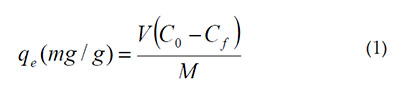
CIENCIAS EXACTAS Y NATURALES-Artículo Científico
REMOCIÓN DE PLOMO POR BIOMASAS RESIDUALES DE CÁSCARA DE NARANJA (Citrus sinensis) Y ZURO DE MAÍZ (Zea mays)
REMOVAL OF LEAD USING RESIDUAL BIOMASS OF ORANGE PEEL AND CORNCOB
Candelaria Tejada Tovar1, Adriana Herrera2, Juan Núñez Zarur3
1 M.Sc. Ingeniería Ambiental, M.Sc. Educación. Universidad de Cartagena, Avenida del Consulado Calle 30 No. 48-152, Cartagena, Bolívar, Colombia, e-mail: ctejadat@unicartagena.edu.co
2 Ph.D. Ingeniería Química, Docente. Universidad de Cartagena, Colombia, e-mail: aherrerab2@unicartagena.edu.co
3 Ingeniero Químico. Universidad de Cartagena, Colombia, e-mail: jrzarur@gmail.com
Rev. U.D.C.A Act. & Div. Cient. 19(1): 169-178, Enero-Junio, 2016
RESUMEN
Actualmente, la contaminación por metales pesados en cuerpos naturales de agua es un problema a resolver, por cuanto es cada vez mayor su concentración. Para tal fin, han sido usadas tecnologías, como la precipitación química, la oxidación, el intercambio iónico, entre otras; sin embargo, muchas de estas resultan poco eficientes si se desean remover contaminantes, especialmente, a bajas concentraciones. En este contexto, en el presente trabajo, se estudió la adsorción como proceso para la remoción de plomo en aguas residuales industriales, usando biomasa residual, a partir de cáscara de naranja y zuro de maíz. Se realizó una comparación entre las biomasas utilizadas, variando el tamaño de partícula y el pH, con el fin de determinar las mejores condiciones de adsorción. Se encontró que las biomasas presentaron mayor capacidad de adsorción a condiciones de tamaño de partícula de 0,5mm, para el zuro de maíz y 1mm, en la cáscara de naranja, a un pH de 6, con valores de remoción de 67,5% y 99,2%, respectivamente. Se utilizaron diferentes modelos para describir la cinética de adsorción de Pb (II), siendo el de mayor ajuste el modelo de pseudo primer orden; por otro lado, el modelo de isoterma que se ajustó mejor a los resultados obtenidos fue el propuesto por Freundlich.
Palabras clave: Adsorción, efluentes, residuos agroindustriales.
SUMMARY
Currently the heavy metal pollution in natural water bodies is a problem to be solved due to their increase in concentration. For this purpose technologies such as chemical precipitation, oxidation, ion exchange and others have been used. Despite this, many of them are not very efficient if low pollutant concentrations has to be removed. Therefiore, in this paper an alternative for adsorption of lead in industrial wastewater, using residual biomass coming from orange peel and corncob was studied. It was realized in order to add a possible value to these residues. A comparison of biomasses used varying the particle size and pH to determine best conditions of adsorption was carried out. It was found that the biomasses exhibited the highest adsorption capacity with a particle size of 0.5mm for corncob and 1mm for orange peel at pH 6, reaching adsorption values of 67.5% and 99.2%, respectively. Different models were used to describe the adsorption kinetics of Pb (II) into orange peel and corncob. The most predictive model was Pseudo First Order. On the other hand, the isotherm model that best described the results was the one proposed by Freundlich.
Key words: Adsorption, agro-industrial waste, effluent.
INTRODUCCIÓN
Hoy por hoy, el incremento de los contaminantes tóxicos, entre estos los metales pesados provenientes de efluentes industriales en los recursos hídricos, es uno de los problemas ambientales más graves. Estas sustancias tienden a persistir por un largo periodo de tiempo en el medio ambiente y son consideradas como potenciales devastadores de los ecosistemas, ya que no solo comprometen el bienestar y el equilibrio de la fauna y la flora, también perturban la salud de los habitantes de los sectores aledaños al punto de vertido, debido a su capacidad de acumulación en los distintos organismos (Farooq & Kozinski, 2010).
Elevadas concentraciones de iones metálicos pueden ocasionar diversas afecciones en la salud, como erupciones cutáneas, malestar de estómago, problemas respiratorios, debilitamiento del sistema inmune, daño en los riñones e hígado, alteración del material genético, cáncer, alteraciones neurológicas e, inclusive, la muerte (Dubey & Krishna, 2007). Las concentraciones de este tipo de sustancias, en algunos casos, sobrepasa el valor permitido por la legislación Colombiana, siendo para el plomo, un máximo 0,5mg/L, de acuerdo a la resolución número 0631 del 2015 (FENAVI, 2015).
En los últimos años, se han implementado diferentes alternativas para el tratamiento de aguas residuales industriales, entre las que se pueden mencionar, la precipitación química, la osmosis inversa, el intercambio iónico, entre otras; sin embargo, estos métodos han resultado costosos e ineficientes, pues no logran remover grandes cantidades de iones metálicos; además, generan lodos durante el proceso, siendo más problemáticos de resolver (Tejada et al. 2015a; TorabMostaedi et al. 2013). Ante esta situación, surge la bioadsorción, como una alternativa prometedora para la remoción de iones metálicos presentes en aguas residuales, ya que logra remover grandes porcentajes de iones metálicos, usando biomasas lignocelulósicas, como materiales adsorbentes. El proceso de adsorción, sea cual sea la naturaleza del adsorbente, se puede explicar cinéticamente en cuatro pasos: primero, una transferencia del metal desde la fase líquida hasta la película que rodea al adsorbente, mediante un proceso de difusión; luego, una transferencia, a través de la película líquida hacia el adsorbente, donde es importante tener en cuenta el coeficiente de transferencia de masa global y la resistencia ejercida por la película al fenómeno ocurrido; posteriormente, se da la difusión del metal en el adsorbente, ya sea en el líquido intraparticular o de un sitio del adsorbente a otro, para que, finalmente, se facilite el proceso de adsorción, químico o físico, donde se dan, como tal, las interacciones del metal en los sitios activos del adsorbente (Netzahuatl-Muñoz et al. 2010).
Entre los materiales ampliamente estudiados y con excelentes resultados para la remoción de metales pesados, se encuentran: zuro de maíz y cáscara de naranja, con plomo y níquel (Tejada et al. 2015a); aserrín de pino, con plomo (II) (Momcilovic et al. 2011); bagazo de palma, con plomo (Tejada et al. 2015b); cáscara de yuca y limón, con mercurio (Tejada et al. 2015c); bagazo de caña, con plomo (II) (Hamza et al. 2013); cáscara de nuez, con cromo (Altun & Pehlivan, 2012), entre otras. La bioadsorción presenta muchas ventajas frentes a otras técnicas convencionales, como bajo costo, alta eficiencia, minimización de productos químicos y lodos biológicos. Además, permite la regeneración de los biosorbentes y la posibilidad de recuperación de metales (Netzahuatl-Muñoz et al. 2010).
En años recientes, se han reportado diversos estudios referentes a la bioadsorción de metales pesados con biomasas residuales, destacándose el trabajo reportado por Zheng & Meng (2016), quienes realizaron un estudio de adsorción de Cd (II) en solución acuosa, a partir de zuro de maíz. Los resultados obtenidos mostraron que más del 90% de iones de cadmio se alcanzó a pH entre 2 y 7, mientras que la adsorción se incrementó de 73,2% a 98,0%, con el aumento de las dosis de adsorbente y una temperatura más alta favoreció la adsorción. El modelo que mejor se ajustó a las cinéticas de equilibrio fue pseudo-segundo orden y para las isotermas, el modelo de Langmuir.
Tejada et al. (2015a) realizaron adsorción competitiva de Ni (II) y Pb (II) sobre zuro de maíz y cáscara de naranja, encontrando que los modelos Freundlich y Langmuir ofrecen un buen ajuste de los datos experimentales. Dedujeron una capacidad máxima de adsorción de 2687 mg/g, para el plomo y 1016,9mg/g, para el níquel, utilizando la biomasa de zuro de maíz. En el caso de la biomasa de cáscara de naranja, se determinó una adsorción de 3224,07mg/g, para el plomo y 390,59 mg/g, para el níquel, mostrando que son materiales que podrían ser usados para la remoción de estos metales, aun cuando estén en solución binaria, pues se siguen obteniendo altas capacidades de sorción.
En adición, se han reportado estudios de adsorción de metales pesados usando carbones activados químicamente, entre los cuales, se encuentra el trabajo publicado por Ghasemi et al. (2014), quienes emplearon carbón activado químicamente con ácido fosfórico (H3PO4), para remoción de plomo, determinando una adsorción de 95,8%, con una concentración de adsorbente de 80,645mg/g, a un pH de 4.
El plomo es utilizado en diversas actividades industriales, como la elaboración de insecticidas, de baterías, de pinturas, de aleaciones, de tuberías de agua, de acabado de metales, de fertilizantes, de pesticidas y de contenedores de alimentos. La Agencia de Protección Ambiental (EPA), por sus siglas en idioma inglés, permite un nivel de plomo en agua potable de sólo 0,015mg/L, pero muchas de estas industrias superan los niveles de concentración del metal en sus efluentes (EPA, 2002).
En esta investigación, se realizó un estudio comparativo de la capacidad de adsorción de Pb (II) entre biomasa residual de cáscara de naranja y zuro de maíz, teniendo en cuenta que ambos biomateriales son de fácil tratamiento, alta disponibilidad, fácil consecución y bajo costo. Los ensayos de adsorción, se realizaron en sistemas batch, analizando las biomasas sin modificación y modificadas químicamente con ácido cítrico.
MATERIALES Y MÉTODOS
Preparación de los bioadsorbentes. Las biomasas fueron recolectadas en el mejor estado posible, para evitar su pronta descomposición y garantizar la eficiencia del proceso. Ambos materiales fueron lavados con abundante agua destilada, con el fin de eliminar taninos, resinas de azúcares reductores y demás impurezas, que puedan intervenir en el proceso de adsorción. Posteriormente, fueron secadas en horno a 90°C, durante 24h; a continuación, el tamaño de las mismas fue reducido, mediante un molino de rodillo, durante 20min; la clasificación, se llevó a cabo en una tamizadora, obteniendo tamaños de 0,355mm, 0,5mm y 1mm.
Caracterización de los adsorbentes. Una vez preparados los materiales adsorbentes, se procedió a la caracterización determinando el análisis elemental de la biomasa e identificando los grupos funcionales, responsables de la adsorción de los iones de Pb (II), mediante un análisis FTIR, Espectros de Infrarrojo con Transformada de Fourier.
Modificación del zuro de maíz con ácido cítrico. Una vez pre-tratado el zuro de maíz, se procedió a realizar la modificación con ácido cítrico; para tal fin, se mezcló 13,5g de biomasa, con 33,75mL de una solución de ácido cítrico 0,6M. La mezcla fue dejada en agitación contaste por 2 h, a una temperatura de 60°C; posterior a este tiempo, la biomasa se lavó con abundante agua desionizada; luego, fue secada en un horno por 24 h, a 55°C, de acuerdo a la metodología recomendada por Altun & Pehlivan (2012).
Reticulación de la cáscara de naranja con cloruro de calcio. La pectina, presente en la cáscara de naranja, se puede reticular con diferentes sustancias químicas, para mejorar su capacidad de adsorción; el cloruro de calcio (CaCl2) es una de ellas (Hannachi et al. 2010). Para realizar la modificación, se tomaron 20g de biomasa tratada seca, se colocaron en 500mL de una solución de CaCl2 0,2M, la mezcla se mantuvo en agitación constante a 200 rpm, durante 24 h; luego del tratamiento con CaCl2, el material bioadsorbente se lavó varias veces con agua destilada; posteriormente, fue secado a 40°C en un horno durante 3 h, de acuerdo con la metodología recomendada por Hannachi et al. (2010).
Preparación del agua residual sintética y ensayos de bioadsorción. Para la realización de los ensayos de adsorción, se usó un Shaking incubator IN-666, que contenía, previamente, un Erlenmeyer con 0,5g de biomasa y una solución de Pb (II), a 100 ppm, que se preparó añadiendo 0,1g de Pb (NO3)2 a 1L de agua desionizada; se utilizó este valor, simulando la concentración promedio de los efluentes industriales. Los ensayos de adsorción, se llevaron a cabo a una temperatura de 25°C y 150rpm, durante 2 h. Los valores de pH evaluados fueron 2, 4 y 6, los cuales, fueron controlados mediante la adición de HCl y NaOH (Farooq & Kozinski, 2010).El análisis de la concentración final, se realizó mediante espectroscopía de absorción atómica a 283,3nm. Después de estos ensayos, la capacidad de adsorción se calculó mediante la fórmula:
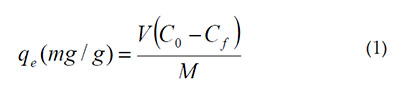
Donde, qe es la capacidad de adsorción en equilibrio (mg/g); Co y Cf son las concentraciones iniciales y el equilibrio (mg/l) de Pb (II) en la solución; V es el volumen (L) de solución tomada y M es la masa (g) de adsorbente usado.
Cinética e isotermas de adsorción. Para determinar el tiempo de equilibrio de adsorción, se llevó a cabo la cinética, tomando una alícuota de 5 mL, cada periodo de tiempo, entre 10 y 280 min; las isotermas de adsorción, se realizaron con el propósito de describir la cantidad de plomo adsorbido en la interfase con la concentración del mismo en el seno de la fase (Hannachi et al. 2010); para la realización de los ensayos, se usaron diferentes concentraciones iniciales, 25, 50, 75 y 100ppm. El estudio de isotermas solo fue realizado en las biomasas sin modificar.
Todas las pruebas fueron realizadas por triplicado, tomando el promedio aritmético de los datos, la consistencia de los mismos fue verificada, calculando la desviación estándar. El análisis de los datos fue hecho haciendo uso de la herramienta Solver de Excel.
RESULTADOS Y DISCUSIÓN
La composición química de las cáscaras de naranja y de zuro de maíz, se determinó a través de diversas técnicas analíticas, encontrándose que el elemento con mayor porcentaje-en ambas biomasasfue el carbono, con un 44,43%, para la cáscara de naranja y 39,89%, para el zuro de maíz (Método Analítico AOAC 949.14). En adición, se estableció por las técnicas de digestión ácida y termogravimetría, un contenido de Pectina y Celulosa de 18,15% y 14,28% para la cáscara de naranja, mientras que el zuro de maíz presentó valores de 7,98% y 13,08%, respectivamente.
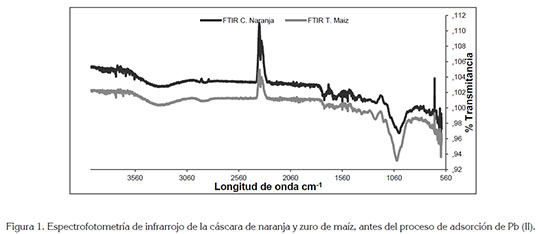
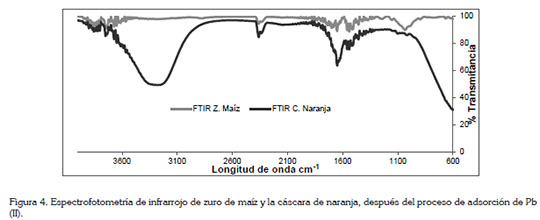
En la figura 1, se muestra el análisis FTIR de la cáscara de naranja y de zuro de maíz, para determinar los grupos funcionales presentes en la biomasa y que podrían interferir en la adsorción del metal en estudio. En el espectro de la cáscara de naranja, los picos alrededor de 3330cm-1, corresponden a las vibraciones O-H, debido al estiramiento de alcoholes, de fenoles y de ácidos carboxílicos, en la pectina, en la celulosa y en la lignina; por lo tanto, se estableció la presencia de hidroxilos ''libre'' en la superficie adsorbente, tal como lo reporta Junxiong et al. (2009). Para el espectro del zuro de maíz, se puede observar una banda sólida y amplia con enlaces de hidrógeno O-H, centrada a 3405cm-1; además, una banda de estiramiento C-O apareció en el espectro a 1012cm-1. Por otro lado, las bandas de absorción próximas a 1600cm-1 podrían estar relacionadas con las vibraciones del esqueleto aromático de la lignina; asimismo, los picos a 1374 y 1238cm-1, se asocian con la hemicelulosa de las biomasas (Leyva-Ramos et al. 2012). Wan & Hanafiah (2008) demuestran que para la remoción de plomo usando bagazo de caña, que contenía cerca de un 50% de celulosa, 27% de poliosas y 23% de lignina, conocidos por la gran cantidad de grupos hidroxilos y fenólicos, son los responsables directos de la remoción metálica. En general, los principales componentes de la cáscara de naranja y el zurro de maíz son proteínas, pectinas, celulosas, pigmentos y lignina, por lo cual, el espectro muestra numerosos picos de absorción, indicando la naturaleza compleja del material.
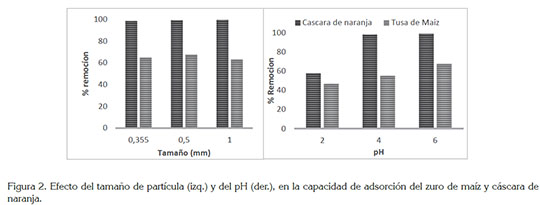
Efecto del tamaño y pH en la adsorción. La influencia de los tamaños de partículas 0,355, 0,5 y 1mm evaluados, se muestran en la figura 2. Se observa que a un tamaño de partícula de 0,5 mm, para el zuro, se reporta un mayor porcentaje de remoción del metal, mientras que en la cáscara de naranja fue el tamaño 1 mm. Para el caso del zuro de maíz, la mayor adsorción se debe a que al disminuir el tamaño de las partículas, el número de centros activos por unidad de masa es mayor, como resultado del mayor área superficial que posee la partícula pequeña, pues a mayor área de la superficie nterna aumenta su cantidad de poros por unidad de masa y, por ende, aumentaría la cantidad de metal adsorbido; sin embargo, en el menor tamaño, disminuyó el porcentaje de adsorción, debido a la posible aglomeración de las partículas. En cuanto al pH, se observó que el aumento del porcentaje de adsorción sobre el zurro de maíz se dio a medida que aumenta el pH. A valores superiores de pH (pH=6), se incrementa la concentración de iones OH-, induciendo cambios en la superficie del adsorbente y aumentando la adsorción de los iones metálicos; esto se debe a que la superficie del bioadsorbente podría estar protonada, lo que favorecería la captación de plomo en su forma aniónica. Estos resultados coinciden con otras investigaciones: Onwu & Ogah (2010) reportan el potencial de la cáscara de manzana blanca para la remoción de Pb (II), siendo un proceso altamente dependiente del pH, obteniendo un pH óptimo de 7, con el cual, se obtuvo una remoción máxima de 8,5mg/g; García-Rosales & Colín-Cruz (2010) lograron la eliminación de Pb (II) con tallos de maíz, encontrando una capacidad de adsorción máxima de 80mg/g y un pH óptimo de 6.
Cinética e isotermas de adsorción. Para estudiar la cinética de adsorción, los modelos cinéticos usados fueron pseudoprimer orden, pseudo-segundo orden, Elovich y difusión intraparticular. Estos modelos matemáticos de ajuste no lineal, se desarrollaron usando la herramienta Microsoft Excel Solver y el ajuste de los mismos se muestra en la figura 3.
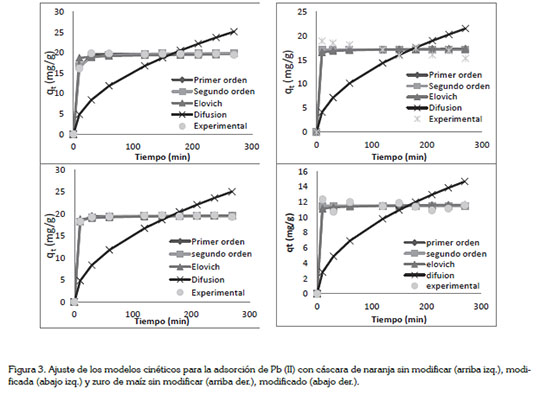
Se encontró que todos estos modelos se ajustan a los datos experimentales de la adsorción de Pb (II), con excepción del modelo de difusión intraparticular. Para ambas biomasas, este modelo muestra una tendencia totalmente diferente al de los datos obtenidos en la experimentación, esto significa que la adsorción de plomo no se da al interior de los poros de las biomasas en estudio, dándose en sitios heterogéneos de las mismas, tal como lo reportan Pinzón-Bedoya & Cardona (2010) y Pérez et al. (2009).
El modelo cinético con mejor ajuste estadístico para las biomasas modificadas y no modificadas fue el modelo de pseudo-primer orden; de acuerdo a este modelo, los iones serán adsorbidos por un sitio activo, de acuerdo a Pérez et al. (2009).
En la tabla 1, se muestran los resultados del ajuste a los modelos de isotermas. Se encontró que el modelo que mejor describe la adsorción de Pb (II), para el zuro de maíz y cáscara de naranja sin modificar y modificada, es el de Freundlich, mientras que para el zuro de maíz modificado, lo hace el de Langmuir. En general, se establece que la superficie de las biomasas es heterogénea y durante el proceso de adsorción se forman multicapas en la superficie de los biomateriales y los sitios activos que pudiesen estar de desorción son ocupados, primero, por enlaces fuertes y dicha fuerza va decreciendo, a medida que estos son ocupados por los iones de Pb (II), de acuerdo a Kwon et al. (2010); cabe destacar que la desorción es el fenómeno donde la partícula ya adsorbida se separa del biomaterial. De la capacidad de adsorción, se muestra que las biomasas modificadas exhiben menor capacidad y se podría deber a que la reacción de carboxilación, que se debería dar con la modificación química de la biomasa, no se dio completamente y no hubo adición de estos grupos en el biomaterial, por tanto, se sugiere realizar otras modificaciones a los biomateriales, que puedan insertar grupos carboxilos e hidroxilos, a la estructura de las mismas.
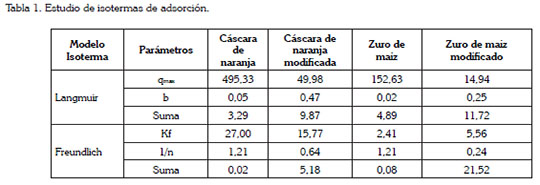
En general, se comprobó que la cáscara de naranja y el zuro de maíz presentan una gran capacidad de adsorción de iones Pb (II) en agua sintética, que lograron remover porcentajes de 99,2 y 67,5%; sin embargo, una vez modificadas la capacidad de adsorción de ambas biomasas se vio ligeramente disminuida, por lo que se sugiere experimentar otro tipo de agentes modificantes.
Las mejores condiciones, en las cuales se llevó a cabo el proceso de adsorción de iones de Pb (II), se lograron usando un tamaño de partícula de 0,5mm, para el zuro de maíz y 1mm, en el caso de cáscara de naranja, se esperaría que al disminuir el tamaño de partícula de las biomasas, aumentaría la capacidad de adsorción de los iones metálicos, puesto que los procesos de adsorción están directamente relacionado con el área de contacto entre el material adsorbente y la fase líquida; sin embargo, a pequeños tamaños de partícula, se puede dar la aglomeración de las mismas, lo que interfiere en la adsorción metálica. Además, se estableció como pH óptimo de adsorción un valor de 6.
El ajuste de los datos experimentales obtenidos para los diferentes modelos seleccionados indican que el modelo de pseudo segundo orden es el modelo matemático que mejor describe la cinética de adsorción de Pb (II); por otro lado, el modelo de isoterma que mejor describe los resultados obtenidos fue el propuesto por Freundlich, con lo cual, se comprobó que el proceso de adsorción está controlado por reacción química, como se encuentra referenciado en la bibliografía consultada.
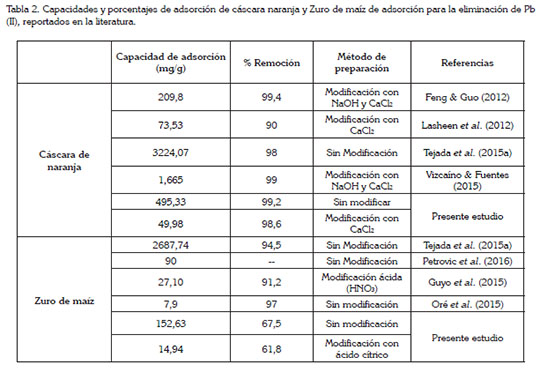
Comparación entre las capacidades y porcentajes de adsorción. La tabla 2 presenta una comparación entre los valores reportados en literatura y los obtenidos en el presente estudio, referentes a las capacidades y los porcentajes de adsorción para la eliminación de Pb (II), usando la cáscara de naranja y el zuro de maíz. Las dos biomasas, que se investigaron en este estudio, tienen una alta capacidad de adsorción para la eliminación de Pb (II) en comparación con investigaciones previas de residuos agroindustriales sin y con modificación. Oré et al. (2015) investigaron el zuro de maíz como adsorbente para Pb (II), en solución acuosa; Petrovic et al. (2016), también estudiaron el zuro de maíz, para este mismo metal. Las capacidades de adsorción de estos dos estudios fueron menores en comparación con la del zuro de maíz sin modificar, del presente estudio (Tabla 2), aunque se destaca una ligera disminución en los porcentajes de remoción al modificar las biomasas, en comparación con las investigaciones presentadas. Por otro lado, para la cáscara de naranja, la capacidad de adsorción siempre fue mayor para la mayoría de los trabajos revisados en la literatura, con porcentajes de adsorción mayores o similares a sus correspondientes, en la tabla mencionada, lo que muestra una ventaja por tener mejor característica de adsorción en comparación con los trabajos investigados anteriormente. Cabe destacar que la cáscara de naranja se puede utilizar sin ninguna modificación, por ser tan buen adsorbente para la eliminación de Pb (II) en solución acuosa, lo que hace que sea de bajo costo y amigable con el medio ambiente.
Agradecimientos: Se agradece a COLCIENCIAS y a la Universidad de Cartagena, por su apoyo en la realización del presente estudio, en el marco del programa de jóvenes investigadores, convenio No 0722-2013. Conflictos de intereses: El manuscrito fue preparado y revisado con la participación de todos los autores, quienes declaramos que no existe conflicto de intereses que ponga en riesgo la validez de los resultados presentados.
BIBLIOGRAFÍA
1. ALTUN, T.; PEHLIVAN, E. 2012. Removal of Cr (VI) from aqueous solutions by modified walnut shells. Food Chem.132:693-700.
2. DUBEY, S.P.; KRISHNA, G. 2007. Adsorption of chromium (VI) on low cost adsorbents derived from agricultural waste material: A comparative study. J. Hazard. Mat.145: 465-470.
3. EPA. 2002. List of Drinking Water Contaminants & MCLs. Disponible desde internet en: http://www.epa.gov/safewater/mcl.html (con acceso 20/04/14).
4. FAROOQ, U.; KOZINSKI, J. 2010. Biosorption of heavy metal ions using wheat based biosorbents-A review of the recent literature. Bioresource Technol. 101:5043-5053.
5. FEDERACIÓN NACIONAL DE AVICULTORES DE COLOMBIA -FENAVI-. 2015. Disponible desde internet en: http://www.fenavi.org/index.php?option=com_content&view=article&id=3167:resolucion- 0631-de-2015&catid=393:uso-de-recursos. Consultado el 20 noviembre de 2015.
6. FENG, N.; GUO, X. 2012. Characterization of adsorptive capacity and mechanisms on adsorption of copper, lead and zinc by modified orange peel. Transactions Nonferrous Metals. 22(5):1224-1231.
7. GARCÍA-ROSALES, G.; COLÍN-CRUZ, A. 2010. Biosorption of lead by maize (Zea mays) stalk sponge. J. Environ. Manag. 91:2079-2086.
8. GHASEMI, M.; NAUSHAD, M.; GHASEMI, N.; KHOSRAVI, Y. 2014. A novel agricultural waste based adsorbent for the removal of Pb(II) from aqueous solution: kinetics, equilibrium and thermodynamic studies. J. Industr. Eng. Chem. 20:454-461.
9. GUYO, U.; MHONYERA, J.; MOYO, M. 2015. Pb(II) adsorption from aqueous solutions by rawand treated biomass of maize stover - Acomparative study. Process Safety Environm. Prot. 93:192-200.
10. HAMZA, I.A.A.; MARTINCIGH, B.S.; NGILA, J.C.; NYAMORI, V.O. 2013. Adsorption studies of aqueous Pb(II) onto a sugarcane bagasse/multi-walled carbon nanotube composite. Phys. Chem. Earth. 66:157-166.
11. HANNACHI, Y.; SHAPOVALOV, N.A.; HANNACHI, A. 2010. Adsorption of nickel from aqueous solution by the use of low-cost adsorbents. Korean J. Chem. Eng. 27:152-158.
12. JUNXIONG, C.; LONGZHE, C.; YANXIN, W.; CHENFU, L. 2009. Effect of functional groups on sludge for biosorption of reactive dyes. J. Environ. Sci. 21:534-538.
13. KWON, J.S.; YUN, S.T.; LEE, J.H.; KIM, S.O.; JO, H.Y. 2010. Removal of divalent heavy metals (Cd, Cu, Pb, and Zn) and arsenic (III) from aqueous solutions using scoria: kinetics and equilibria of sorption. J. Hazard. Mater. 174:307-313.
14. LASHEEN, M.; AMMAR, N.; HANAN, I. 2012. Adsorption/ desorption of Cd(II), Cu(II) and Pb(II) using chemically modified orange peel: equilibrium and kinetic studies. Solid State Sci. 14:202-210.
15. LEYVA-RAMOS, R.; LANDIN-RODRIGUEZ, L.E.; LEYVA-RAMOS, S.; MEDELLIN-CASTILLO, N.A. 2012. Modification of corncob with citric acid to enhance its capacity for adsorbing cadmium (II) from water solution. Chem. Eng. J. 180:113-120.
16. MOMCILOVIC, M.; PURENOVIC, M.; BOJIĆ, A.; ZARU- BICA, A.; RANĐELOVIC, M. 2011. Removal of lead (II) ions from aqueous solutions by adsorption onto pine cone activated carbon. Desalination. 276:53-59.
17. NETZAHUATL-MUÑOZ, A.; CRISTIANI-URBINA, M.; CRISTIANI-URBINA, E. 2010. Estudio cinético de la remoción de cromo hexavalente y de cromo total por la corteza del árbol de pirul. Rev. Cub. Quím. 22(3):3-8.
18. ONWU, F.K.; OGAH, S.P. 2010. Studies on the effect of pH on the sorption of cadmium (ll), nickel (II), lead (II) and chromium (VI) from aqueous solutions by african white star apple (Chrysophyllum albidium) shell. J. Biotechn. 9(42):7086-7093.
19. ORÉ, J.F.; LAVADO, M.C.; BENDEZÚ, M.S. 2015. Biosorción de Pb (Ii) de aguas residuales de mina usando el marlo de maíz (Zea mays). Rev. Soc. Quím. Perú. 81(2):122-134.
20. PÉREZ, A.; MESEGUER, V.; SAENZ, O.; LLORENS, M. 2009. Biosorption of chromium (III) by orange (Citrus cinensis) waste: Batch and continuous studies. Chem. Eng. J. 155:199-206.
21. PETROVIC, M.; SOSTARIC, T.; STOJANOVIC, M.; MILOJKOVIC, J.; MIHAJLOVIC, M.; STANOJEVIC, M.; STANKOVIC, S. 2016. Removal of Pb2+ ions by raw corn silk (Zea mays L.) as a novel biosorbente. J. Taiwan Inst. Chem. Eng. 58:407-416.
22. PINZÓN-BEDOYA, M.; CARDONA, A. 2010. Influencia del pH en la bioadsorción de Ni (III) sobre cáscara de naranja: Determinación de las condiciones de operación en proceso discontinuo. Rev. Facultad Ciencias Básicas. 8(1):45-53.
23. TAN, G.; HONGYAN, Y.; YONG, L.; DAN, X. 2010. Removal of lead from aqueous solution with native and chemically modified corncobs. J. Hazard. Mater. 174(1-3):740-745.
24. TEJADA, C.; HERRERA, A.P.; NUÑEZ, J.R. 2015a. Adsorción competitiva de Ni (II) y Pb (II) sobre materiales residuales lignocelulósicos. Invest. Andinas.17(31):1355-1367.
25. TEJADA, T.C.; RUIZ, P.E.; GALLO, J.; BOHORQUEZ, J.M. 2015b. Evaluación de la biosorción con bagazo de palma africana para la eliminación de Pb(II) en solución. Prospect. 13(1):59-67.
26. TEJADA, C.; VILLABONA, O.A.; GARCES, J.L. 2015c. Kinetics of adsorption in mercury removal using cassava (Manhiot esculenta) and lemon (Citrus limonum) wastes modified with citric acid. Ingeniería y Universidad. 19(2):37-52.
27. TORAB-MOSTAEDI, M.; ASADOLLAHZADEH, M.; HEMMATI, A.; KHOSRAVI, A. 2013. Equilibrium, kinetic, and thermodynamic studies for biosorption of cadmium and nickel on grapefruit peel. J. Taiwan Inst. Chem. Eng. 44:295-302.
28. VIZCAÍNO MENDOZA, L.; FUENTES MOLINA, N. 2015. Biosorción de Cd, Pb y Zn por biomasa pretartada de algas rojas, cáscara de naranja y tuna. Cienc. Ing. Neogranadina. 25(1):43-60.
29. WAN, W.S.; HANAFIAH, M.A.K.M. 2008. Removal of heavy metal ions from wastewater by chemically modified plant wastes as adsorbents: A review. Biores. Techn. 99:3935-3948.
30. ZHENG, L.; MENG, P. 2016. Preparation, characterization of corn stalk xanthates and its feasibility for Cd (II) removal from aqueous solution. J. Taiwan Inst. Chem. Eng. 58:391-400.
Recibido: Junio 10 de 2015 Aceptado: Enero 25 de 2016
Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.