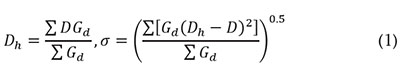
CIENCIAS EXACTAS Y NATURALES-Artículo Científico
IMPLEMENTACIÓN DE ÓSMOSIS DIRECTA Y NANOADITIVOS MAGNÉTICOS PARA DESALINIZACIÓN DE AGUA
IMPLEMENTATION OF FORWARD OSMOSIS AND MAGNETIC NANOADDITIVES FOR WATER DESALINATION
Adriana Herrera1, Laura Vela2, Gustavo Morales3, Ildefonso Castro4*
1 Ingeniera Química, M.Sc., Ph.D. Ingeniería Química. Universidad de Cartagena, Facultad de Ingeniería, Programa de Ingeniería Química, Grupo de Investigación Nanomateriales Multifuncionales. Avenida El Consulado, Calle 30 No. 48-152, Cartagena, Colombia, e-mail: aherrerab2@unicartagena.edu.co
2 Ingeniera Química. Universidad de Cartagena, Facultad de Ingeniería, Programa de Ingeniería Química. Avenida El Consulado, Calle 30 No. 48-152, Cartagena, Colombia, e-mail: lacryvepa@msn.com
3 Ingeniero Químico. Universidad de Cartagena, Facultad de Ingeniería, Programa de Ingeniería Química. Avenida El Consulado, Calle 30 No. 48-152, Cartagena, Colombia, e-mail: gamor07@gmail.com
4 Químico Farmacéutico, Especialista en Ingeniería Sanitaria y Ambiental, M.Sc. Ingeniería Ambiental. Universidad de Cartagena, Facultad de Ingeniería, Maestría en Ingeniería Ambiental. Avenida El Consulado, Calle 30 No. 48-152, Cartagena, Colombia, e-mail: foncas2001@yahoo.com
Rev. U.D.C.A Act. & Div. Cient. 19(1): 199-206, Enero-Junio, 2016
RESUMEN
Se evaluó, a escala laboratorio, la desalinización por ósmosis directa de agua de mar sintética. Este sistema utilizó un agente osmótico comercial y un agente osmótico preparado, a partir de azúcar/glucosa anhídrida 50/50%p/p y nanopartículas magnéticas, modificadas con carboximetil celulosa (MNp-CMC). De acuerdo a mediciones de dispersión de luz dinámica, las nanopartículas exhibieron un tamaño hidrodinámico de 173±53nm. Un valor de flux de agua desalinizada de 1,3LMH fue determinado al adicionar 112,5mg/ mL de MNp-CMC al agente osmótico sintético, produciéndose un aumento del 9,2%, comparado al flux obtenido sin el uso del nanoaditivo. En adición, se evaluó la remoción de las nanopartículas magnéticas, aplicando un campo electromagnético externo. A pesar que se observó una disminución en la concentración de nanopartículas presentes en el efluente, luego de ocho ciclos de separación magnética, se detectó, por espectrofotometría de absorción atómica, una concentración de 227mg Fe/L en el agua desalinizada, lo cual, supera el valor máximo aceptable de hierro en aguas potables (0,3mg Fe/L), reflejando así la necesidad de mejorar el proceso de separación magnética, para el empleo de nanoaditivos magnéticos, en procesos de desalinización de agua, por osmosis directa.
Palabras clave: Magnetita, nanomateriales, celulosa, flux, desalinización.
SUMMARY
At a laboratory scale by means of a direct osmosis process the desalination of a synthetic seawater was evaluated. This system employed a commercial osmotic and a synthetic osmotic agent prepared from sugar/anhydrous glucose 50/50%w/w and magnetic nanoparticles modified with carboxymethyl cellulose (MNp-CMC). According to measurements from dynamic light scattering, nanoparticles exhibited a hydrodynamic size of 173±53nm. A desalinated water flux of 1,3LMH was determined by the addition of 112,5mg/mL of MNp-CMC to the synthetic osmotic agent, showing an increase of 9.2% as compared to the one obtained without the use of the nanoadditives. Additionally, the magnetic decantation of the nanoparticles by applying an external electromagnetic field was evaluated. Although a concentration decrease of nanoparticles in the water effluent after eight cycles of magnetic separation was detected; by atomic absorption spectroscopy a concentration of 227mg Fe/L in the desalinized water was identified, which is higher than the maximum iron content allowed in drinking water (0.3mg Fe/L), showing that more work is required in order to improve the process of magnetic separation for the application of magnetic nanoadditives in the desalinization of water by direct osmosis systems.
Key words: Magnetite, nanomaterials, cellulose, flux, desalinization.
INTRODUCCIÓN
La escasez de agua potable en el mundo es una consecuencia del crecimiento exagerado de la población humana. Este problema, se ha magnificado en las últimas décadas, debido a factores, como la ubicación geográfica de las grandes ciudades y el desarrollo agropecuario e industrial. La falta de este importante recurso ha afectado el bienestar de los seres humanos y el desarrollo de la biota, en general (Gohari et al. 2013; García et al. 2015).
Dentro de las tecnologías y los procesos que se han desarrollado para mitigar la escasez de agua potable, se encuentran las técnicas de desalinización, que se fundamentan en el aprovechamiento de la gran cantidad de agua salada, que existe en la mayor parte de las regiones del mundo (Zhao et al. 2012; Kwan et al. 2015). Los métodos de desalinización más empleados actualmente son la ósmosis inversa y la destilación, pero su alta demanda energética ha impulsado la exploración de métodos más económicos y viables, tales como los tratamientos por ósmosis directa (Jamil et al. 2015; Nguyen et al. 2015).
El método de ósmosis directa aprovecha la diferencia de presión osmótica que existe entre una solución concentrada, conocido como agente osmótico y un sin número de soluciones acuosas, como las aguas residuales (Achilli et al. 2010; Holloway et al. 2015). Este proceso conlleva el flujo de agua desde la solución menos concentrada (baja presión osmótica) hasta la solución más concentrada (agente osmótico), las cuales, pasan a través de una membrana semipermeable, que rechaza moléculas e iones contaminantes (Jamil et al. 2015).
Generalmente, los procesos de desalinización de agua por ósmosis directa involucran dos etapas: la dilución osmótica de la solución concentrada y la obtención de agua dulce a partir del agente osmótico diluido (Achilli et al. 2010; Zhao et al. 2012). Al final de la primera etapa del proceso no se obtiene agua pura sino una mezcla de agua dulce y agente osmótico; por tal motivo, se hace necesario efectuar un mecanismo de separación para remoción del agente osmótico y obtención de agua, apta para el consumo humano (Valladares Linares et al. 2014; Deshmukh et al. 2015). Recientemente, se ha investigado la aplicación de nanopartículas magnéticas modificadas con polímeros hidrofilicos, para la desalinización de agua de mar, por ósmosis directa (Ling et al. 2010; Qingchun et al. 2011); esto se debe, a las propiedades magnéticas de estas nanopartículas, que permite su separación, aplicando un campo magnético externo, una vez concluido el proceso de desalinización.
En el presente trabajo, se evaluó, a escala laboratorio, la desalinización de agua de mar sintética, por el método de ósmosis directa. Para esto, se sintetizaron nanopartículas de magnetita modificadas con el polímero hidrofílico carboximetil celulosa (MNp-CMC). Estas nanopartículas fueron incorporadas a un agente osmótico, preparado a partir de azúcar/glucosa anhídrida al 50/50%p/p. En adición, se estudió la posibilidad de remoción de las nanopartículas, usando una malla metálica, con un campo electromagnético externo.
MATERIALES Y MÉTODOS
Los reactivos químicos empleados para la síntesis y la modificación de las nanopartículas magnéticas fueron adquiridos como reactivos químicos de alta pureza, entre el 97 y 99%; entre estos, cloruro de hierro II, cloruro de hierro III, 3-aminopropil trietoxisilano (APS), sodio carboximetil celulosa (CMC) 90×103 g/mol, sulfoxido de dimetilo (DMSO), hidróxido de amonio 29 %v/v, 1-etil-3-(3-dimetil aminopropil) carbodimida (EDC) y N-hidroxisucinimida (NHS). Para el sistema de osmosis directa, se empleó una membrana comercial de triacetato celulosa, adquirida en la empresa Hydration Technology Innovation.
Las nanopartículas de magnetita se sintetizaron, utilizando el método de coprecipitación, a partir de una solución de cloruro férrico 0,36M y cloruro ferroso 0,18M, con adición de hidróxido de amonio, a 80°C y pH 8,0 (Herrera et al. 2008). Una vez sintetizadas las nanopartículas, se suspendieron en DMSO, al 1,5%p/v, agregando 5mL del reactivo APS, 1,0mL de agua desionizada y 0,1mL de ácido acético. Esta mezcla reactiva, se llevó a un shaker, a temperatura ambiente, durante 72 horas.
Para lograr la modificación con CMC, se suspendieron 0,1g de las nanopartículas cubiertas con el APS, en 10mL de agua desionizada, utilizando un baño ultrasónico, por 15min. A esta suspensión, se le ajustó el pH en un valor de 4,0 y se refrigeró a 4°C. Posteriormente, se preparó una solución, disolviendo 0,1g de CMC, en 7,5mL de agua desionizada, se ajustó su pH en un valor de 4,8 y se agregaron 12,5mg de EDC y 7,5mg de NHS. Esta solución fue mezclada con la suspensión acuosa de nanopartículas preparadas a 4°C, llevándose a un shaker, a temperatura ambiente, por dos días. Finalmente, las nanopartículas magnéticas modificadas con el CMC fueron lavadas con etanol, usando una centrifuga a 5000rpm, por 15min, se secaron a temperatura ambiente y se trituraron en un mortero, de acuerdo a la metodología descrita por Herrera et al. (2008).
Se usó un microscopio de barrido electrónico o SEM en alto vacío, marca JEOL JSM 6490 LV, para analizar la morfología y el tamaño de las nanopartículas magnéticas, modificadas con el CMC. En adición, se determinó la composición elemental de estas nanopartículas, usando la técnica de espectroscopía de energía dispersiva de rayos-X o EDX, acoplado al microscopio SEM. El tamaño hidrodinámico de las nanopartículas MNp-CMC fue determinado, usando un equipo de dispersión de luz dinámica DLS HORIBA LB-550. La ecuación 1, se usó para calcular el tamaño hidrodinámico promedio y desviación estándar de estas nanopartículas.
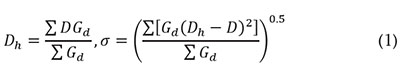
Donde, D es el tamaño de la partícula, obtenido con la función de distribución de tamaño multimodal del equipo; Gd es la intensidad relativa y s es la desviación estándar de los datos (Herrera et al. 2008).
Se construyó una celda de ósmosis directa, compuesta por dos piezas rectangulares, con una cavidad en su interior, como se observa en la figura 1. Para el diseño de este sistema, se usaron placas de acrílico de 9cm de alto, 14cm de ancho y 10mm de espesor, de acuerdo a la metodología descrita por Ling et al. (2010). Se fijó un marco de caucho en el borde interior de cada una de las piezas de acrílico, para evitar fugas de agua, durante el proceso de desalinización. Una membrana semipermeable de triacetato de celulosa se ubicó entre ambas cámaras, procediendo a cerrar el sistema a presión, utilizando tornillos milimétricos. En adición, se acopló una bomba peristáltica Cole Palmer Masterflex de doble canal, con el propósito de facilitar la circulación del agente osmótico, a través de la celda, utilizando mangueras de silicona, con un diámetro interno de 2,38mm.
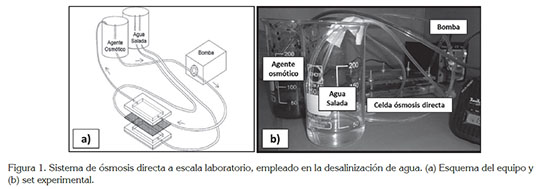
El sistema, se probó utilizando un agente osmótico comercial (AOC), compuesto por dextrosa/fructosa y un agente osmótico sintético (AOS), preparado en el laboratorio, con una relación de azúcar/glucosa anhídrica, preparada 50/50%p/p. En ambos casos, se prepararon soluciones acuosas de los agentes osmóticos electrolíticos, con una concentración de 493,75mg/mL. La solución salina de alimentación, en este caso agua de mar sintética, se preparó al 3,65%p/v, utilizando cloruro de sodio y agua destilada. Esta solución salina, se bombeó a la cavidad inferior de la celda de ósmosis directa hasta llenarla completamente; luego, se circuló la solución del agente osmótico por la parte superior, registrando el tiempo, a partir del momento en que ingresó esta solución a la celda. El proceso de ósmosis directa, se llevó a cabo durante cinco horas. Posteriormente, ambos lados de la celda se drenaron completamente y se lavaron con agua destilada, antes de realizar la siguiente prueba.
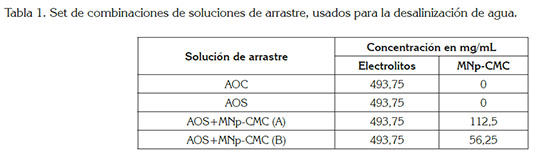
Con el propósito de evaluar el efecto de las nanopartículas magnéticas, como aditivo de un agente osmótico, se prepararon soluciones del AOS, con la adición de 112,5mg/mL y 56,25mg/mL de las nanopartículas, con las que se realizaron las pruebas de desalinización, ya descritas anteriormente. La tabla 1 ilustra el set de combinaciones que se usaron, como soluciones de arrastre, para el proceso de desalinización de agua, usando el sistema de ósmosis directa a escala laboratorio.
El flux de agua LMH y el porcentaje de rechazo de sal, se determinaron usando las ecuaciones 2 y 3 (Ling et al. 2010; Ling & Chung, 2011; Zhao et al. 2012).
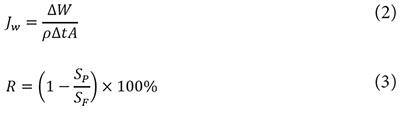
Donde, Jw es el flux de agua en LMH; ΔW es el cambio de peso de la solución de arrastre en gramos; Δt el es el diferencial de tiempo en horas; r es la densidad del agua en g/L; A es el área de la membrana en m2; R es el porcentaje de sales rechazadas; SP es la salinidad del permeado en g/L y SF es la salinidad de la alimentación en g/L. Las mediciones de salinidad se realizaron usando un analizador electroquímico Consort C-931.
Se construyó un dispositivo para remover las nanopartículas magnéticas del agua tratada, usando un campo electromagnético externo. Para ello, se empleó una jeringa plástica, alrededor de la cual, se enrollaron 600 vueltas de alambre de cobre calibre 22, suministrando una corriente alterna de 12 V, por medio de un adaptador. Aplicando la ley de Ampère, se pudo estimar, para este solenoide, un campo magnético de 4,2mT (Callister, 2003). Al interior de la jeringa, se instaló una malla metálica, usando una esponjilla de acero. Esta malla ayuda a dispersar las líneas del campo magnético, logrando la retención de las nanopartículas magnéticas, que fluyen a través de ella.
La eficiencia de la separación magnética, se evaluó recirculando en ciclos continuos la solución de nanopartículas magnéticas. Para esto, se tomaron muestras de 100µL del efluente proveniente de cada ciclo y se diluyeron con 10mL de agua destilada. La concentración de nanopartículas magnéticas presentes en estas diluciones, se determinaron usando un espectrofotómetro UV-Vis marca Labomed, Inc. UV 2650, siguiendo la absorbancia del hierro, a una longitud de onda de 307nm. La recirculación, se mantuvo hasta obtener un mínimo de nanopartículas magnéticas en el efluente. Para realizar estos análisis, se preparó primero una curva de calibración, partiendo de una concentración conocida de nanopartículas MNp-CMC de 20mM, la cual, se diluyó sucesivamente con agua destilada y se determinó su absorbancia, a una longitud de onda de 307nm. A partir de estas mediciones, se determinó que la ecuación que mejor describe este sistema es y = 0,68x + 0,20, con un ajuste lineal R2 = 0,94, donde, y representa la absorbancia de la muestra y x la concentración de las nanopartículas MNp-CMC con unidad mM.
Para probar el dispositivo de retención magnética, se tomaron 50mL del efluente obtenido del proceso de ósmosis directa, que contiene las nanopartículas magnéticas, modificadas con el polímero hidrofílico CMC. Esta muestra, se llevó a un embudo de separación y se hizo gotear a través del dispositivo, para retención magnética. El flujo de salida del dispositivo magnético, se ajustó a 7mL/min, usando un estrangulador de catéter.
RESULTADOS Y DISCUSIÓN
La figura 2 muestra las imágenes obtenidas con el microscopio de barrido electrónico SEM (Figura 2a) y espectroscopía EDX (Figura 2b). En la figura 2a, se puede observar que las partículas magnéticas modificadas con el polímero hidrofílico de carboximetil celulosa (MNp-CMC) lucen como cristales aglomerados con morfología irregular y con una amplia distribución de tamaños. Esto se puede atribuir al método de coprecipitación, empleado para sintetizar las nanopartículas de magnetita, que se caracteriza por no proveer un control en la distribución de tamaño y de forma de las mismas (Herrera et al. 2008).
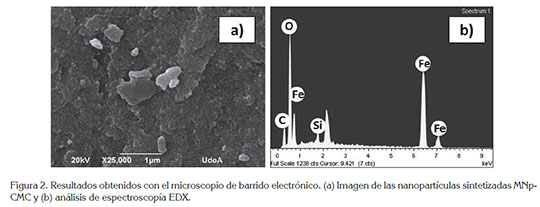
De acuerdo al análisis de espectroscopía EDX, mostrado en la figura 2b, las nanopartículas MNp-CMC contienen átomos de hierro, de carbono, de oxígeno y de silicio. A partir de este análisis, se determinó una composición de 43,9% en peso, para el hierro presente en la magnetita; 15,4% de carbono, presente en la molécula de CMC; 39,4% de oxígeno, presente en la molécula de CMC; y 1,3% de silicio, presente en la molécula de 3-aminopropil trietoxisilano (APS), confirmándose la presencia de estas moléculas orgánicas, en la superficie de las nanopartículas magnéticas.
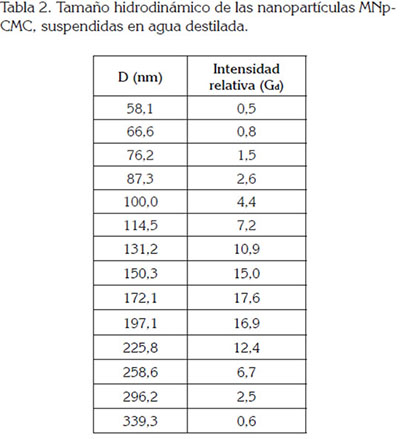
Adicionalmente, se suspendió una muestra de las nanopartículas MNp-CMC en agua destilada (1mg/10mL), para determinar, a través de mediciones con el DLS, el tamaño hidrodinámico de las nanopartículas. La tabla 2 presenta el histograma obtenido con la función de distribución de tamaño multimodal del equipo. Usando la ecuación 1, se pudo calcular, para las nanopartículas MNp-CMC, un tamaño hidrodinámico promedio de 173±53nm, a temperatura ambiente. Este valor, se puede relacionar con la extensión de las moléculas de CMC al medio acuoso. La naturaleza de este biopolímero es altamente hidrofílica y posee un peso molecular de 90×103 g/mol, con un número aproximado de 388 grupos carboxílicos por cadena, lo que facilita la formación de puentes de hidrógeno con la molécula de agua (Bono et al. 2009).
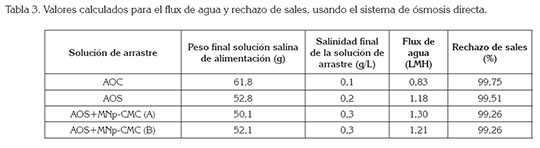
La tabla 2 presenta un registro de los resultados obtenidos al probar el equipo de ósmosis directa con los agentes osmóticos y los nanoaditivos MNp-CMC, los cuales, fueron usados para calcular el flux de agua y rechazo de sales, utilizando las ecuaciones 2 y 3. En estos experimentos, se observó que el AOS resultó ser más efectivo que el AOC, obteniéndose un incremento en el flux de agua, de aproximadamente 30%, que se puede atribuir a que el AOS se preparó fresco en el laboratorio, usando como electrolitos, una relación de azúcar y glucosa anhídrica, en 50/50 %p/p, mientras que al AOC, compuesto principalmente por dextrosa/fructosa, se le observó un contenido de humedad al momento de retirarlo del empaque e implementarlo en el sistema, lo que pudo resultar en un menor aporte de presión osmótica a la solución y, por ende, menor arrastre de agua, a través de la membrana.
Cuando se utilizó la mayor concentración de nanoaditivos en el agente osmótico sintético, se obtuvieron los valores más altos de flux de agua, observándose un incremento del 9,2%, comparado al flux de agua conseguido con el AOS sin nanoaditivos. Este resultado indica que la presencia de las nanopartículas en la solución de arrastre logró incrementar la presión osmótica del sistema, teniendo mayor número de partículas osmóticamente activas, que arrastran más cantidad de agua, a través de la membrana.
Ling et al. (2010) evaluaron el uso de nanopartículas magnéticas cubiertas con polímeros hidrofílicos, como soluciones de arrastre, en procesos de ósmosis directa, usando una membrana comercial de triacetato de celulosa. A partir de estos resultados, encontraron valores de flux de agua de 10,4 a 7,7 LMH, usando nanopartículas de magnetita sintetizadas por el método de descomposición termal, con tamaño partícula, aproximadamente, de 4,0nm y modificadas con ácido poliacrílico.
En otros trabajos, Qingchun et al. (2011) estudiaron el uso de nanopartículas magnéticas sintetizadas por el método de descomposición termal y cubiertas por polietilenglicol diácido, para procesos de ósmosis directa, encontrado también valores de flux de agua de 10 LMH.
Es importante resaltar que los trabajos reportados por Ling et al. (2010) y Qingchun et al. (2011) sintetizaron las nanopartículas magnéticas por el método de descomposición termal, que permite tener nanopartículas monodispersas y con buen control de tamaño, pero con elevados costos de reactivos y materiales (Herrera et al. 2013). A pesar que en el presente estudio se obtuvieron valores más bajos de flux de agua, son relevantes, toda vez que las nanopartículas fueron obtenidas por un método sencillo y económico, como la co-precipitación y fueron implementadas como nanoaditivos, con concentraciones máximas de 112,5mg/L, lo que puede sugerir que un aumento en la concentración de estos nanomateriales puede incrementar el flux de agua, en el proceso de ósmosis directa.
En cuanto al porcentaje de rechazo de sales registrado en la tabla 3, se pudo observar que los mismos fueron todos mayores al 99%, para cada una de las soluciones de arrastre evaluadas en el sistema de ósmosis directa, lo cual, indica una buena selección de la membrana semipermeable de triacetato de celulosa, para la desalinización de agua. Entre las ventajas que se han documentado para el uso de membranas basadas en acetato de celulosa, se destaca su alta hidrofilicidad, buenas propiedades mecánicas, bajo factor de ensuciamiento o fouling y alta resistencia a degradación frente a compuestos clorados, convirtiéndose así en un material versátil, para procesos de ósmosis directa (Zhao et al. 2012).
Los resultados de la separación magnética, se presentan en la tabla 4, donde se observó una disminución en la concentración de nanopartículas presentes en el efluente, después de seis ciclos de separación magnética, demostrando así la capacidad de remoción de las nanopartículas, usando un campo electromagnético externo. El valor negativo de concentración reportado en la tabla 4, luego de ocho ciclos de separación magnética, se puede atribuir a limitaciones derivadas de la curva de calibración obtenida con el UV-Vis, donde no se consideró hacer lecturas de absorbancia para un rango de concentración de nanopartículas entre 0 y 0,1mM, dificultando así la lectura de estas muestras con el espectrofotómetro para concentraciones de MNp-CMC, por debajo de 0,2mM.
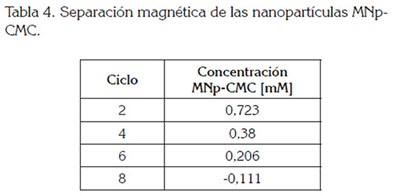
Con el propósito de determinar el contenido de hierro en partes por millón remanente en el efluente, luego de ocho ciclos de separación magnética, se llevó una muestra al equipo de absorción atómica Varian, Modelo FS220, a partir del cual, se detectó la presencia de un contenido de hierro de 227,5mg/L. Esta alta concentración de hierro supera el valor máximo aceptable de hierro de 0,3mg/L, establecido en la Resolución 2115 de 2007 del gobierno colombiano, Ministerio de Ambiente, Vivienda y Desarrollo Territorial 2007, para aguas potables. Esto indica, que se debe mejorar el proceso de separación magnética, aplicando campos electromagnéticos de más alta potencia, que ayuden a eliminar, de manera más efectiva, las nanopartículas magnéticas, disminuyendo así el contenido de hierro, en el efluente de agua desalinizada.
De la presente investigación, se concluye que las soluciones de arrastre juegan un importante papel en el proceso de ósmosis directa, facilitando el transporte de las moléculas de agua, a través de una membrana semipermeable, sin la utilización de un gradiente de presión, que genere gastos energéticos al sistema. Se espera que estos agentes osmóticos sean solubles en agua, económicos y que se preparen a partir de materiales no tóxicos. Entre estos, se destacan las nanopartículas magnéticas modificadas con polímeros hidrofílicos, que tienen la ventaja de poder ser recuperadas, implementando un campo magnético externo.
A pesar de que se observó un incremento en el flux de agua con la adición de las nanopartículas a una solución de electrolitos, se encontró una alta concentración de hierro en el efluente de agua desalinizada, luego de ocho ciclos continuos de separación magnética. Esto lleva a pensar que, a pesar de que esta tecnología se presenta como una alternativa viable para la desalinización de agua de mar, todavía hace falta mejorar los dispositivos de recuperación magnética, para asegurar que el agua tratada cumpla con los criterios de calidad y de seguridad, para consumo humano.
Agradecimientos: Los autores expresan sus agradecimientos a la Universidad de Cartagena y a la Facultad de Ingeniería, por el uso del Laboratorio de Ciencia de los Materiales del programa de Ingeniería Química, para la preparación de los nanomateriales, la puesta en marcha del sistema de ósmosis directa y la caracterización de efluentes por UV-Vis. En adición, se agradece a la Corporación Autónoma Regional del Canal del Dique CARDIQUE, por su apoyo en la caracterización de muestras de agua y beca, para realización de la Maestría en Ingeniería Ambiental del Q.F. Ildefonso Castro. Conflicto de intereses: El manuscrito fue preparado y revisado con la participación de todos los autores, quienes declaramos que no existe conflicto de intereses, que ponga en riesgo la validez de los resultados presentados.
BIBLIOGRAFÍA
1. ACHILLI, A.; CATH, T.Y.; CHILDRESS, A. E. 2010. Selection of inorganic-based draw solutions for forward osmosis applications. J. Membr. Sci. (Netherlands). 364:233-241.
2. BONO, A.; YING, P.; YAN, F.; MUEI, C.; SARBATLY, R.; KRISHNAIAH, D. 2009. Synthesis and characterization of carboxymethyl cellulose from palm kernel cake. Adv. Nat. Appl. Sci. (USA). 3:5-11.
3. CALLISTER, W. 2003. Materials Science and Engineering. An Introduction. Third Edición. New York, USA. Editorial Jhon Wiley & Sons. p.675-677.
4. DESHMUKH, A.; YIN YIPA, N.; LINA, S.; ELIMELECHA, M. 2015. Desalination by forward osmosis: Identifying performance limiting parameters through modulescale modeling. J. Membr. Sci. (USA). 491:159- 167.
5. GARCÍA, X.; PARGAMENT, D. 2015. Reusing wastewater to cope with water scarcity: Economic, social and environmental considerations for decision-making. Resources, Conserv. Recyc. (Israel). 101:154-166.
6. GOHARI, A.; ESLAMIANA, S.; MIRCHIB, A.; ABEDI-KOUPAEIA, J.; BAVANIC, A.; MADANID, K. 2013. Water transfer as a solution to water shortage: A fix that can backfire. J. Hydrol. (Iran). 491:23-39.
7. HERRERA, A.; BARRERA, C.; RINALDI, C. 2008. Synthesis and functionalization of magnetite nanoparticles with aminopropylsilane and carboxymethyl Dextran. J. Mater. Chem. (UK). 18:3650-3654.
8. HERRERA, A.; POLO-CORRALES, L.; CHAVEZ, E.; CABARCAS, J.; UWAKWEH, O.; RINALDI, C. 2013. Influence of aging time of oleate precursor on the magnetic relaxation of cobalt ferrite nanoparticles synthesized by the thermal decomposition method. J. Magnetism Magnetic Mater. (Netherlands). 328:41-52.
9. HOLLOWAY, R.W.; MALTOS, R.; VANNESTE, J.; CATH, T.Y. 2015. Mixed draw solutions for improved forward osmosis performance. J. Membr. Sci. 491:121-131.
10. JAMIL, S.; LOGANATHAN, P.; KAZNER, C.; VIGNESWARAN, S. 2015. Forward osmosis treatment for volume minimisation of reverse osmosis concentrate from a water reclamation plant and removal of organic micropollutants. Desalination (Australia). 372:32-38.
11. KWAN, S.; BAR-ZEEV, E.; ELIMELECH, M. 2015. Biofouling in forward osmosis and reverse osmosis: Measurements and mechanisms. J. Membr. Sci (USA). 493:703-708.
12. LING, M.; CHUNG, T. 2011. Desalination process using super hydrophilic nanoparticles via forward osmosis integrated with ultrafiltration regeneration. Desalination (Australia). 278:194-202.
13. LING, M.; WANG, K.; CHUNG, T.B. 2010. Highly watersoluble magnetic nanoparticles as novel draw solutes in forward osmosis for water reuse. Industr. Engineer. Chem. Res. (USA). 49:5869-5876.
14. NGUYEN, H.; NGUYEN, N.; CHEN, S.; NGO, H.; GUO, W.; LI, C. 2015. A new class of draw solutions for minimizing reverse salt flux to improve forward osmosis desalination. Sci. Total. Environ. (Taiwan). 538:129-136.
15. QINGCHUN, G.; JINCAI, S.; TAI-SHUNG, C.; GARY, A. 2011. Hydrophilic superparamagnetic nanoparticles: Synthesis, characterization, and performance in forward osmosis processes. Industr. Engineer. Chem. Res. (Singapore). 50:382-388.
16. VALLADARES LINARES, R.; LI, Z.; SARP, S.; BUCS, S.S.; AMY, G.; VROUWENVELDER, J.S. 2014. Forward osmosis niches in seawater desalination and wastewater reuse. Water Res. (Netherlands). 66:122-139.
17. ZHAO, S.; ZOU, L.; TANG, C.; MULCAHY, D. 2012. Recent developments in forward osmosis: Opportunities and challenges. Review. J. Membr. Sci (USA). 396:1-21.
Recibido: Julio 3 de 2015 Aceptado: Mayo 18 de 2016
Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.