CIENCIAS AGROPECUARIAS-Artículo Científico
ACTIVIDAD ANTIMICROBIANA DEL EXTRACTO DE Mascagnia macrodena (DC) Mied SOBRE Collectotrichum gloeosporioides CAUSANTE DE ANTRACNOSIS EN ÑAME
ANTIMICROBIAL ACTIVITY OF Mascagnia macrodena (DC) Mied LEAF EXTRACT ON Colletotrichum gloeosporioides DISEASE CAUSING FUNGUS OF YAM
Alexander Pérez-C.1, Katy Pérez-P.2, Leonardo Chamorro-A.3
1 Dr. Sci. Universidad de Sucre, Facultad de Ciencias Agropecuarias, Grupo Bioprospección Agropecuaria, e-mail: alexander.perez@unisucre.edu.co
2 Biol. Universidad de Sucre, Facultad de Educación y Ciencias, Grupo Bioprospección Agropecuaria, e-mail: katymaria1@hotmail.com Campus Universitario Puerta Roja, A.A. 406, Sincelejo, Sucre, Colombia. wwww.unisucre.edu.co, dius@unisucre.edu.co
3 Biol. Universidad de Sucre, Facultad de Educación y Ciencias, Grupo Bioprospección Agropecuaria, e-mail: lema1906@hotmail.com Campus Universitario Puerta Roja, A.A. 406, Sincelejo, Sucre, Colombia.
Rev. U.D.C.A Act. & Div. Cient. 17(2): 413-422, Julio-Diciembre, 2014
RESUMEN
El presente estudio tuvo como objetivo evaluar in vitro la actividad antimicrobiana del extracto de hojas de Mascagnia macrodena (DC) Mied, sobre cepas del hongo del género Colletotrichum gloeosporioides, causante de la enfermedad de la antracnosis, en el cultivo del ñame, en Colombia. Inicialmente, mediante extracción por el método Soxhlet, se obtuvieron extractos totales en etanol de hojas de M. macrodena y, a partir de éste, se prepararon fracciones líquido-líquido con éter de petróleo (E. petrol) y acetato de etilo (AcOEt). El extracto total etanólico y las dos fracciones fueron preparadas a diferentes concentraciones (ppm) y evaluadas in vitro sobre cepas del hongo C. gloeosporioides. La cepa que mostró mayor susceptibilidad a los extractos fue C040, en relación a C279, C853 y C507, que mostraron mayor resistencia. Los hongos presentaron mayor susceptibilidad al extracto total etanólico, seguido de la fracción acetato de etilo a concentraciones de 50, 75 y 100ppm, respectivamente. El screen fitoquímico realizado, reveló la presencia de metabolitos secundarios tipo taninos, antocianinas y alcaloides. Este estudio preliminar muestra el efecto potencial de los extractos de hojas de M. macrodena, sobre la inhibición in vitro del crecimientos de hongos causante de la enfermedad de la antracnosis en el cultivo de ñame.
Palabras clave: Extracto, fitopatógeno, Colletotrichum,Dioscorea spp.
SUMMARY
The objective of this study was to evaluate the in vitro antimicrobial activity of leaf extract the Mascagnia macrodena (DC) Mied, on fungi of the genus Colletotrichum, causative of the anthracnose disease of yam cultivation in Colombia. Initially, using the Soxhlet method, total extracts in ethanol of leaves of M. macrodena were obtained and from these liquid-liquid fractions with petroleum ether (E. petrol) and ethyl acetate (AcOEt) were prepared. The total ethanolic extract and two fractions were prepared in different concentrations (ppm) and evaluated in vitro on strains of the fungus C. gloeosporioides. The strain that showed the highest susceptibility to the extracts was C040 compared with C853, C279 and C507, which showed the highest resistance. The fungi showed increased susceptibility to the total ethanol extract, followed by the ethyl acetate fraction at concentrations of 50, 75 and 100 ppm, respectively. The phytochemical screen, revealed the presence of secondary metabolites of tannin, anthocyanin and alkaloid types. This preliminary study showed the potential effect M. macrodena leaf extracts on inhibition in vitro of the growth of fungi causing anthracnose in yam cultivation.
Key words: Extract, fungi, Colletotrichum sp., Dioscorea spp.
INTRODUCCIÓN
El ñame es una planta monocotiledónea, dioica del género Dioscorea de la familia Dioscoreaceae y comprende seis géneros, siendo el principal Dioscorea, con 600 especies, de las cuales, 60 son comestibles y, de éstas, 12 son cultivadas. Las especies comestibles de valor comercial son: D. rotundata, D. cayenensis, D. alata y D. trifida (Rodríguez, 2009).
Este tubérculo, se ha constituido en uno de los productos alimenticios de mayor interés, debido a su riqueza en carbohidratos para millones de personas que habitan en los trópicos y los subtrópicos de África, de América Central, de Sur América, partes de Asia, el Caribe e islas del Pacifico, repercutiendo en su comercialización y, por ende, en la economía, a nivel mundial (Amusa et al. 2003).
La producción mundial de ñame, se estimó en 49.183.219 t en el 2009 y más del 90% (46 millones de toneladas por año), se produce en el occidente de África, siendo las especies más sembradas D. rotundata y D. alata, a nivel mundial (FAO, 2011). En Colombia, D. alata y D. rotundata son las especies de ñame de mayor importancia por el área sembrada, como por la demanda del tubérculo (Méndez et al. 2013).
En el Caribe colombiano, se cultivan alrededor de 26.502ha, con un rendimiento promedio de 11,7t/ha y una producción anual de 310.205t. De este producto, se sostienen al menos 20 mil familias de los departamentos de Sucre, de Córdoba y de Bolívar (Osorio et al. 2010).
Dentro de los problemas fitosanitarios presentes en el cultivo, actualmente, se destacan las enfermedades de origen fúngico (Osorio & Ramírez, 1989). En Colombia, los investigadores consideran que uno de los factores que más limita la producción de ñame son las enfermedades que se presentan en campo como en almacenamiento, destacándose por su severidad en el campo la antracnosis, causada por Colletotrichum. gloeosporioides [(Penz.) Penz. y Sacc.] y la marchitez descendente por Fusarium oxysporum (Pinzón et al. 2009).
El género Colletotrichum comprende una amplia gama de especies de hongos, en donde C. gloeosporioides, C. acutatum y C. orbiculare se han considerado las más importantes. Estos hongos, se encuentran en la naturaleza como saprófita y parásita especializados, con un amplio número de hospederos. La forma patogénica forma lesiones necróticas en tallos, en hojas y en frutos de diversas especiales de cultivos (Cerón et al. 2006).
Mascagnia macrodena (DC) Mied pertenece a la familia Malpighiaceae; es una maleza o planta indeseable, conocida comúnmente como Cansa viejo o mindaca, que crece en clima cálido de Colombia y, en especial, en algunos departamentos del Caribe. Posee una alta capacidad reproductiva, adaptación a diferentes condiciones de clima y suelo, soporta condiciones adversas de humedad y temperatura, conserva eficientemente la viabilidad de sus semillas, alta capacidad de propagación, dispersión y de producción de inhibidores del desarrollo de otras plantas (Jiménez, 2005).
Se caracteriza por ser tóxica para el ganado bovino, por su alto contenido de ácido cianhídrico. La intoxicación por estas plantas es más común al comienzo de las lluvias, después de un intenso verano. El análisis químico colorimétrico demuestra que contiene altas concentraciones de ácido cianhídrico en la época seca (Jiménez, 2005).
El principio tóxico de estos compuestos son los glucósidos cianogénicos y nitratos, los cuales, se acumulan en las semillas y en las hojas y cuando está en crecimiento, la planta en sí no es tóxica, pues el glucósido requiere de un desdoblamiento realizado por la enzima βglucosidasa, la cual, en condiciones extremas de sequía, marchitamiento o mal desarrollo, hacen posible la unión de la β- glucosidasa con el glucósido liberando el HCN (Jiménez, 2005).
Un desafío para los países ricos en biodiversidad es poder vincular y convertir el conocimiento proveniente de los recursos biológicos, en compuestos, en procesos, en métodos, en herramientas o en productos útiles, como parte del aprovechamiento y explotación sostenible de la diversidad biológica, en beneficio de la sociedad, realizando estudios que permitan el descubrimiento de moléculas bioactivas, que procedan de fuentes naturales, como los vegetales.
El uso indiscriminado de sustancias desarrolladas sintéticamente para el control de patógenos ha ocasionado la inducción de resistencia de algunos microorganismos, causando efectos importantes en muchos otros cultivos, además, del efecto toxicológico sobre animales, humanos y organismos, en los diferentes ecosistemas. Por otro lado, el alto costo de los plaguicidas y el desarrollo de resistencias han obligado a los investigadores a buscar nuevos ingredientes activos biodegradables, para la implementación de medidas de manejo con menor impacto ambiental y económico, pero con un efecto similar o mayor al utilizado en el control de plagas (Quintero et al. 2001).
El departamento de Sucre, Colombia, cuenta con una gran diversidad de especies vegetales en diferentes nichos ecológicos, de las cuales, se desconoce su potencial farmacológico. Muchas de estas especies son nativas y aún existe escasa información sobre su posible potencial biológico en la inhibición de fitopatógenos, en especial, sobre el hongo que causa la enfermedad de la antracnosis.
Tomando como referencia esta problemática, el presente trabajo tuvo como objetivo evaluar la actividad antifúngica de extracto de hojas de M. macrodena sobre cepas del hongo Colletotrichum gloeosporioides, causante de la enfermedad conocida como antracnosis, en el cultivo del ñame, del departamento de Sucre.
MATERIALES Y MÉTODOS
Recolección del material vegetal. Las muestras fueron colectadas durante abril del 2012, en fincas ganaderas del municipio de Sincé. Durante el muestreo, la planta se encontraba en estado de bejuco, con presencia de hojas de la parte media a superior de la planta; las hojas se colectaron del tercio medio de la planta. Durante el muestreo, se tomaron plantas completas que fueron utilizadas para su identificación taxonómica. Las hojas colectadas fueron conservadas y transportadas al laboratorio de Fitoquímica de la Universidad de Sucre, para su posterior procesamiento.
La fuente del inoculo, se obtuvo de la colección de hongos fitopatógenos de ñame de la Universidad de Sucre. Se utilizaron cuatro cepas de hongos, identificados como C. gloeosporioides, que se diferenciaron en cuanto a forma, color y tamaño de crecimiento, en medio PDA y, microscópica, en cuanto a forma y tamaño de las conidias y macroconidias.
Cada aislado fue purificado en cajas de petri con medio Papa-Dextrosa-Agar® (PDA) y se incubaron en oscuridad, a una temperatura de 30°C y humedad relativa del 90%, por un periodo de siete a quince días.
Proceso de extracción. Para obtener el extracto vegetal, se utilizaron las hojas previamente secadas a temperatura ambiente por ocho días; luego, se procedió a cortar el material para el proceso de extracción. Las hojas secas picadas (1000g), se sometieron a una extracción con etanol al 97%, en equipo Soxhlet, a 60°C-80°C, durante seis horas, el cual, se concentró en un rota evaporador a 60°C, al vacío hasta sequedad (Gualtieri et al. 2008).
Después de obtener el extracto etanólico, se realizó un fraccionamiento líquido-líquido con éter de petróleo (E. petrol) y acetato de etilo (AcOEt), obteniéndose así las fracciones de E. petrol y AcOEt (Ávila et al. 2006).
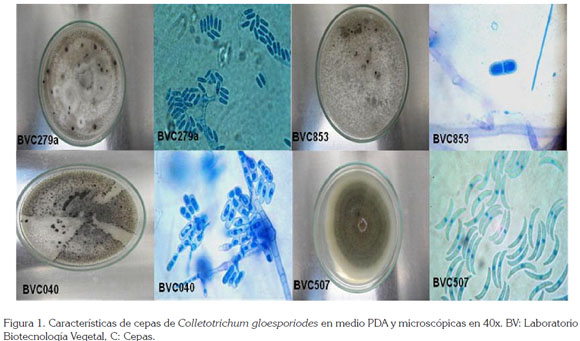
Actividad antifúngica. Para evaluar in vitro la actividad antifúngica, se utilizaron cuatro cepas purificadas de C. gloesporiodes, identificadas como: C040, C279, C507 y C853 (Figura 1). El extracto etanólico total seco y sus diferentes fracciones obtenidas fueron diluidos con dimetilsulfóxido, para preparar concentraciones de 1, 25, 50, 75 y 100ppm, las cuales, se realizaron de la siguiente manera: El primer patrón de concentración corresponde al extracto etanólico total seco que, al salir de la muestra del sohlet y pasarlo por el rotavaporador, se obtiene un volumen (mL) al 100% de concentración; a partir de este volumen se diluye a las diferentes concentraciones de 1,0, 25, 50, 75 y 100ppm.

Para las fracciones de acetato de etilo y éter de petróleo, se procede de la misma forma que en el proceso anterior, excepto que la muestra se dejó más tiempo en el rotavaporador, para eliminar el exceso de alcohol. Seguidamente, se somete a una separación con los otros solventes, para la extracción de sus compuestos, de acuerdo a su polaridad. A partir del volumen obtenido en la separación, se realizaron las diferentes concentraciones con dimetilsulfoxido de 1,0, 25, 50, 75 y 100 ppm.
Para la prueba de actividad inhibitoria, se utilizó el método de siembra, que consistió en sembrar un área de 5mm x 5mm, de crecimiento de cada cepa sobre la superficie del medio papa dextrosa agar (PDA), en ambiente aséptico (Pérez et al. 2011).
La prueba de inhibición, se realizó de la siguiente manera: Los aislados puros en PDA, se les adicionó 100µL de cada extracto total etanólico y, las fracciones (E.petrol y AcOEt), a diferentes concentraciones en ppm, por separado. Para comparar el efecto del extracto total y el de las dos fracciones con las acción química de los fungicidas in vitro, se utilizó nistatina (4mg/mL), como control positivo, debido a que los fungicidas comerciales empleados consecutivamente en campo, no han mostrado ningún efecto inhibitorio sobre el desarrollo de la enfermedad (Pérez et al. 2011).
Como testigo absoluto fueron utilizados las cepas de C. gloeosporioides, cultivadas en medio PDA, sin ningún tratamiento. Los ensayos fueron incubados a 30°C, de siete a quince días. La actividad antifúngica, se evaluó midiendo el crecimiento radial de cada aislado con las diferentes concentraciones. El resultado, se interpretó como porcentaje de índice de inhibición: Índice antifúngico (%) = (1-Diametro de crecimiento de cada tratamiento/Diámetro de crecimiento del testigo absoluto) x 100 (Zhanyong et al. 2007). Para determinar la eficiencia de cada extracto, se compara el índice de inhibición del extracto total y el de las fracciones con el control positivo.
Identificación cualitativa de los metabolitos secundarios. La identificación de los diferentes tipos metabolitos secundarios presentes en los extractos de M. macrodena, se realizó por pruebas de coloración y por reacciones estandarizadas, que indicaron la presencia de compuestos químicos específicos. Se hizo determinación de flavonoides, de taninos, de triterpenos/esteroles, de quinonas, de saponinas, de alcaloides y de antocianinas, conforme Marini-Bettolo et al. (1981).
Análisis espectroscopia de infrarrojo (IR). Para el análisis de las muestras de caracterización o identificación del extracto etanólico y las fracciones éter de petróleo y acetato de etilo, se empleó un espectrofotómetro de infrarrojo (FTIR)-84005 FOURIER TRANSFORM, marca SHIMADZU, en la región 4000-400cm-1. En un mortero, se mezcló 1mg de muestra de extractos, con aproximadamente 100mg, de Cloruro de sodio desecado y se pulverizó con un pistilo. Posteriormente, se presionó la mezcla en un troquel entre 700 y 1000K/cm2, hasta obtener un disco transparente, que se ubica en la trayectoria del haz del instrumento, para su examen espectroscópico (Skoog et al. 2001).
Análisis estadístico. Para establecer relación de la actividad antifúngica (índice de inhibición) del extracto de hojas de M. macrodena en función a las diferentes variables, tales como fracciones, concentraciones y cepas, se realizó un ANOVA multifactorial. Se practicaron varias pruebas y gráficas para determinar qué factores tuvieron efectos estadísticamente significativos sobre el índice de inhibición. Se evaluó la significancia de las interacciones entre los factores, las cuales, fueron evidenciadas, de acuerdo a los resultados de las pruebas obtenidas mediante ANOVA, lo que permitió identificar los factores de mayor significancia. Los análisis fueron realizados mediante el programa estadístico R (R development core team, 2009).
RESULTADOS Y DISCUSIÓN
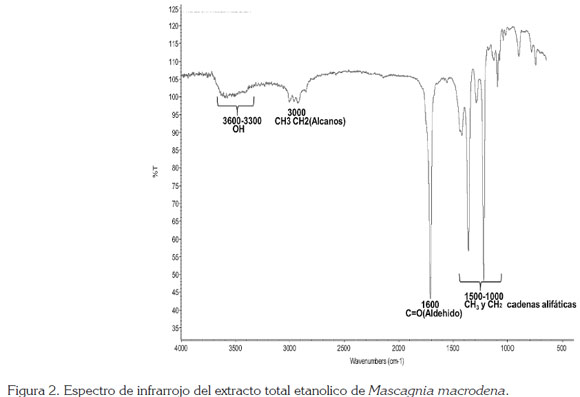
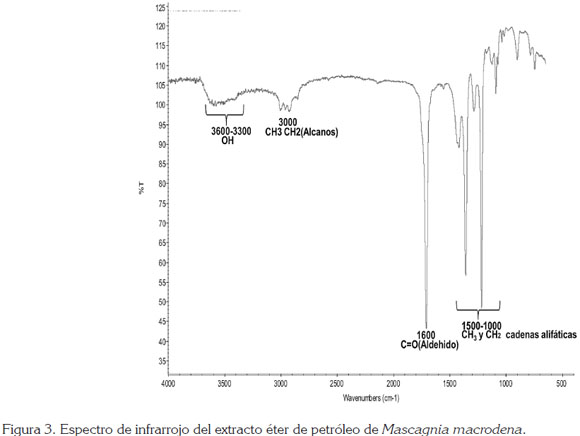
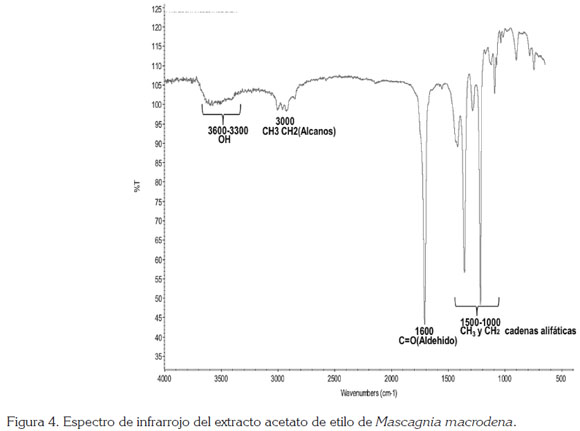
En las figuras 2, 3 y 4, se observan las señales que presentaron los espectros infrarrojos del extracto etanólico total y las fracciones éter de petróleo y acetato de etilo para M. macrodena, respectivamente.
Los resultados del análisis multifactorial para la actividad antifúngica (índice de inhibición en porcentaje) de M. macrodena en función a fracciones, concentración (ppm) y cepa, indican que no existen diferencias significativas (p value = 0.6945) entre la actividad inhibitoria del extracto de M. macrodena con respecto a fracciones, pero sí hubo diferencia altamente significativa para concentración y cepas (p = < 0.001).
Para visualizar las diferencias significativas, se realizó gráfico de boxplot (Figura 5). Los resultados obtenidos en el gráfico para índice de inhibición en función a extracto total etanólico y las fracciones acetato de etilo y etanol, se muestran en la figura 5A; a pesar de no existir diferencia, se observan algunos contrastes en la dispersión de los datos, mostrando mayor índice de inhibición para el extracto total etanolico y, con menor actividad, las fracciones pertenecientes a éter de petróleo y acetato de etilo.
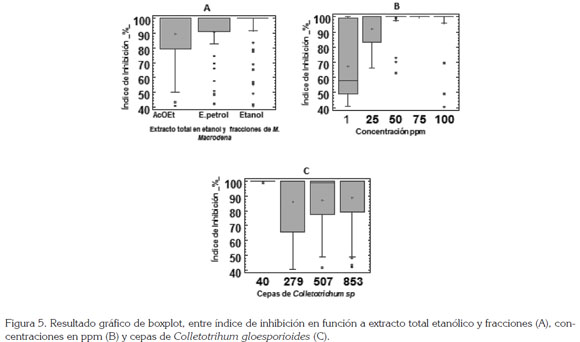
La figura 5B, evidencia las diferencias altamente significativas (p value = <0.001) entre actividad inhibitoria con respecto a la concentración, observándose mayor inhibición, a partir de la concentración 50ppm. A concentraciones de 1 y 25ppm, se distinguen rangos de actividades menores. El gráfico de boxplot, que presenta como resultado el índice de inhibición de los extractos con respecto a las cepas de hongos Colletotrichum, arroja como resultado, que el hongo que presentó mayor sensibilidad es la cepa C040 que, de acuerdo a las características morfológicas de la espora y la forma de crecimiento en medio, corresponde a C. gloesporioides, aislado de plantas de ñame, de la especie D. alata y, mayor resistencia, para las cepas C853 (C. aculatum), obtenido de D. rotundata, C279 (C. orbiculares) y C507 (C. orbiculares), obtenidos de la especie de ñame D. rotundata (Figura 5C).
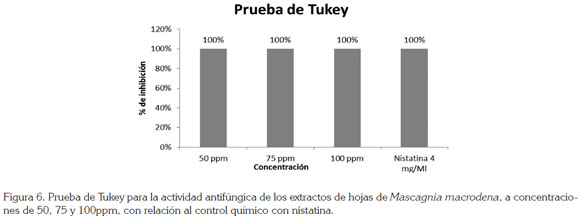
La figura 6 muestra los resultados de la prueba de Tukey, realizados para comparar, in vitro, el efecto inhibitorio de los extractos de hoja de M. macrodena con un fungistático; como el caso de nistatina indica que no existe diferencia significativa a partir de la concentración de 50ppm del extracto de hojas, con respecto al fungistático, lo que sugiere que el extracto presentó una actividad antifúngica igual a este producto químico.
A la fecha del presente estudio, no se dispuso de literatura universal que corrobore el efecto de extractos de plantas de M. macrodena, sobre hongos causantes de la enfermedad de la antracnosis, en el cultivo del ñame; sin embargo, estudios realizados in vitro con otros extractos obtenidos de diferentes especies vegetales, han mostrado actividad inhibitoria, para un amplio número de fitopatógenos.
Trabajos realizados con compuestos presentes en las fracciones de hexanos, acetato de etilo y metanol, extraídos a partir de frutos de Areca catechu, fueron evaluados in vitro y demostraron alta actividad inhibitoria sobre C. gloeosporioides Penz, in vitro, de fruto de mango. Los resultados indicaron que los triterpenos inhiben el crecimiento del micelio de C. gloesporioides a concentraciones de 36,7; 47,5; 56,7 y 111,5mg/L, respectivamente; sin embargo, los triterpenos mostraron alta inhibición de la germinación de las espora y del tubo germinativo (Yenjit et al. 2010).
Otros estudios con 300 extractos metanólicos provenientes de hojas, de tallos y de flores de árbol de ladra, del estado Minas Gerais-Brasil, presentaron actividad antifúngica, in vitro, para C. lindemuthianum. Otros extractos obtenidos de Astroniumfra xinifolium, Inga marginata, Malva sylvestris, Matayba elaeagnoides, Miconia argyrophylla, Myrcia fallax, Ocimum gratissimum, Origanum vulgare, Rolliniae marginata, Siparuna arianeae, Styrax pohlii, Tabebuia serratifolia y Trichilia pallida, fueron evaluados, in vitro, sobre esta misma especie de Colletotricum, mostrando una alta tasa de inhibición, para este hongo (Andrade et al. 2010).
De otra parte, extractos de Acorusta tarinowii mostraron múltiples actividades anifungicas, in vitro. Los extractos evaluados evidenciaron ser los responsables de la actividad inhibitoria, entre un 98,81 a 100%, sobre el crecimiento micelial y germinación de esporas de Thielaviopsis paradoxa, Pestalotia mangiferae, Fusarium oxysporum sp., Alternaria alternatea, Colletotrichum musae, Sphaceloma fawcettii y Mycosphaerella sentina (Yen et al. 2007).
Extractos de acetona obtenidos de diversos tejidos de especies de plantas invasivas del sur de África, fueron estudiadas como potencial antifúngico, para un grupo selecto de fitopatógenos, tales como: Penicillium janthinellum, Penicillium expansum, Aspergillus niger, Aspergillus parasiticus, Colletotrichum gloeosporioides, Fusarium oxysporum, Trichoderma harzianum, Phytophthora nicotiana, Pythium ultimum and Rhizoctonia solani (Mdee et al. 2009). Las especies de plantas probadas correspondieron a flores y hojas de Cestrumla evigatum; hojas y semillas de Nicotiana glauca; hojas y frutos de Solanum mauritianum; hojas, flores y frutos de Lantana cámara; semillas de Datura stramonium; hojas de Ricinus communis y hojas y flores de Ampuloclinium macrocephalum.
Todos los extractos mostraron alta a moderada actividad inhibitoria, para todos los fitopatógenos evaluados a concentración mínima inhibitoria, en un rango de 0,08mg/ml a 2,5mg/ml. En todos los casos, los extractos de hojas presentaron mayor actividad que las de semillas y frutos. El crecimiento de A. niger, P. expansum y R. solani fueron más sensibles a todos los extractos evaluados, a concentraciones de 0,81; 0,83 y 0,84mg/ml, respectivamente, con relación a C. macrocephalum y C. gloeosporioides, que fueron mayormente inhibidos con extractos de hojas, a concentración de 0,05mg/ml (Mdee et al. 2009).
Los resultados de la prueba de Tukey, realizados para comparar, in vitro, el efecto inhibitorio de los extractos de hoja de M. macrodena, con un fungistático, como el caso de nistatina, muestra que no existe diferencia significativa, a partir de la concentración de 50ppm del extracto de hojas, con respecto al fungistático, lo que indica que el extracto presentó una actividad antifúngica similar a este producto químico. La nistatina reveló ser un buen control positivo en todos los ensayos; sin embargo, al comparar estos resultados con los tratamientos evaluados, se puede evidenciar que algunas de las concentraciones utilizadas (50, 75 y 100ppm) mostraron los mismos efectos de inhibición sobre algunas cepas del hongo, lo cual, representa una alternativa eficaz, para disminuir la infección del hongo Colletotrichum. El dimetilsulfóxido utilizado para preparar las concentraciones del extracto etanólico total y las fracciones, no presentó ningún tipo de interferencia en los resultados obtenidos, puesto que no manifestó actividad inhibitoria en los ensayos, de tal manera que los efectos inhibitorios se le atribuyen directamente a los extractos.
Los ensayos de caracterización cualitativa o screening fitoquímico realizado al extracto en etanol de las hojas frescas de M. macrodena permitieron determinar la presencia de metabólitos secundarios taninos y alcaloides. Estudios llevados a cabo sobre la presencia de compuestos alcaloides en 114 muestras vegetales, pertenecientes a 80 especies de la familia Malpighiaceae, reportan prueba positiva de este compuesto, en M. macrodena (Raffaut, 1996).
Las señales que presentaron los espectros infrarrojos del extracto etanólico total y las fracciones éter de petróleo y de acetato de etilo, muestran los constituyentes del extracto total etanólico y las fracciones éter de petróleo y de acetato de etilo, obtenidos a partir de la muestra de hojas secas de M. macrodena; se observan picos similares de grupos funcionales en común, como el estiramiento de compuestos OH, de cadena alifática, de alcanos y estiramiento de grupo aldehído.
El análisis químico colorimétrico de esta planta ha determinado que existe mayor presencia de ácido cianhídrico en la época de verano que en la época de lluvias. El principio tóxico de esta planta son los glucósidos cianogénicos y nitratos. Esta planta almacena, dentro de su estructura, glucósidos cianogénicos, acumulados en semillas y en hojas y cuando la planta está en crecimiento, en sí no es tóxica, pues el glucósido requiere de un desdoblamiento realizado por la enzima B- glucosidasa, que está separada dentro de la planta; de factores extremos, como sequía, marchitado o mal desarrollo o, fisiológicos, como la digestión, que hacen posible la unión de la B- glucosidasa con el glucósido, liberando el HCN (Jiménez, 2005).
A la fecha del presente estudio no existe reporte de literatura que evidencien la actividad antifúngica de M. macrodena sobre actividad antifúngica de C. gloesporioides, causante de la antracnosis en el cultivo del ñame, en Colombia. La identificación de la actividad antifúngica, in vitro, de una especie vegetal es un paso preliminar para la utilización de esta especie vegetal, como bioactivos; sin embargo, estudios posteriores, evaluarán la eficiencia de M. macrodena, in vivo, sobre C. gloesporioides, como también la toxicidad de estos bioactivos sobre los humanos y los compuestos químicos implicados en la actividad antifúngica. Los resultados obtenidos in vitro, en el presente estudio, comprobó que la especie vegetal M. macrodena contiene una diversidad de metabolitos secundarios, que estarían, posiblemente, asociados a la actividad antifúngica.
Agradecimientos: Los autores agradecen a la Universidad de Sucre, por toda la colaboración brindada. Conflicto de intereses: El manuscrito fue preparado y revisado con la participación de todos los autores, quienes declaramos que no existe ningún conflicto de intereses, que ponga en riesgo la validez de los resultados presentados.
BIBLIOGRAFÍA
1. AMUSA, N.A.; ADEGBITE, A.A.; MUHAMMED, S.; BAIYEWU, R.A. 2003. Yam diseases and its management in Nigeria. Afr. J. Biotechn. 2(12):497-502.
2. ANDRADE, J.M.; ELAINE, A.S.; DENILSON, F.O. 2010. Use of plant extracts in the control of common bean anthracnose. Crop Prot. 29(8):838-842.
3. ÁVILA, L.; BAQUERO, E.; VIÑA, A.; MURILLO, E. 2006. Actividad antibacteriana de Diplostephium tolimense Cuatrec. (Asteraceae) frente a Staphylococcus aureus. Rev. Fac. Química Farmac. 13(9):55-60.
4. CERÓN, L.; HIGUERA, B.; SÁNCHEZ, J.; BUSTAMANTE, S.; BUITRAGO, G. 2006. Crecimiento y desarrollo de Colletotrichum gloeosporioides durante su cultivo en medios líquidos. Acta Biol. Col. 11(7):99-109.
5. FAO. Organización de las Naciones Unidas para la Alimentación y la Agricultura-. FAOSTAT © FAO Dirección de Estadística. 2011. Disponible desde internet en: http://faostat.fao.org/site/567/DesktopDefault.aspx?PageID=567#ancor (con acceso 24/11/2011).
6. GUALTIERI, M.J.; GONZÁLEZ, M.C.; CONTRERAS, B.C.; KEYLLA, P.A. 2008. Evaluación de la actividad antimicrobiana de los extractos etanólicos de Azadirachta indica. Rev. Inst. Nal. Higiene Rafael Rangel. 39(4):12-16.
7. JIMÉNEZ, S. 2005. Toxicidad de algunas plantas medicinales. Disponible desde Internet en: http://www.grupogema.blogspot.com/2008/07/plantas-toxicas.html (con acceso 09/11/2010).
8. MARINI-BETTOLO, G.B.; NICOLETTI, M.; PATAMIA, M. 1981. Plant screening by chemical and cromatographic procedures under fiels conditions. J. Cromatogr. 213(4):113-127.
9. MDEE, L.K.; MASOKO, P.C.; ELOFF, J.N. 2009. The activity of extracts of seven common invasive plant species on fungal phytopathogens. South Afr. J. Botany. 75(6):375-379.
10. MÉNDEZ Y., P.; PALENCIA, J.P.; HERNÁNDEZ, K.P.; BELTRÁN, J.D. 2013. Reacción de genotipos de ñame (Dioscorea spp.) a la antracnosis (Colletotrichum gloesporioides). Temas Agrarios 18(1):34-40.
11. OSORIO, J.; BUSTAMANTE, E.; MACARENO, M.; HERNÁNDEZ, E.; BELTRÁN, J. 2010. Aislamientos enzimáticos de protoplastos a partir de mesófilo de Dioscorea alata cultivar ''Pico de Botella''. Temas Agrarios. 15(1):58-70.
12. OSORIO, J.; RAMÍREZ, B. 1989. Principales enfermedades del ñame en la Región Caribe Colombiana. Rev. Transf. Tecn. 12(1):13-18.
13. PÉREZ, A.; ROJAS, J.; ANAYA, L.; PÉREZ, K. 2011. Evaluación in vitro de la actividad inhibitoria de extractos vegetales sobre aislados de Colletotrichum spp. Acta Agron. 60(2):158-164.
14. PINZÓN, Y.; BUSTAMANTE, S.; BUITRAGO, G. 2009. Evaluación de métodos para la conservación de hongos fitopatógenos de ñame (Dioscorea sp.). Rev. Col. Biotecn. 11(2):8-19.
15. QUINTERO, S.R.; GIOANETTO, F.A.; CHÁVEZ, C.E.; BÁRCENAS, O.D. 2001. Curso taller de agricultura orgánica. Universidad Autónoma de Chihuahua. CIDACOM, Chihuahua, Chihuahua. 227p.
16. RAFFAUT, R.F. 1996. Plant Alkaloids. A guide to their discovery and distribution. Food Products Press, NY. 1916p.
17. R DEVELOPMENT CORE TEAM. 2009. Language and Environment for Statistical computing, Foundation for Statistical Computing. Disponible desde internet en: http://www.R-project.org (con acceso. 10/07/2010).
18. RODRÍGUEZ, A.; VÁSQUEZ, J.; GARCÍA, M.; FONSECA, M.; BORGES, M.; AGUILERA, N.; MENESES, S.; INFANTE, Z. 2009. Conservación in vitro de germoplasma de Dioscorea alata L. por crecimiento mínimo. Plant Genet. Resour. Newsl. 133(5):8-12.
19. SKOOG, D.; HOLLER, F.; NIEMAN, T. 2001. Principio de Análisis Instrumental 5a ed. España: Ed. Mc GrawHill/ Interamericana de España, S.A.U. p.409-435.
20. YENJIT, P.; MONTREE, I.; WARIN, I.; KAN, CH. 2010. Fungicidal activity of compounds extracted from the pericarp of Areca catechu against Colletotrichum gloeosporioides in vitro and in mango fruit. Postharv. Biol. Techn. 55(9):129-132.
21. YEN, T.B.; CHANG, H.T.; HSIEH, C.C.; CHANG, S.T. 2007. Antifungal properties of ethanolic extract and its active compounds from Calocedrus macrolepis var. formosana (Florin) heartwood. Biores. Technol. 99(4):4871-4877.
22. ZHANYONG, G.; RONGE, X.; SONG, L.; ZHIMEI, Z.; XIA J. 2007. The influence of molecular weight of quaternized chitosan on antifungal activity. Int. J. Food Microbiol. 118(10):214-217.
Recibido: Agosto 27 de 2013 Aceptado: Agosto 27 de 2014

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.