CIENCIAS AGROPECUARIAS-Artículo Científico
CINÉTICA DO FÓSFORO EM TECIDOS DE CORDEIROS RECEBENDO DIETAS COM CONCENTRAÇÕES CRESCENTES DO MINERAL
CINÉTICA DEL FÓSFORO EN TEJIDOS DE CORDEROS RECIBIENDO DIETAS CON CONCENTRACIONES CRECIENTES DEL MINERAL
PHOSPHORUS KINETICS IN LAMB TISSUES FED DIETS WITH INCREASING CONCEN TRATIONS OF THE MINERAL
René Patiño P.1, Tanimara Soares da Silva2, José Cleto da Silva Filho3, José A. Moreira4, Dorinha M S S Vitti.5
1Ph.D. Professor do programa de Zootecnia da Faculdade de Ciências Agropecuárias. Universidade de Sucre, Campus Universitario Barrio Puerta Roja. A.A. 406. Sincelejo, Colômbia. rene.patino@unisucre.edu.co
2M.Sc. Centro de Energia Nuclear na Agricultura, Universidade de São Paulo, Av. Centenário no303. Caixa Postal 96 1400-970, Piracicaba, São Paulo, Brasil. tanimarasoares@hotmail.com,
3Ph.D. Professor Universidade Federal de Lavras. Programa de Zootecnia. Campus Universitário, Caixa Postal 3037, Lavras, Minas Gerais, Brasil. cleto@dzo.ufla.br
4Ph.D. Professor Universidade Federal do Rio Grande do Norte. Unidade Acadêmica Especializada em Ciências Agrárias, Curso de Zootecnia, Caixa Postal 07, Macaíba, Rio Grande do Norte, Brasil. japmoreira@bol.com.br
5M.Sc. Centro de Energia Nuclear na Agricultura, Universidade de São Paulo, Av. Centenário no303. Caixa Postal 96 1400-970, Piracicaba, São Paulo, Brasil.dovitti@cena.usp.br
Rev. U.D.C.A Act. & Div. Cient. 17(2): 445-452, Julio-Diciembre, 2014RESUMO
Avaliou-se o efeito do incremento na ingestão de fósforo sobre a cinética do mineral nos tecidos de cordeiros. Vinte e quatro cordeiros machos da raça Santa Inês com peso vivo médio de 34,5kg foram distribuídos em quatro tratamentos (0,16; 0,37; 0,58 e 0,79% de P na MS da dieta). Foi utilizado um delineamento em blocos ao acaso com parcelas subdivididas. Os animais foram injetados com 7,4 MBq de 32P e abatidos oito dias após. Foram determinadas a concentração de fósforo, a retenção, a atividade específica relativa (EAR) e a padronizada (AEP) do 32P nos tecidos. O incremento na ingestão de fósforo aumentou linearmente (P<0,05) a concentração plasmática do mineral e a atividade metabólica (AER) dos tecidos, porém a retenção de 32P diminuiu de forma diferenciada entre tecidos, sem variação na concentração de P. A substituição do P estável por 32P (AEP) diferiu entre tecidos, e foi afetada (P<0,05) quadraticamente pelo incremento na ingestão. O fígado apresentou maior (P<0,05) AER, AEP e retenção de 32P. Conclui-se que o incremento na ingestão de P, em concentrações de até 220mg P/kg de peso corporal, modificou o comportamento metabólico dos órgãos avaliados em relação às trocas celulares do íon fosfato.
Palavras-chave: Ruminantes, minerais, radiofósforo, cinética; tecidos.
RESUMEN
Se evaluó el efecto del incremento en la ingestión de fósforo sobre la cinética del mineral en los tejidos de ovinos en crecimiento. Veinticuatro machos de la raza Santa Inés, con peso vivo medio de 34.5kg, fueron distribuidos a cuatro tratamientos (0,16; 0,37; 0,58 y 0,79% de fósforo en la MS de la dieta). Se utilizó un diseño en bloques al azar en parcelas subdivididas. Los animales fueron inyectados con 4 MBq de 32P y sacrificados ochos días después. Se determinó la concentración y retención de fósforo, la actividad específica relativa (AER) y la estandarizada (AEP) del 32P en los tejidos. El aumento en la ingestión de fósforo incrementó linealmente (P<0.05) la concentración plasmática del mineral y la actividad metabólica (AER) de los tejidos en relación al fósforo, sin embargo, la retención de 32P cayó linealmente (P>0.05) con el aumento en la ingestión, pero de manera diferente (P<0.05) entre los tejidos evaluados. El incremento en la ingestión no afectó (P>0.05) la concentración final de fósforo de fósforo en los tejidos. La substitución del fósforo estable por 32P (AEP) fue afectada cuadráticamente (P<0.05) por el incremento en la ingestión, y de manera diferente entre los tejidos evaluados. El hígado presentó mayor (P<0,05) AER, AEP y retención de 32P. Se concluye que el incremento en la ingestión de fósforo, hasta niveles de 220mg de P/kg PV, modificó la cinética metabólica del mineral en los órganos evaluados en relación a los flujos celulares del ión fosfato.
Palabras clave: Cinética, minerales, rumiantes, radiofósforo, tejidos.
SUMMARY
This study evaluated the effect of the increase in P intake on P kinetics in tissues of lambs. Twenty-four Santa Inês lambs with average weight of 34.5kg were allotted to four treatments (0.16, 0.37, 0.58 and 0.79% P in DM of the diet). A randomized block design with split plots was used. Lambs were injected with 7.4 MBq of 32P and slaughtered eight days later. P concentration, retention, relative specific activity (RSA) and standardized (SSA) of 32P in tissues were determined. The increase in P intake increased linearly (P<0.05) plasma concentration of P and the metabolic activity (RSA) of the tissues; however the retention of 32P decreased, differentially between tissues, without any variation in the concentration of P. Replacement of the stable P for 32P (SSA) differ among tissues, and was affected (P<0.05) quadratically for the increase in P intake. The liver was higher (P<0.05) for RSA, SSA and retention of 32P. It was concluded that the increase of P intake, up to the levels of 220mg P/kg LW, modified the metabolic activity of the organs evaluated in relation to change and cellular retention of ion phosphate.
Key words: Kinetics, minerals, ruminant, radiophosphorus, tissues
INTRODUÇÃO
O fósforo (P) é um mineral que participa no desenvolvimento e conformação óssea, além de estar presente na maioria dos processos metabólicos celulares (Dias et al. 2013). Na atualidade, muitos dos estudos relacionados com P na alimentação animal procuram precisar na ingestão do elemento para garantir a exigência. Procura-se evitar excessos na oferta que podem causar excessos na a excreção e causar poluição ambiental, como indicado por Kebreab et al. (2013), além de prejuízos econômicos (Geisert et al. 2010). Nos ruminantes, a cinética metabólica do P está em função da quantidade ingerida (Dias et al. 2012), da forma como o elemento se encontra na dieta (Bravo et al. 2003), e das possíveis interações entre o mineral com outros minerais ou componentes da dieta, como também das características do animal, como idade, peso corporal, estado fisiológico e nível de desempenho produtivo (Underwood & Suttle, 2003). A determinação do balanço de P e a concentração sérica deste, em resposta à ingestão, são ferramentas importantes para avaliar sua cinética (Grünberg, 2014), porém, devido à complexidade dos processos homeostáticos que regulam o metabolismo do P, estas poderiam não ser suficientes para analisar o sistema como um todo. Estudar a cinética de P nos tecidos pode ser um complemento importante para avaliar o metabolismo do mineral de maneira mais ampla. O anterior pode ser feito aplicando a técnica da diluição isotópica em ovinos, que por seu tamanho e facilidade de manejo, representam um modelo animal adequado e representativo (Dias et al. 2013) dos ruminantes, para realizar estudos do metabolismo mineral a pesar das diferenças entre espécies.A técnica da diluição isotópica pode ser aplicada usando variáveis como a concentração, a taxa de retenção, a atividade específica padronizada (AEP) e a atividade específica relativa (AER) do 32P (Teixeira et al. 2004). A taxa de retenção do 32P nos tecidos indica como o P interage com o plasma e os fluidos intersticiais, e define a atividade de cada tecido em relação à mobilização de P.
A AER é um índice que indica a atividade metabólica dos tecidos, e é usada para remover o efeito aparente de outros processos importantes como a formação óssea e a captação de P nos tecidos moles. A padronização pode ser feita considerando-se a atividade injetada, em relação ao peso vivo dos animais, chamada atividade específica padronizada (AEP), que é proporcional à dose injetada e retida por cada tecido, como indicado por Smith et al. (1952), que foram os primeiros a estudar o metabolismo do P em tecidos de ovinos.
Ainda que o estudo da cinética de P nos tecidos de ruminantes, usando marcadores, começou há mais de seis décadas, não são muitos os trabalhos disponíveis estudando este aspecto metabólico, e entre os resultados até agora obtidos por alguns autores (Smith et al. 1952; Lobão & Crocomo, 1974; Dias et al. 2007) existem algumas divergências que devem ser esclarecidas. Este trabalho foi desenvolvido com o objetivo de estudar o efeito do incremento na ingestão de P sobre a sua cinética, em termos de distribuição, atividade metabólica e troca de P em tecidos de ovinos em crescimento.
MATERIAL E MÉTODOS
O experimento foi conduzido no Laboratório de Nutrição Animal do Centro de Energia Nuclear na Agricultura (CENA) da Universidade de São Paulo, localizado na cidade de Piracicaba, estado de São Paulo, Brasil, nas coordenadas 22°42'23.48'' S e 47°38'43.01'' O, a 514 m de altitude. Vinte e quatro ovinos machos não castrados da raça Santa Inês, com oito meses de idade e pesando em média 34,5±1,4kg, foram mantidos em quatro baias de 16 m2 durante sete dias, onde receberam as dietas experimentais. Posteriormente, os animais foram transferidos para gaiolas de aço inoxidável para estudo de metabolismo, equipadas com coletores para separação de fezes e urina, cochos de alimentação, independentes para feno e concentrado, e bebedouro. Nas gaiolas, os cordeiros permaneceram por um período de 15 dias. Diariamente foi realizada a separação e quantificação de fezes e urina como parte da rotina de estudos paralelos. O experimento foi conduzido em dois períodos, conformando dois grupos de 12 animais cada, devido à disponibilidade de gaiolas e ao espaço do local de coletas de material radiativo do laboratório.
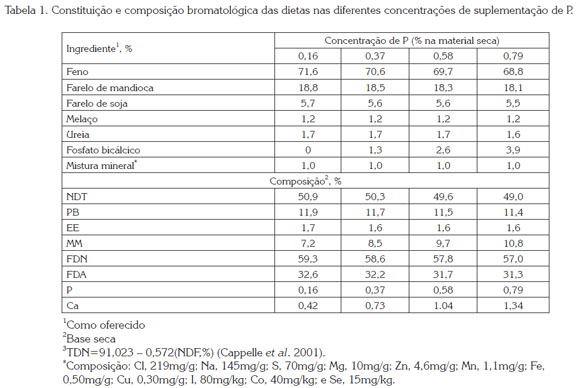
Os tratamentos consistiram em quatro dietas isoproteicas e isoenergéticas formuladas para prover teores de fósforo (P) na matéria seca (MS) de 0,16; 0,37; 0,58 e 0,79 % (Tabela 1), seguindo as recomendações do NRC (2007). Com exceção da dieta com 0,16% de P, as demais incluíram quantidades crescentes de fosfato bicálcico (16% de P), para obter os teores desejados de P (12,5; 25 e 37,5 g animal/dia de fosfato para os teores 0,37; 0,58 e 0,79 % de P na dieta, respectivamente). Na dieta sem inclusão de fosfato a relação Ca:P foi de 2.9:1, e nas demais dietas a relação se manteve próxima a 2:1, indicadas como aceitáveis para este tipo de animais.

O concentrado (300 g/d) juntamente ao feno de capim ''coast-cross'' (Cynodum dactylon L. Pers) e à quantidade de fosfato foram oferecidos diariamente. O concentrado, misturado ao fosfato, era oferecido no período da manhã e o feno era fornecido duas vezes ao dia, em partes iguais. Diariamente, foram registrados o consumo de alimento e as sobras. Amostras dos ingredientes da ração foram colhidas para a determinação da matéria seca, matéria mineral, extrato etéreo e proteína bruta, segundo AOAC (1995). A fibra em detergente neutro (FDN) e a fibra em detergente ácido (FDA) foram determinadas segundo Van Soest & Wine (2004), o teor de P por colorimetria (Sarruge & Haag, 1974), e o de Ca por espectrofotometria de absorção atômica (Zagato et al. 1979).
Após um período de adaptação de sete dias nas gaiolas foram injetados em cada animal 7,4MBq de 32P (em 1mL de solução salina 0,85%) via jugular direita. As amostras de sangue foram colhidas na jugular esquerda, usando tubos com vácuo e contendo anticoagulante. As colheitas ocorreram 5 minutos após a injeção, e a cada 24 horas, durante sete dias.
O sangue foi centrifugado a 1100 X g durante 10 minutos, para separar o plasma. Amostras de 1mL de plasma foram misturadas a 9mL de ácido tricloroacético (10%) para precipitação das proteínas. Após 10 minutos, o material foi centrifugado a 1100 X g e o sobrenadante separado para análise dos teores de P inorgânico por colorimetria (Fiske & Subbarow, 1925).
No oitavo dia, após a injeção do 32P, os cordeiros foram abatidos de acordo com procedimentos da Comissão de Ética em Experimentação com Animais do CENA. Após a sangria dos animais, fígado, coração, rins e testículos foram separados e pesados. A amostra de tecido muscular foi obtida realizando um corte transversal de aproximadamente 5 cm, do membro posterior direito. A amostra de osso foi colhida da 12a costela. O restante das carcaças foi levado para local apropriado construído sob supervisão do Serviço de Proteção Radiológica do CENA. As amostras dos tecidos foram limpas e preparadas para a determinação do teor de matéria seca, seguida de uma pré-queima com ácido nítrico 50%. As cinzas obtidas por incineração (500oC) foram solubilizadas em ácido clorídrico, e o teor de P inorgânico determinado segundo Sarruge & Haag (1974). A detecção da radioatividade do 32P nos tecidos e no plasma foi realizada em espectrômetro de cintilação líquida por efeito Cerenkov (Nascimento & Lobão, 1977).
Para todos os tecidos coletados foi calculada a concentração de P (mg/g MS), a retenção do 32P, a atividade específica padronizada (AEP) e relativa (AER), como segue:
Retenção de 32P = [(cpm amostra tecido/g MS)/cpm dose injetada]/(mg P/g MS);
AEP = [(cpm amostra tecido/g MS)/(mg P/g MS)]/(cpm dose injetada/kg PV) e
AER = Atividade específica do tecido/Atividade específica do plasma.
(cpm=contagens por minuto).
Utilizou-se um delineamento em blocos ao acaso, em esquema de parcelas subdivididas. O fator teor de P da dieta foi alocado nas parcelas (animais) e os tecidos nas subparcelas (seis tecidos). Foi realizada análise de variância utilizando as seguintes fontes de variação no modelo: grupo (como bloco, 1gl); nível de P suplementar, com a soma dos quadrados dividida para testar os efeitos linear, quadrático e cúbico, com 1 grau de liberdade para cada contraste; erro 1; tecido (5gl); a interação entre concentrações de P suplementar e tecido (15gl) e o erro 2, totalizando 143 graus de liberdade para o n total. Dentro de bloco cada tratamento teve três repetições. A comparação das médias dos tecidos foi feita utilizando o teste de Tukey a 5% de probabilidade. Foi feita análise de correlação de Pearson entre as variáveis em estudo. A análise estatística dos dados foi realizada usando a funções GLM e Correlação do programa SPSS versão 12 para Windows.
RESULTADOS E DISCUSSÃO
A ingestão de P foi aumentada linearmente (P<0,05) conforme aumentaram as concentrações de P na dieta, com valores de 1,47; 3,53; 5,5 e 7,47g/dia, para os teores 0,16; 0,37; 0,58 e 0,79% de P na dieta, respectivamente. Os valores plasmáticos também aumentaram linearmente (P<0,05), com valores médios de 6,66; 7,92; 8,78 e 9,02mg/100mL, para as respectivas concentrações de P na dieta. Apesar do incremento nos teores de P no plasma, em resposta ao aumento no consumo de P, os valores situaram-se dentro de uma faixa (6 e 9mg/100mL) considerada normal para ovinos (Dar et al. 2014).
A ingestão de MS não foi afetada (P>0,05) pelos tratamentos e teve um valor médio de 0,942 kg/dia. A concentração de P inorgânico diferiu (P<0,001) entre tecidos, sem efeito (P>0,05) do teor de P na dieta, nem da interação (P>0,05) dos dois fatores (Tabela 2). O osso apresentou a maior concentração de P, seguido em ordem decrescente pelo testículo, rim e fígado, os quais não diferiram entre si, e coração e o músculo que apresentaram os menores (P<0,05) valores. Em relação à concentração de P em tecidos, Smith et al. (1952) obtiveram valores semelhantes aos observados neste estudo, exceto no fígado, que apresentou valor 30% superior. Porém, Bueno & Vitti (1998) relataram que o incremento na ingestão de P afetou linearmente (P<0,05) a concentração de P no coração, músculo e rim de cabras com 34 kg de PC, sem que as concentrações no fígado e no osso fossem alteradas. Os estudos referenciados evidenciam a variabilidade na concentração de P inorgânico nos tecidos e a resposta diferencial destes em relação à quantidade ingerida de P. Landsman et al. (2005) indicaram que fatores, como a fase fisiológica, ritmo de crescimento, além das variações na ingestão de P, são, em parte, responsáveis pelas variações no metabolismo do mineral nas diferentes espécies. A correlação negativa (r=-0,57; P<0,01) entre a concentração de P nos tecidos e a AER pode ser um indício de que tecidos com menor concentração de P apresentam velocidades de troca maiores com os fluidos extracelulares.
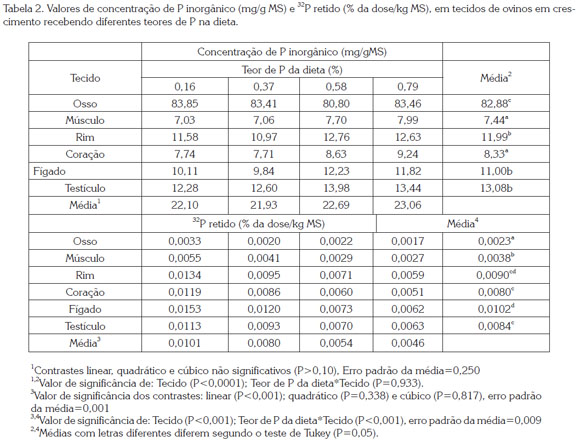
A retenção de 32P variou (P<0,001) entre os diferentes tecidos, e diminuiu linearmente (P<0,001) conforme aumentaram os teores de P na dieta. Porém, a presença de interação (P<0,001), dos fatores ''tecido'' e ''teor de P'', indica que os tecidos apresentaram diferenças entre eles (Tabela 2). Fígado e rim apresentaram a maior retenção (P<0,001), seguidos pelo testículo e coração, com concentrações semelhantes, e músculo e osso com os menores valores (P<0,001). No músculo e no osso, a queda na retenção de 32P foi menor (P<0,05). A diferença entre os tecidos avaliados e a sua diminuição com o incremento na ingestão de P evidenciam que a menor atividade no músculo e osso poderia explicar a menor influência da ingestão de P sobre a retenção. A menor retenção com o aumento na ingestão sugere uma maior excreção, como constatado por Patiño et al. (2013) os quais modelaram a cinética do P usando os dados dos mesmos animais deste estudo. DIAS et al. (2007) observaram um comportamento diferente desta variável. Segundo estes autores a ordem decrescente foi: osso, músculo, fígado coração e rins, semelhante ao encontrado por Bueno & Vitti (1998) em cabras de 34,6kg de PC recebendo dietas com níveis crescentes de P (0, 1 e 2g/dia). Entretanto, Lobão & Crocomo (1974), em ovinos de 114 e 208 dias de idade, Lopes et al. (1999) em suínos recebendo concentrações crescentes de P na dieta, e Teixeira et al. (2004) avaliando diferentes fontes de fosfato, também em suínos, encontraram resultados semelhantes aos do presente estudo, com ossos e músculos apresentando menor retenção de 32P. A divergência entre os estudos poderia ser explicada pelo tempo ocorrido entre a injeção do radioisótopo e o abate dos animais. Nos estudos de curta duração, a incorporação de 32P nos ossos poderia ser mais tardia. Porém, o atual estudo teve a mesma duração do realizado por Dias et al. (2007) e mesmo assim as diferenças foram presentes. O ritmo de crescimento poderia explicar essas diferenças. Animais com ganhos de peso elevados formam maiores quantidades de tecido ósseo e muscular, portanto a retenção total do 32P é maior, o que sugere a relação do P com os demais nutrientes oferecidos e com a capacidade genética do animal. Neste caso, concentrações próximas à concentração de ingestão mínima, como a utilizada no presente estudo, poderiam ser suficientes para atender à exigência do mineral nesta fase, como concluído também por Geisert et al. (2010), os quais avaliaram várias concentrações de ingestão em bovinos em crescimento. A correlação significativa (r=-0,52; P<0,01) entre a ingestão de P e a retenção de 32P nos tecidos confirmou o efeito da ingestão de P sobre atividade dos tecidos em relação à mobilização de P.
A AER foi diferente (P<0,001) entre os tecidos avaliados, e foi aumentada linearmente (P=0,005) à medida que aumentou a ingestão de P. Não houve interação (P>0,05) dos fatores avaliados para essa variável. Fígado, rim e testículo apresentaram maior AER (P<0,05), seguido do coração, e finalmente osso e músculo (Tabela 3). A AER nos tecidos apresentou correlação positiva (r=0,43; P<0,01) com a AEP e a retenção de 32P, e negativa (r=-0,57; P<0,01) com a concentração de P nos tecidos. Estes resultados evidenciam que cada tecido ou órgão possui particularidades em relação à troca de P com o plasma, o que diferencia o papel de cada um na homeostase do mineral no organismo, lembrando que esta variável representa a troca de 32P entre plasma e tecidos. Portanto, o fígado se mostrou o órgão metabolicamente mais ativo, seguido pelos rins e testículos, sendo ossos e músculos os menos ativos.
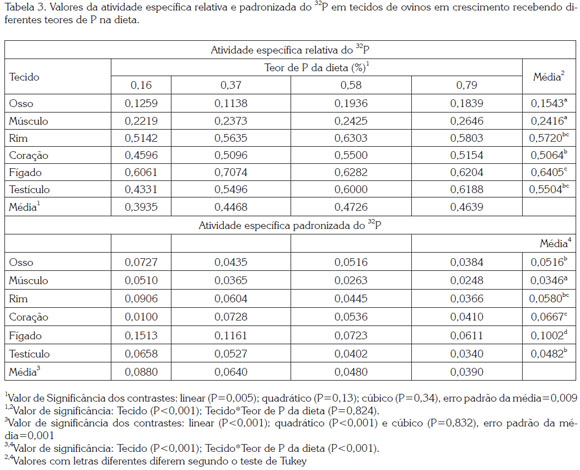
Por outro lado, a AEP (Tabela 3) foi diferente (p<0,001) entre os tecidos, com efeito quadrático (P=0,02) do incremento no consumo de P sobre a AEP. A ordem decrescente da AEP nos tecidos foi: fígado, com o maior valor (P<0,05), seguido de coração, rim, testículo e osso, os quais não diferiram entre si (P>0,05), e músculo, com os menores valores (P<0,05). O comportamento do fígado foi diferente dos demais tecidos, o que explica a interação (P<0,05) entre o fator ''tecido'' e o ''teor de P da dieta'', principalmente pela queda pronunciada (52%), quando se compara o tratamento sem P suplementar (0,16% de P na dieta) com o de 0.37% de P. Já os demais tecidos apresentaram quedas inferiores a 28%, entre as diferentes ofertas de P. Os resultados de AER e AEP obtidos neste estudo foram semelhantes aos encontrados por Bueno &Vitti (1999) em caprinos suplementados com quantidades crescentes de P.
O incremento nas concentrações de P no plasma devido à maior ingestão de P, até níveis de 220mg P/kg PC, modificou o comportamento metabólico dos órgãos avaliados em relação às trocas celulares e retenção do íon fosfato. O fígado foi o órgão metabolicamente mais ativo no intercambio e captação de P, e ossos e músculo os menos ativos.
Agradecimentos: Os autores agradecem à FAPEMIG pelo apoio financeiro (PPM 0381-09) e à ''CAPES/CNPq - IEL Nacional - Brasil'' por conceder a bolsa de estudos do primeiro autor. Conflitos de interesse: O escrito foi preparado e revisado por todos os autores, que declaramos não ter nenhum conflito de interesse que se oponha à validez dos resultados obtidos.
BIBLIOGRAFIA
1. LANDSMAN, A.; LICHTSTEIN, D.; ILANI A. 2005. Distinctive features of dietary phosphate supply. J. Appl. Physiol. 99(3):1214-1219.
2. ASSOCIATION OF OFFICIAL AGRICULTURAL CHEMISTS. 1995. Official methods of analysis. Arlington: AOAC International.
3. BRAVO, D.; BOGAERT, C.; MESCHY, F.; SAUVANT D. 2003. Plasma phosphorus content and dietary phosphorus availability in adult sheep. Anim. Res. 52(5):427-35.
4. BUENO, M.S.; VITTI, D.M.S.S. 1998. Cinética de fósforo em tecidos caprinos. Pesq. Agropec. Bras. 33(10):1609-1615.
5. BUENO, M.S.; VITTI, D.M.S.S. 1999. Níveis de P para caprinos: perda endógena fecal e exigência líquida para mantença. Pesq. Agropec. Bras. 34(4):940-942.
6. CAPPELLE, E.R.; VALADARES, S.; COELHO, F.; CECON, P.R. 2001. Estimativas do valor energético a partir de características químicas e bromatológicas dos alimentos. Rev. Bras. Zootec. 30(6):1837-1856.
7. DAR, A.A.; JADHAV, R.K.; DIMRI, U.; KHAN, A.A.; KHAN, H.M.; SHARMA, M.C. 2014. Effects of physiological status and seasonal variation on plasma mineral profile of sheep in Kashmir valley. Sci. Res. Essays. 9(4):69-76.
8. DIAS, R.S.; KEBREAB, E.; VITTI, D.M.S.S.; PORTILHO, F.P.; LOUVANDINI, H.; FRANCE, J. 2007. Phosphorus kinetics in lambs fed different levels of dicalcium phosphate. J. Agr. Sci. 145(5):509-516.
9. DIAS, R.S.; LÓPEZ, S.; PATIÑO, R.M.; SILVA, T.S.; SILVA, J.C.; VITTI, D.M.; PEÇANHA, M.R.; KEBREAB, E.; FRANCE, J. 2012. An extended model of phosphorus metabolism in growing ruminants. J. Anim. Sci. 89(12):4151-4162.
10. DIAS, R.S.; LÓPEZ, S.; PATIÑO, R.M.; SILVA, T.S.; SILVA FILHO, J.C.; VITTI, D.M.S.S.; PEÇANHA, M.R.S.R.; KEBREAB, E.; FRANCE, J. 2013. Calcium and phosphorus utilization in growing sheep supplemented with dicalcium phosphate. J. Agric. Sci. 151(3):424-433.
11. FISKE, C.H.; SUBBAROW, Y. 1925. The colorimetric determination of phosphorus. J. Biol. Chem. 66(2):375-400.
12. GEISERT, B.G.; ERICKSON, G.E.; KLOPFENSTEIN, T.J.; MACKEN, C.N.; LUEBBE, M.K.; MAC DONALD, J.C. 2010. Phosphorus intake and excretion of finishing beef cattle fed different concentrations of phosphorus. J. Anim. Sci. 88(7):2393-2402.
13. GRÜNBERG, W. 2014. Treatment of phosphorus balance disorders. Vet. Clin. Food. Anim. 30 (2014):383-408
14. KEBREAB, E.; HANSEN, A.V.; LEYTEM, A.B. 2013. Feed management practices to reduce manure phosphorus excretion in dairy cattle. Adv. Anim. Bio. 4(sup.1):37-41.
15. LOBÃO, A.O.; CROCOMO, O.J. 1974. Retenção de P radioativo (P32) em tecidos de ovinos. Bol. Industria Animal. 31(2):261-291.
16. LOPES, J.B.; VITTI, M.S.; FIGUEIRÊDO, A.V.; BARBOSA, H.P. 1999. Cinética de fósforo em tecidos de suínos em crescimento. Rev. Bras. Zootec. 28(4):779- 784.
17. NASCIMENTO, V.F.; LOBÃO, A.O. 1977. Detecção de P-32 em amostras de origem animal e vegetal por efeito Cerenkov, cintilação líquida e detector GM. Piracicaba: CENA/USP. Bol. Cient. 48. 25p.
18. NATIONAL RESEARCH COUNCIL - NRC. 2007. Nutrient requirements of small ruminants: sheep, goats, cervids, and new word camelids. Washington: National Academic. 362p.
19. PATIÑO, P.R.; TANIMARA, DA SILVA; SILVA FILHO, J.C.; NASSER, E.; VITTI, D.M.; MOREIRA, A. 2013. Nutrient absorption in lambs fed diets containing different amounts of phosphorus. Rev. MVZ Córdoba 18(2):3444-3451.
20. SARRUGE, J.R.; HAAG, H.P. 1974. Análises químicas em plantas. Piracicaba: ESALQ/USP. 56p.
21. SMITH, A.H.; BLACK, M.K.; LUICK, J.R.; LARSON, R.F.; WEIR, W.C. 1952. Distribution of intravenously injected radioactive phosphorus (P32) among sheep tissues. J. Anim. Sci. 11(4):638-645.
22. TEIXEIRA, A.; CLEMENTINO, D.; BATISTA, J.; DORINHA, M.S.; VITTI, D.M.; APARECIDO, J.; DE ARAUJO, V.; MIRANDA, S.; ARLINDO, A. 2004. Cinética do radiofósforo em tecidos de suínos em crescimento alimentados com dietas contendo diferentes fontes do fósforo. Rev. Bras. Zootec. 33(5):1238-1245.
23. UNDERWOOD, E.J.; SUTTLE, N.F. 2003. Los minerales en la nutrición del ganado. Zaragoza: Ediciones Acribia. 637p.
24. VAN SOEST, P.J.; WINE, R.H. 2004. Use of detergent in the analysis of farmers feed. IV. Determination of plant cell wall constituents. Rev. Bras. Zootec. 35(5):1238-1245.
25. ZAGATO, E.A.; KRUG, F.J.; BERGAMIN, H.; JORGENSEN, S.S.; REIS, B.F. 1979. Merging zones in flow injection analysis: Part 2: Determination of calcium, magnesium and potassium in plant material by flow injection atomic absorption and flame emission spectrometry. Anal. Chem. Acta. 104(1):279-284.
Recebido em: 28 de maio de 2014 Aceito em: 06 de outubro de 2014

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.