CIENCIAS AGROPECUARIAS-Artículo Científico
SEROPREVALENCIA DE Sarcocystis neurona EN CABALLOS DE MONTERÍA (CÓRDOBA, COLOMBIA)
SEROPREVALENCE OF Sarcocystis neurona IN HORSES IN MONTERÍA (CÓRDOBA, COLOMBIA)
Alfonso Calderón1, Virginia Rodríguez2, Ana Gabriela Henao3, Lizette Johana Aguas4
1 MVZ, M. Sc. Docente, Instituto de Investigaciones Biológicas del Trópico (IIBT), Facultad de Medicina Veterinaria Zootecnia, Universidad de Córdoba, Montería - Colombia. Kilómetro 27 vía Ciénaga de Oro. Correspondencia, e-mail: alcaran1@yahoo.com
2 Bacterióloga, M. Sc. Docente, Grupo de Investigaciones Microbiológicas y Biomédicas de Córdoba (GIMBIC), Programa de Bacteriología, Universidad de Córdoba, e-mail: consuelorr1@yahoo.com
3 MVZ. Asistente Técnico Particular, e-mail: anahenao_87@hotmail.es
4 MVZ. Asistente Técnico Particular, e-mail: vergara_aguas@hotmail.com
Rev. U.D.C.A Act. & Div. Cient. 17(2): 453-459, Julio-Diciembre, 2014
RESUMEN
Sarcocystis neurona es el protozoario más comúnmente asociado con la mieloencefalitis protozoaria equina (EPM), infección que afecta el sistema nervioso central, produciendo ataxia, atrofia muscular, parálisis facial, claudicación, entre otros signos; su diagnóstico es difícil y se debe tener en cuenta cuando se presentan cuadros clínicos con sintomatología nerviosa. En Colombia, se ha reportado un caso compatible con EPM y, en todo el territorio, se encuentran chuchas o zorros y se desconoce su rol epidemiológico. El objetivo de este trabajo fue determinar la presencia de anticuerpos contra S. neurona en equinos, de Montería, Córdoba (Colombia), para conocer su prevalencia y continuar con otros estudios epidemiológicos. Se muestrearon 73 equinos de diferentes criaderos, asociaciones caballistas y fincas ganaderas de Montería y, por medio de un Elisa, se determinó una seroprevalencia de anticuerpos contra S. neurona, del 65,7% y, como sospechosos, se consideraron el 4,1%. La presencia de altos títulos de anticuerpos permite afirmar que existe evidencia de circulación de S. neurona en los equinos y se hace necesario adelantar estudios para comprender mejor la epidemiologia de este agente etiológico, en el Caribe colombiano.
Palabras clave: Encefalomielitis, ensayo de inmunabsorción ligado a enzimas, infecciones por protozoarios.
SUMMARY
Sarcocystis neurona is the most common protozoa associated with equine protozoa myeloencephalitis (EPM), affecting the central nervous system producing ataxia, muscle atrophy, facial paralysis, claudication among other signs; its diagnosis is difficult and it has to be taken into account when clinical symptoms with neurological symptoms are presented. In Colombia a related case to EPM has been reported and in the whole territory there have been found opossums, foxes but their epidemiological role is unknown. The objective of this research was to determine the seroprevalence of S. neurona through sarcocystina toxin detection in horses in Monteria, Cordoba. 73 horses of different hatcheries, horse associations and farms of Monteria, were sampled. Using Elisa a seroprevalence of antibodies against S. neurona of 65.7% was detected and a 4.1% was considered suspicious. The presence of high titers of antibodies in horses allow to suggest the evidence of the circulation of S. neurona in the horses and it becomes necessary to carry out more studies for better understanding the epidemiology of the etiologic agent in the colombian Caribbean.
Keys words: Encephalomyelitis, enzyme linked inmunosorbent assay, protozoan infections.
INTRODUCCIÓN
Sarcocystis, Neospora y Toxoplasma, protozoos patógenos, que se ubican en el sistema nervioso central (SNC) de los équidos (Cheadle et al. 1999; Hoane et al. 2006; Pusterla et al. 2014), causan la mieloencefalitis protozoaria equina (EPM) y enfermedad neurológica, en otros vertebrados (Dubey et al. 2013). Sarcocystis neurona es endémica; solamente en Norte, Centro y Sur América y en algunas áreas de Norte América, la EPM es una de las más importantes enfermedades neurológicas de los equinos (Wright & Kenney, 2010; Hsu et al. 2010). Por primera vez, Paixão et al. (2007), en Brasil, asoció una lesión de EPM con antígenos S. neurona en un estudio retrospectivo en cerebros de equinos. En Europa, esta patología es poco conocida y algunos casos están relacionados por la contaminación de alimentos importados de las Américas y por aves migratorias, como vectores o hospederos de Sarcocystis spp. (Pitel et al. 2002). Arias et al. (2012), en Galicia (España), demostraron que los caballos de esta región están expuestos a S. neurona.
Los equinos son considerados como hospederos intermedios aberrantes para S. neurona, debido a que en la etapa asexual los sarcoquistes que se requieren para transmitir al hospedero definitivo no se han encontrado en sus tejidos (Dubey et al. 2001a; Lindsay et al. 2004; Mullaney et al. 2005), estos hospederos se infectan por la ingestión de alimentos y aguas, contaminados con material fecal de zarigüeyas, que contiene esporocistos, de S. neurona; una vez ingeridos, migran desde el tracto intestinal al sistema nervioso central (SNC), superando la barrera hematoencefálica (Moura et al. 2008) e invaden el SNC, causando inflamación focal o multifocal y EPM (Saville et al. 2001; Saville et al. 2004; Ellison & Witonsky, 2009). La ruta de migración por la ingestión de esporocistos a neuroinvasión es desconocido, pero se han evidenciado parásitos en el SNC en equinos, que han desarrollado enfermedad neurológica, después de una inoculación experimental (Sellon et al. 2004).
En América del Norte, S. neurona utiliza la zarigüeya de Virginia (Didelphis virginiana) como su hospedero definitivo (Fenger et al. 1995; Pereira & Martins, 2010). Yabsley et al. (2007); en zarigüeyas norteamericanas (D. virginiana) de Louisiana, determinaron una prevalencias del 7%, para S. neurona. En Suramérica, Didelphis albiventris es el hospedero definitivo de más de una especie de Sarcocystis (Dubey et al. 2001c; Pereira & Martins, 2010). Se ha evidenciado S. neurona en Brasil, por Dubey et al. (2001c) y Araujo et al. (2011) aislaron S. neurona de Didelphis albiventris; en Uruguay, (Noya et al. 2007) aislaron esporocistos de S. neurona, en los intestinos de la zarigüeya (D. albiventris). En Colombia, se encuentra a D. albiventris, conocida como chucha de oreja blanca, comadreja grande, carachupa, gambá, chucha común, fara, runcho, comadreja, faro, raposa, zorro hediondo, zorro mochilero o zarigüeya y zorro chuca (Figueroa et al. 2009).
La EPM es una enfermedad neurológica progresiva, con signos focales o multifocales, que puede afectar áreas del SNC, con una progresión gradual de los signos clínicos, que incluyen, inicialmente, claudicación de miembros (pelvianos o torácicos), ataxia y atrofia muscular (Dubey et al. 2001a; Moré, 2011); además, se pueden detectar áreas de hipoalgesia, afección de los nervios craneales, que se visualiza por disfagia, parálisis facial y atrofia lingual (Moura et al. 2008). Las anormalidades en la marcha son el resultado de los daños de la médula espinal y varían dependiendo de la ubicación y de la gravedad de las lesiones (Moré, 2011). En Colombia, se ha reportado un caso compatible con EPM (Medina & Oliver, 2003).
El objetivo de este trabajo fue determinar la presencia de anticuerpos contra S. neurona en equinos de Montería, Córdoba (Colombia), con el fin de conocer su prevalencia y continuar con otros estudios epidemiológicos.
MATERIALES Y MÉTODOS
Tipo de estudio. Estudio de tipo descriptivo de corte transversal.
Tamaño de la muestra. Según la encuesta nacional agropecuaria de 2010 (MADR-2010), Montería cuenta con una población de 21.044 equinos y mediante el cálculo para poblaciones (Mateu & Casal, 2003), se estableció que el tamaño de la muestra, para determinar la seroprevalencia de S. neurona, fue de 73 equinos.
Área de estudio. Se realizó en Montería (Córdoba), ubicado al noroeste de Colombia, a 8° 46' de latitud Norte, 75° 51' longitud Oeste, a una altura de 18 msnm, con una extensión de 3.043 km2, con una precipitación anual de 1.500 mm, de clima cálido tropical, con una estación de sequía y otra de lluvias a lo largo del año. La temperatura promedio anual es de 28°C, con picos mínimos-máximo de 16-35°C, en época lluviosa y de 22°C hasta 45°C, en temporada de sequía. La humedad relativa es del 85% y está ubicada dentro de la franja ecológica de bosque seco tropical (bs-T) y en la zona agroecológica Cj (Pulido et al. 2002), que se caracteriza por presentar topografía básicamente plana, con pendientes hasta del 3%, tierras de planicies aluviales sujetas a inundaciones periódicas durante el año; con suelos formados a partir de materiales sedimentarios, que registran poca evolución y mal drenaje, de fertilidad de moderada a alta, tierras aptas para cultivos transitorios, permanentes, ganadería semi-intensiva e intensiva.
Toma de muestra. Previa desinfección de la tabla del cuello, se obtuvo, por venopunción de la yugular, 7mm de sangre, que se colectaron en tubos vacutainers sin anticoagulante (tapa roja), previamente rotulados con la identificación del animal, que se conservaron en refrigeración. El suero, se consiguió por centrifugación, a 3.000 gravedades durante 5 minutos y se trasvasó a viales rotulados, que se conservaron en congelación, 70°C bajo cero, hasta su procesamiento.
El procesamiento de las muestras, se llevó a cabo en un laboratorio clínico veterinario particular de la ciudad de Bogotá, por medio de un ELISA, con una especificidad del 98% y una sensibilidad del 95% (valores indicados por el fabricante y responsable de la técnica de laboratorio, Fundación Colombiana de Estudios Parasitológicos, Bogotá, Colombia), en donde, en una placa de pozos, se fijó la toxina sarcocystina. Se preparó una mezcla del conjugado (anticuerpos anti-toxina+peroxidasa), con la muestra problema, a partes iguales; posteriormente, se adicionó a cada pozo 50µL de esta mezcla y se incubó a 37°C, por una hora. Terminado este tiempo, se lavó 5 veces con PBS-Tween 0,5%; seguidamente, se añadió la solución reveladora y se incubó por 10 minutos a temperatura ambiente y en oscuridad; se frenó la reacción y se hizo la lectura a 630nm, tomando un punto de corte para animales positivos mayor o igual a 100 unidades de absorbancia; sospechosos entre 50 a 100 y negativos, menores de 50.
Análisis estadístico. Los datos se recolectaron mediante un formulario estandarizado y tabulados en una hoja electrónica. Se realizó un análisis descriptivo de las variables (edad, sexo, tipo de explotación, entre otros) y se relacionaron, con el fin de determinar el efecto sobre la presencia de S. neuroma, mediante el Chi-cuadrado(X2). El software implementado para el análisis estadístico fue SAS.
Aspectos éticos. El estudio fue considerado de bajo riesgo por el Comité de Ética del Instituto de Investigaciones Biológicas del Trópico (IIBT), de la Facultad de Medicina Veterinaria Zootecnia, de la Universidad de Córdoba. Para las muestras de sangre obtenidas de los caballos, se tuvieron en cuenta los procedimientos de toma de muestra, manejo y conservación, según las normas de las buenas prácticas de laboratorio y las normas éticas, técnicas y científicas, conforme a la Ley 84 (Congreso de Colombia, 1989). A lo largo del estudio, se mantuvo la confidencialidad de la información de los equinos evaluados.
RESULTADOS Y DISCUSIÓN
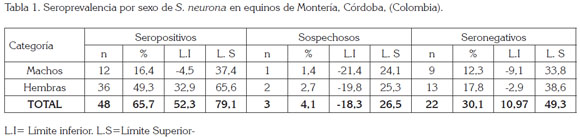
De la muestra de 73 equinos evaluados, el 30,14% fueron machos y el 69,86%, hembras. Al discriminar la muestra por tipo de alojamiento, la mayor proporción, 76,71%, correspondió a equinos en pastoreo y, en el 23,29%, a equinos estabulados, porque la mayor parte de su tiempo permanecen en caballerizas, se usan alimentos balanceados más forrajes henificados, principalmente, y una menor proporción de horas en pastoreo; el 83,56% de los equinos de la muestra fueron mayores de 5 años. Al momento de la toma de las muestras no se observó ningún tipo de signología nerviosa y los encargados directos del manejo zootécnico manifestaron la presencia de zarigüeyas, zorros o comadrejas en potreros y alrededor de las caballerizas; asimismo, se evidenciaron animales de compañía, como perros, gatos y aves ornamentales, en la totalidad de los predios y caballerizas visitadas, en este estudio.
La seroprevalencia determinada fue del 65,7% y, el 4,1% de los equinos, se consideraron como sospechosos (Tabla 1), excluyéndose para los cálculos de la seroprevalencia, por sistema de alojamiento y edad. La alta seroprevalencia determinada en el presente estudio, sugiere que la presencia de chuchas o de comadrejas (D. albiventris), hospedero intermedio, que fue reportada en todos los predios o caballerizas, puede ser fuente de infección para los equinos; aunque no se disponen de estudios epidemiológicos y evidencias diagnósticas de infección de esta especie en Colombia, a diferencia de Houk et al. (2010), quienes determinaron que zarigüeyas del sur de Louisiana, 17%, fueron positivas para S. neurona y Monteiro et al. (2013), en Brasil, demostraron que diferentes especies de Sarcocystis infectan a las zarigüeyas; Morales et al. (2004) describen los hábitos y las condiciones de vida de la zarigüeya en Colombia, dejando claro que se encuentra distribuida en las tres cordilleras y su hábitat va desde los bosques hasta los páramos; aunque también se podría deber a la presencia de animales de compañía (perros y gatos), que también son hospederos de S. neurona y, en muchos casos, sirven de alarma o de control biológico y donde se desconoce su rol epidemiológico para este agente etiológico.

Para los análisis estadísticos, se excluyeron tres equinos reportados como sospechosos y no se registraron diferencias significativas entre sexo, edad y sistema de producción, aun que la tendencia mostró una mayor infección en equinos en pastoreo y mayores de 5 años, lo cual, se puede deber a ser los grupos etarios muestreados, a diferencia de Saville et al. (2000), en Estados Unidos, donde la edad fue un factor de riesgo para la presencia de anticuerpos de S. neurona en equinos, de Yeargan et al. (2013), en México, donde el análisis multivariado mostró que la exposición a S. neurona se asoció con la edad, con la alimentación de granos, cultivos y con el pequeño tamaño del hato y de Pusterla et al. (2014), donde determinaron asociaciones significativas con ubicación geográfica (estado), mes de la presentación, de la raza y del estado serológico.
En Colombia, en un equino que presentó un cuadro de debilidad del tren posterior y que al Western Blot del líquido cefalorraquídeo reveló un proceso activo de infección en el canal vertebral, se asoció con una alta probabilidad de EPM (Medina & Oliver, 2003). Igualmente, Parra et al. (2012), en humanos con sintomatología diversa y antecedentes de contacto con perros infectados por Sarcocystis, detectaron títulos (IgM) y concluyen que esos dos pacientes fueron contagiados por contacto directo, con caninos infectados.
Diversas seroprevalencias en equinos han sido reportadas por diferentes autores, en otros países: Stanek et al. (2003), en Ohio (USA), del 93%; Bentz et al. (2003), en Oklahoma, del 89,2% y Pivoto et al. (2014), en yeguas, 33,7% y en potros recién nacidos, sin ingerir calostro, del 6,6%; en Brasil, Dubey et al. (1999a), del 36,64% y Hoane et al. (2006), del 69,6%; en Argentina (provincia de Chacos), del 35,5%, mediante inmunoblot (Dubey et al. (1999b); en Costa Rica, Dangoudoubiyam et al. (2011), del 42,2% y, en México (Estado de Durango), del 48,5%, por Yeargan et al. (2013).
La confirmación del diagnóstico de S. neurona en equinos, en Estados Unidos (Hamir et al. 1993); el diagnóstico en Brasil, estado de São Paulo, de EPM por S. neurona (Peixoto et al. 2003); en México, en un equino con síndrome neurológico, que diagnosticaron la presencia de S. neurona (Fuentes et al. 2001); en Uruguay, por la presencia de tres casos clínicos con sintomatología nerviosa, ocurridos durante el 2002 y 2003, en equinos mayores de 5 años y donde se aislaron esporoquistes de S. neurona en zarigüeyas, del genero D. albiventris (Noya et al. 2007); en Argentina (Moré, 2011), quien hizo el primer reporte de MEP en una yegua de 12 años, que presentaba ataxia y arpeo bilateral y donde se confirmó mediante inmunohistoquímica y la evidencia de merozoitos de S. neurona, en la médula y en el encéfalo; Masri et al. (1992), en Brasil, en dos equinos con ataxia que, en la necropsia hallaron esquizontes de S. neurona en cerebro y en médula espinal, cuyo diagnóstico se hizo por inmunohistoquímica, son todas éstas, evidencias serológicas, clínicas y patológicas, mostrando que en las Américas, se presentan casos clínicos de EPM y, ante sintomatología nerviosa en los equinos, se debe incluir a S. neurona, en el diagnóstico diferencial (Yeargan et al. 2013) y con la alta seroprevalencia determinada en este estudio, conviene tenerla presente en nuestro medio, para el diagnóstico.
Se han determinado especies aberrantes para S. neurona; por ejemplo, Stanek et al. (2003), en Ohio (USA), encontraron que en el 40% de los gatos de granjas equinas hubo circulación de S. neurona y, en el 10% de los gatos que asistieron a una jornada de esterilización, presentaron anticuerpos; Hsu et al. (2010) determinaron una seroprevalencia del 7% en gatos domésticos de Virginia y en Pennsylvania, mediante IFI y Choque et al. (2007) observaron ooquistes o esporoquistes de Sarcocystis spp. en caninos asociados con llamas.
Valinezhad et al. (2008), en Irán, por histopatología, detectaron la prevalencia de Sarcocystis spp. en camellos (Camelus spp.), en el 83,6% y proponen que los carnívoros salvajes y domésticos, como los caninos, pueden ser los hospederos finales de Sarcocystis spp. Cooley et al. (2013), en Estados Unidos, por PCR, confirmaron protozoos en caninos y concluyen que estos son hospederos aberrantes para S. neurona. Ellison et al. (2012), en Alemania, afirman que la infección por S. neurona es identificada erróneamente como S. canis y que el ciclo de vida de S. canis y el rol de S. neurona en perros es aún desconocida y que la incidencia de S. neurona en los caninos es desconocida. Aunque este estudio no incluyó a los animales de compañía para el diagnóstico, en próximos estudios, se deben incluir, con el fin de conocer su papel epidemiológico, ya que estos pueden ser infectados y servir como hospederos, en la cadena de trasmisión.
Agradecimientos. Los autores agradecen a los diferentes propietarios y administradores de las fincas y caballerizas, sin cuya colaboración no sería posible haber adelantado este estudio. Conflicto de interés: El manuscrito fue preparado y revisado con la participación de todos los autores, quienes declaramos que no existe ningún conflicto de intereses, que ponga en riesgo la validez de los resultados presentados.
BIBLIOGRAFÍA
1. ARAUJO, L.; SOARES, F.L.; FRIEDRICH, F.J.; GOMES, Z.C.; AIRES, B.M.E.; WAYNE, N.C.E. 2011. Presença de Sarcocysits spp. em marsupiais da espécie Didelphis albiventris na região sul do estado do Rio Grande do Sul, Brasil. R. Bras. Cienc. Vet. 18(2/3):126- 128.
2. ARIAS, M.; YEARGAN, M.; FRANCISCO, I.; DANGOUDOUBIYAM, S.; BECERRA, P.; FRANCISCO, R.; SÁNCHEZ, A.R.; PAZ, S.A.; HOWE, D.K. 2012. Exposure to Sarcocystis spp. in horses from Spain determined by Western blot analysis using Sarcocystis neurona merozoites as heterologous antigen. Vet. Parasitol. 185(2-4):301-304.
3. BENTZ, B.G.; EALEY, K.A.; MORROW, J.; CLAYPOOL, P.L.; SAÑIKI, J.T. 2003. Seroprevalence of antibodies to Sarcocystis neurona in equids residing in Oklahoma. J. Vet. Diagn. Invest. 15(6):597-600.
4. CHEADLE, M.; LINDSAY, D.; ROWE, S.; DYKSTRA, C.C.; WILLIAMS, M.A.; SPENCER, J.A.; TOIVIO-K., M.A.; LENZ, S.D.; NEWTON, J.C.; ROLSMA, M.D.; BLAGBURN, B.L. 1999. Prevalence of antibodies to Neospora sp. in horses from Alabama and characterization of an isolate recovered from a naturally infected horse. Int. J. Parasitol. 29:1537-1543.
5. CONGRESO DE COLOMBIA. 1989. Estatuto Nacional de Protección Animal. Ley 84 de 1989. Por la cual se adopta el Estatuto de Protección de los Animales y se crean unas contravenciones y se regula lo referente a su procedimiento y competencia. Disponible desde Internet en: http://spac-05.tripod.com/id24.html (con acceso 15/11/13).
6. COOLEY, A.J.; BARR, B.; REJMANEK, D. 2013. Sarcocystis neurona Encephalitis in a dog. Vet. Pathol. 44(6):956-961.
7. CHOQUE, M.J.; CHÁVEZ, V.A.; PACHECO, P.A.; LEYVA, V.V.; PANEZ, S.; TICONA, S.D. 2007. Frecuencia de Sarcocystis sp. en perros pastores de asociaciones alpaqueras de Maranganí, Cusco. Rev. Inv. Vet. Perú. 18(1):84-88.
8. DANGOUDOUBIYAM, S.; OLIVEIRA, J.B.; VIQUEZ, C.; GÓMEZ, G.A.; GONZÁLEZ, O.; ROMERO, J.J.; KWOK, O.C.; DUBEY, J.P.; HOWE, D.K. 2011. Detection of antibodies against Sarcocystis neurona, Neospora spp., and Toxoplasma gondii in horses from Costa Rica. J. Parasitol. 97(3):522-524.
9. DUBEY, J.P.; KERBER, C.E.; GRANSTROM, D.E. 1999a. Serologic prevalence of Sarcocystis neurona, Toxoplasma gondii and Neospora caninum in horses in Brazil. J. Am. Vet. Med. Assoc. 215(7):970-972.
10. DUBEY, J.P.; VENTURINI, M.C.; VENTURINI, L.; MCKINNEY, J.; PECORARO, M. 1999b. Prevalence of antibodies to Sarcocystis neurona, Toxoplasma gondii and Neospora caninum in horses from Argentina. Vet. Parasitol. 86(1):59-62.
11. DUBEY, J.P.; LINDSAY, D.S.; SAVILLE, W.J.; REED, S.M.; GRANSTROM, D.E.; SPEER, C.A. 2001a. A review of Sarcocystis neurona and equine protozoal myeloencephalitis (EPM). Vet. Parasitol. 95:89-131.
12. DUBEY, J.P.; SUNDAR, N.; KWOK, O.C.; SAVILLE, W.J. 2013. Sarcocystis neurona infection in gamma interferon gene knockout (KO) mice: comparative infectivity of sporocysts in two strains of KO mice, effect of trypsin digestion on merozoite viability, and infectivity of bradyzoites to KO mice and cell culture. Vet Parasitol. 196(1-2):212-215.
13. DUBEY, J.P.; LINDSAY, D.S.; KERBER, C.E.; KASAI, N.; PENA, H.F.J.; GENNARI, S.M.; KWOK, O.C.H.; SHEN, S.K.; ROSENTHAL, B.M. 2001c. First isolation of Sarcocystis neurona from the South American opossum, Didelphis albiventris, from Brazil. Vet. Parasitol. 95:295-304.
14. ELLISON, S.; WITONSKY, S. 2009. Evidence that antibodies against recombinant SnSAG1 of Sarcocystis neurona merozoites are involved in infection and immunity in equine protozoal myeloencephalitis. Can. J. Vet. Res. 73(39):176-183.
15. ELLISON, S.; MAIER, K.; YOUNG, M. 2012. Prevalence of antibodies to Sarcocystis neurona in dogs with and without neurologic disease. Intern J. Appl. Res. Med. 10(3):243-248.
16. FENGER, C.K.; GRANSTROM, D.E.; LANGEMEIER, J.L.; STAMPER, S.; DONAHUE, J.M.; PATTERSON, J.S.; GAJADHAR, A.A.; MARTENIUK, J.V.; XIAOMIN, Z.; DUBEY, J.P. 1995. Identification of opossums (Didelphis virginiana) as the putative definitive host of Sarcocystis neurona. J. Parasitol. 81:916-919.
17. FIGUEROA, C.; BRIEVA, C.; TRUJILLO, M.; MORENO, O. 2009. Experiencias sobre manejo y crianza de zarigüeyas (Didelphis albiventris). Rev. Mem. Conf. Intern. Med. Aprovech. Fauna Exot. Silv. no Convenc. 5(1):69-73.
18. FUENTES, G.J.; MASRI D.M.; ESQUIVEL, M.A.; RAMÍREZ, L.J. 2001. Mieloencefalitis protozoaria equina, primer informe de un caso en México. Rev. Sanid. Milit. Mex. 55(1):36-40.
19. HAMIR, A.N.; MOSER, G.; GALLIGAN, D.T.; DAVIS, S.W.; GRANSTROM, DE.; DUBEY, J.P. 1993. Immunohistochemical study to demonstrate Sarcocystis neurona in equine protozoal myeloencephalitis. J. Vet. Diagn. Invest. 5:418-422.
20. HOANE, J.S.; GENNARI, S.M.; DUBEY, J.P.; RIBEIRO, M.G.; BORGES, A.S.; YAI, L.E.; AGUIAR, D.M.; CAVALCANTE, G.T.; BONESI, G.L.; HOWE, D.K. 2006. Prevalence of Sarcocystis neurona and Neospora spp. infection in horses from Brazil based on presence of serum antibodies to parasite surface antigen. Vet. Parasitol. 136:155-159.
21. HOUK, A.E.; GOODWIN, D.G.; ZAJAC, A.M.; BARR, S.C.; DUBEY, J.P.; LINDSAY, D.S. 2010. Prevalence of antibodies to Trypanosoma cruzi, Toxoplasma gondii, Encephalitozoon cuniculi, Sarcocystis neurona, Besnoitia darlingi, and Neospora caninum in North American opossums, Didelphis virginiana, from southern Louisiana. J Parasitol. 96(6):1119- 1122.
22. HSU, V.; GRANT, D.C.; DUBEY, J.P.; ZAJAC, A.M.; LINDSAY, D.S. 2010. Prevalence of antibodies to Sarcocystis neurona in cats from Virginia and Pennsylvania. Parasitol. 96(4):800-801.
23. LINDSAY, D.S.; MITCHELL, M.S.; VIANNA, M.C.; DUBEY, J.P. 2004. Sarcocystis neurona (protozoa: apicomplexa): Description of oocysts, sporocysts, sporozoites, excystation and early development. J. Parasitol. 90(3):461465.
24. MASRI, M.D.; LOPEZ, DE A.J.; DUBEY, JP. 1992. Sarcocystis neurona associated ataxia in horses in Brazil. Vet. Parasitol. 44:311-314.
25. MATEU, E.; CASAL, J. 2003. Tamaño de la muestra. Rev. Epidem. Med. Prev. 1:8-14.
26. MEDINA, C.E.; OLIVER, O.J. 2003. Mieloencefalitis protozoica equina: Reporte de caso. Rev. Med. Vet. Zoot. 50:6-9.
27. MINISTERIO DE AGRICULTURA Y DESARROLLO RURAL -MADR-. 2010. Encuesta nacional agropecuaria 2010. Disponible desde Internet en: http://www.agronet.gov.co/www/htm3b/public/ena/ENA_2010.pdf (con acceso 15/11/13).
28. MONTEIRO, R.M.; KEID, L.B.; RICHTZENHAIN, L.J.; VALADAS, S.Y.; MULLER, T.; SOARES, R.M. 2013. Extensively variable surface antigens of Sarcocystis spp. infecting Brazilian marsupials in the genus Didelphis occur in myriad allelic combinations, suggesting sexual recombination has aided their diversification. Vet Parasitol. 196(1-2):64-70.
29. MORALES, J.A.L.; SÁNCHEZ, F.; POVEDA, K.; CADENA, A. 2004. Mamíferos terrestres y voladores de Colombia, Guía de Campo. Bogotá, Colombia. 248p.
30. MORÉ, G.A. 2011. Mieloencefalitis equina por protozoos. Rev. Med. Vet. (B. Aires). 92(5/6):95-104.
31. MOURA, R.L.; JÚNIOR, A.F.; TREVISAN, O.S.R.; SILVA, F.M.M.; COELHO, H.E. 2008. Sarcocystis neurona associado à mieloencefalite protozoária eqüina em Pirenópolis-go: Relato de caso. Ensaios e Ciência: C. Biológicas, Agrárias e da Saúde. 12(2):139-149.
32. MULLANEY, T.; MURPHY, A.J.; KIUPEL, M.; BELL, J.A.; ROSSANO, M.G.; MANSFIELD, L.S. 2005. Evidence to support horses as natural intermediate hosts for Sarcocystis neurona. Vet. Parasitol. 133:27-36.
33. NOYA, F.A.; DELUCCHI, L.; CASTRO, J.E. 2007. Primera comprobación de Sarcocystis spp. en Didelphis albiventris (comadreja mora) en Uruguay. Veterinaria. (Montevideo). 42(167):23-26.
34. PAIXÃO, T.A.; OLIVERA, R. DE P.I.O.; SANTOS, DE L.R. 2007. Anti-Sarcocystis neurona immunostaining associated with equine protozoal myeloencephalitis in Brazil. Ciência Rural. 378(6):1820-1823.
35. PARRA, V.; VÉLEZ, C.A.; GARCÍA, J.C. 2012. Sarcocistosis humana. Presentación de um caso y revisión de literatura. Acta Colom. Cuidado Intensivo. 12(2):95-99.
36. PEIXOTO, P.C.; KUCHEMBUCK, R.G.; GONÇALVES, R.C.; CHIACCHIO, S.B.; KOHAYAGAWA, A.; CASTRO, A.P. 2003. Mieloencefalite protozoária eqüina. Rev. Bras. Saúde Prod. An. 4(1):30-34.
37. PEREIRA, U.J.; MARTINS, A.R. 2010. Mieloencefalite protozoária equina. Vet. e Zootec. 17(2):163-176.
38. PITEL, P.H.; PRONOST, S.; GARGALA, G.; ANRIOUD, D.; TOQUET, M.P.; FOUCHER, N.; COLLOBERT, L.C.; FORTIER, G.; BALLE, J.J. 2002. Detection of Sarcocystis neurona antibodies in French horses with neurological signs. Int. J. Parasitol. 32:481-485.
39. PIVOTO, F.L.; DE MACEDO, A.G.; DA SILVA, M.V.; FERREIRA, F.B.; SILVA, D.A.; POMPERMAYER, E.; SANGIONI, L.A.; MINEO, T.W.; VOGEL, F.S. 2014. Serological status of mares in parturition and the levels of antibodies (IgG) against protozoan family Sarcocystidae from their pre colostral foals. Vet. Parasitol. 199(1-2):107-111.40. PULIDO, I.; MANDIUS, R.; RIVERO, T.; DUARTE, O. 2002. Atlas de los sistemas de producción bovina. Modulo región Caribe. Plan de modernización tecnológica de la ganadería bovina colombiana. Bogotá (Colombia). Corpoica. 86p.
41. PUSTERLA, N.; TAMEZ, E.; BLANCO, A.; VANGEEM, J.; PACKHAM, A.; CONRAD, P.A.; KASS, P. 2014. Comparison of prevalence factors in horses with and without seropositivity to Neospora hughesi and/or Sarcocystis neurona. Vet J. 200 (2):332-334.
42. STATISTICAL ANALYSIS SYSTEM INSTITUTE -SAS-. 2007. SAS/STAT User's Guide (Release 9.1), Cary: NC, USA.
43. SAVILLE, W.; MORLEY, P.; REED, S.; GRANSTROM, D.; KOHN, C.; HINCHCLIFF, K.; WITTUM, T. 2000. Analysis of risk factors for the development of equine protozoal myeloencephalitis in horses. J. Am. Vet. Med. Assoc. 217:1174-1180.
44. SAVILLE, W.J.; SOFALY, C.D.; REED, S.M.; DUBEY, J.P.; OGLESBEE, M.J.; LACOMBE, V.A.; KEENE, R.O.; GUGISBERG, K.M.; SWENSEN, S.W.; SHIPLEY, R.D.; CHIANG, Y.W.; CHU, H.J.; NG, T. 2004. An equine protozoal myeloencephalitis challenge model testing a second transport after inoculation with Sarcocystis neurona sporocysts J. Parasitol. 90:1406-1410.
45. SAVILLE, W.J.; STICH, R.W.; REED, S.M.; NJOKU, C.J.; OGLESBEE, M.J.; WUNSCHMANN, A.; GROVER, D.L.; LAREW-NAUGLE, A.L.; STANEK, J.F.; GRANSTROM, D.E.; DUBEY, J.P. 2001. Utilization of stress in the development of an equine model for equine protozoal myeloencephalitis. Vet. Parasitol. 95:211-222.
46. SELLON, D.C.; KNOWLES, D.P.; GREINER, E.C. ; LONG, M.T.; HINES, M.T.; HOCHSTATTER, T.; TIBARY, A.; DAM, J.B. 2004. Infection of Immunodeficient Horses with Sarcocystis neurona does not result in neurologic disease. Clin. Diagn Lab. Immunol.11(6):1134-1139.
47. STANEK, A.J.F.; STICH, A.R.W.; DUBEY, B.J.P.; REEDC, S.M.; NJOKU, A.C.J.; LINDSAY, D.D.S.; SCHMALL, C.L.M.; JOHNSON, E.G.K.; LAFAVE, F.B.M.; SAVILLE, W.J.A. 2003. Epidemiology of Sarcocystis neurona infections in domestic cats (Felis domesticus) and its association with equine protozoal myeloencephalitis (EPM) case farms and feral cats from a mobile spay and neuter clinic. Vet. Parasitol. 117:239-249.
48. VALINEZHAD, A.; ORYAN, A.; AHMAD, N. 2008. Sarcocystis and its complications in Camels (Camelus dromedarius) of eastern provinces of Iran. Korean J. Parasitol. 46(4):229-234.
49. WRIGHT, B.; KENNEY, D. 2010. Equine Protozoal Myeloencephalitis (EPM). Ministry of Agriculture, Food and Rural Affairs. Disponible desde Internet en: http://www.omafra.gov.on.ca/english/livestock/horses/facts/info epm.pdf (con acceso 10/02/14).
50. YABSLEY, M.J.; JORDAN, C.N.; MITCHELL, S.M.; NORTON, T.M.; LINDSAY, D.S. 2007. Seroprevalence of Toxoplasma gondii, Sarcocystis neurona, and Encephalitozoon cuniculi in three species of lemurs from St. Catherines Island, GA, USA. Vet. Parasitol. 144(1-2):28-32.
51. YEARGAN, M.R.; ALVARADO, E.C.; DUBEY, J.P.; HOWE, D.K. 2013. Prevalence of antibodies to Sarcocystis neurona and Neospora hughesi in horses from Mexico. Parasite. 20. On line, artic. No. 29:5.
Recibido: Febrero 6 de 2014 Aceptado: Septiembre 1 de 2014

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.