CIENCIAS NATURALES-Reporte de Caso
CRECIMIENTO DE PLÁNTULAS DE PEPINO POINSETT 76 CON REMOCIÓN DE HOJAS COTILEDONALES
POINSETT 76 CUCUMBER SEEDLINGS GROWTH WITH COTILEDONARY LEAVES REMOVAL
Fernando Barraza A.1
1 Ingeniero Agrónomo, M.Sc. Horticultura, Ph.D. Horticultura, Profesor investigador. Universidad de Córdoba, Facultad de Ciencias Agrícolas, Departamento de Ingeniería Agronómica y Desarrollo Rural. Carrera 6 No.76-103, Montería, Colombia, e-mail: fbarraza@correo.unicordoba.edu.co
Rev. U.D.C.A Act.. & Div. Cient. 20(2): 479-484, Julio Diciembre, 2017
https://doi.org/10.31910/rudca.v20.n2.2017.383
INTRODUCCIÓN
El pepino (Cucumis sativus L.) pertenece a la familia cucurbitácea y es la cuarta hortaliza más sembrada en el mundo. En 2016, el 70% del volumen total lo produjo China, con 54,3 millones de toneladas (Adeoye & Balogun, 2016).
Un tópico importante de investigación en fase de semillero de pepino y otras cucurbitáceas, como Citrullus colocynthis, C. lanatus, Cucumis melo, Lagenaria siceraria, Luffa acntangula y Cucurbita maxima x C. moschata es el conocimiento de la contribución de las hojas cotiledonales en el crecimiento inicial de plántulas, debido a que tienen rápida expansión, generación de cloroplastos, producción de clorofila y realizan fotosíntesis (Amarante et al. 1995; Jafari et al. 2015), lo que influye en la acumulación de biomasa y crecimiento longitudinal del hipocotilo, que favorece vigor y establecimiento (Shibuya et al. 2016; Celis et al. 2008).
Por el tipo de germinación epigea de las semillas de pepino y de otras especies Sesbania vesicaria, Gossypium hirsutum y Prosopis glandulosa, los cotiledones se exponen a condiciones ambientales en emergencia. Estos órganos aportan sustancias de reserva, fotosintatos y hormonas promotoras del crecimiento a las plántulas (Tischler et al. 2000). Junto con Cynoglossum divaricatum, Amaranthus retroflexus, Medicago lupina, Ipomoea hederacea, Arabidopsis thaliana, Brassica rapa, Glycine max, Helianthus annuus, Sinapis alba, Phaseolus vulgaris, Vigna sinensis y Ricinus communis, se reporta que el daño parcial o total en sus cotiledones afecta la supervivencia y el desempeño reproductivo, ya que aumentan respiración, etileno y senescencia (Zhang et al. 2010; Zhang et al. 2011; Zheng et al. 2011; Procko et al. 2014).
El presente estudio tuvo como objetivo conocer el comportamiento de las variables que describen el crecimiento de plántulas del genotipo de pepino Poinsett 76, cuando fue sometido a tratamientos de remoción de hojas cotiledonales, en diferentes tiempos, en la fase de semillero.
MATERIALES Y MÉTODOS
Localización. La investigación, se realizó entre febrero 11 y marzo 2 de 2017, en el campo experimental de cultivos de hortalizas de la Universidad de Córdoba - Montería, Colombia, a 8°44'53" latitud Norte y 75°52'53" longitud Oeste, altitud 20msnm, temperatura ambiente promedio 27,4°C, precipitación promedia anual 1.225mm y humedad relativa promedio 78% (Climate-Data.org, 2016).
Diseño experimental y tratamientos. Se hizo un bioensayo de crecimiento de plántulas de pepino variedad Poinsett 76®, con diseño completamente al azar, cuatro repeticiones y seis tratamientos: T0, testigo; T1, remoción hojas cotiledonales HC 3 días después de emergencia dde; T2. remoción HC 6dde; T3, remoción HC 9dde; T4, remoción HC 12dde y T5, remoción HC15dde.
Se tuvieron 24 unidades experimentales, con 20 plántulas cada una. Para obtención de cada plántula, se sembró una semilla a profundidad 0,5cm, en vaso de polietileno espumado blanco, de 470cm3 de capacidad, con sustrato mezcla 1:1 tierra de aluvión y arena de río, recién extraídas. La separación entre cada vaso con plántula fue 5cm y entre unidades experimentales 10cm, de manera que las unidades experimentales ocuparon una superficie de 20m2. A 1,0m de altura de la superficie experimental, se colocó malla sombra de 50% en polietileno negro, sostenida con varas de madera y alambre calibre 12.
Variables de respuesta. Desde 3dde hasta 20dde, se tomaron datos de las siguientes variables cada tercer día, como promedio de mediciones, a tres plántulas centrales, marcadas en cada repetición: altura de plántula AP; en cm la longitud desde el cuello de la raíz de la plántula hasta el ápice de la hoja más larga expandida; diámetro del tallo DT, a 1cm de la base de la plántula, con Vernier digital Truper® en mm; número de hojas verdaderas NHV, mediante conteo de hojas verdaderas expandidas; área de hojas cotiledonales AHC y área de hojas verdaderas AHV, expresadas en cm2, obtenidas con software DDA (Ferreira et al. 2009) y scanner HP ScanJet® 3400 C, tomando promedio de mediciones a otras tres plántulas centrales, seleccionadas en cada repetición y materia seca total MST. Las mismas plántulas anteriores secadas en horno eléctrico Memmert® U10 a 85°C hasta peso constante y pesadas en balanza electrónica Ohaus® Explorer EX1103.
Procesamiento estadístico. A las variables estudiadas, se les realizó análisis de varianza, mediante procedimiento PROC ANDEVA y prueba de comparación de medias de Tukey (P ≤ 0,05), con software SAS versión 9.1.3 (SAS Institute, 2008); para conocer inicialmente el comportamiento de los datos obtenidos, se utilizó software Curve Expert versión 1.3 (Hyams, 2003). Por las características de la información, se hizo análisis de regresión no lineal PROC NLIN con software SAS versión 9.1.3 (SAS Institute, 2008) y se ajustaron los datos al modelo logístico (Calvo et al. 1994): y=A/ (1+B*e-Cx), cuyos componentes son: y, cada una de las variables del crecimiento; A, máximo valor observado en cada variable; B, no tiene significado biológico y solo toma lugar en el tiempo inicial x=0; x, días después de emergencia; C, parámetro relacionado con el valor de x para el punto de inflexión y e, base del logaritmo natural. La proporción de variabilidad de los datos experimentales explicada por los modelos obtenidos, se estimó con el coeficiente de determinación R2, mediante la ecuación R2=SCt/SCT, donde: SCt=suma de cuadrados de los tratamientos y SCT=suma de cuadrados total.
RESULTADOS Y DISCUSIÓN
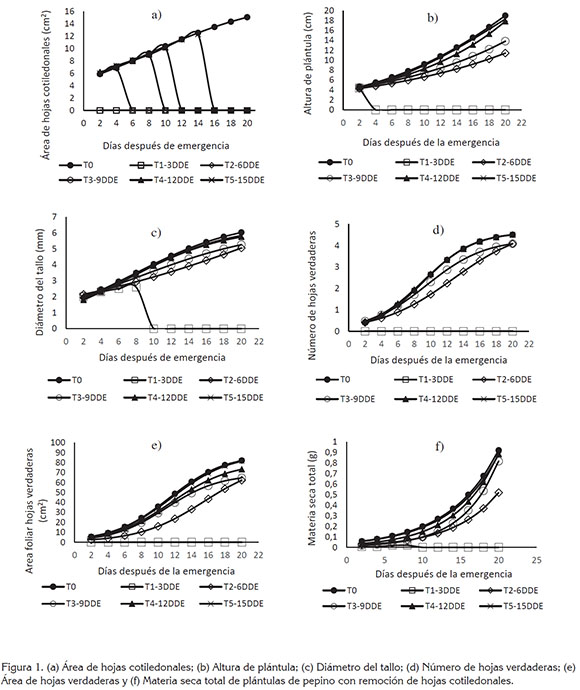
Aspecto general del crecimiento de plántulas. Las variables AHC, AP, DT, NHV, AHV y MST tuvieron ajuste al modelo logístico y en la figura 1, se muestra que su representación gráfica fue sigmoide, la cual, según lo indicado por Moran et al. (1990), puede describir cuantitativamente la magnitud de los cambios estructurales, que ocurrieron durante el proceso de crecimiento.

En términos generales, se observó que la remoción de HC tuvo impacto negativo sobre el patrón de acumulación de materia seca para los tratamientos con remoción a los 3, 6, 9 y 12dde, cuyas trayectorias gráficas estuvieron por debajo del tratamiento testigo, que se asume como una situación normal de crecimiento, sin perturbación a las HC.
De acuerdo con lo anterior es importante señalar que, según los planteamientos de Prakash et al. (2001), el efecto ocasionado por el corte de HC sobre las variables del crecimiento puede ser equivalente al causado por cualquier alteración en la integridad de dichos órganos, ya sea por daños mecánicos, fisiopatías, ataque de plagas o enfermedades, lo que, de acuerdo con Yu et al. (2016), afecta a nivel fisiológico, la estructura de las proteínas y ocasiona aumento en la respiración, senescencia, pérdida de pigmentos, disminución en el transporte de electrones, desestabilización en las membranas de los tilacoides y estructura de los cloroplastos.
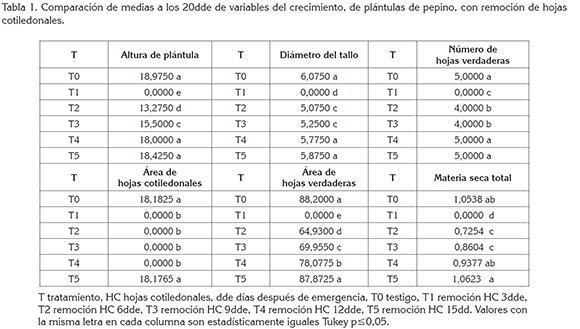
AHC. En la figura 1, se observa que el AHC aumentó a medida que transcurrió el ciclo biológico de las plántulas. A los 20dde, los tratamientos testigo y con remoción HC 15dds alcanzaron mayor valor promedio y superaron con diferencias estadísticas significativas a los demás tratamientos (Tabla 1).
Con remoción de HC a los 3dde, la magnitud de AP, DT, NHV, AHV y MST decreció a cero con muerte de plántulas a los 7dde y no se obtuvieron modelos matemáticos. De acuerdo con lo anterior, se puede considerar, en concordancia con reportes de Penny et al. (1976) y Thomson et al. (2003), que una vez ocurrida la emergencia, los cotiledones dejaron de ser órganos de almacenamiento, para asumir funciones fisiológicas, como principales órganos fotosintéticos, de los cuales, depende la dinámica de la relación fuente-demanda de carbohidratos producidos y almacenados, durante los primeros estados del crecimiento, para contribuir al vigor inicial de las plántulas y afrontar las condiciones ambientales adversas que se pudieran presentar durante la emergencia y, de acuerdo con Jellani et al. (2015), en Cucumis melo y Cucumis sativus, se han encontrado ventajas, como acortamiento del ciclo de cultivo y producción temprana.
AP y DT. A los 20dde, el testigo y los tratamientos con remoción de HC a los 12 y 15dde fueron estadísticamente iguales y superiores en grado significativo a los tratamientos con remoción, a los 3, 6 y 9dde (Tabla 1).
De acuerdo con lo anterior, la disminución del crecimiento en longitud y diámetro del tallo puede estar relacionada con los planteamientos de Asahina et al. (2007), quienes indican que si ocurren daños en los tejidos de las hojas cotiledonales o son cortados, se puede afectar la síntesis y el mantenimiento de los niveles de ácido giberélico y sus precursores en el hipocotilo de las plántulas, sustancias requeridas para formación y crecimiento de los tejidos de la corteza, ocurriendo, además, menor toma de agua y nutrimentos, lo que ocasiona choque osmótico, con pérdida de electrolitos, de aminoácidos y de proteínas, de las hojas y del tallo.
Los menores valores de AP y DT en los tratamientos con remoción de HC a los 3, 6 y 9dde también se pueden relacionar con complejos cambios bioquímicos, ocasionados por la remoción de HC, que afectaron el balance de fitohormonas, principalmente, auxinas, las cuales, regulan el crecimiento del hipocotilo y tienen influencia en la expresión del potencial genético y rendimiento (Procko et al. 2014), ya que, según reportan Albanna et al. (2016), la disminución en el crecimiento genera estrés en las plántulas y afecta la síntesis y aprovechamiento de metabolitos de reserva, fotosintatos, clorofila, proteínas, aminoácidos y vitaminas.
NHV y AHV. Para todos los tratamientos, la emisión de HV comenzó a los 4dde; a los 20dde, los tratamientos testigo y la remoción de HC, a los 12 y 15dde presentaron 5 HV y fueron estadísticamente iguales y superiores a los demás tratamientos. Con la remoción de HC, a los 6 y 9dde, se presentaron 4 HV y con remoción de HC, a los 3dde, no hubo emisión de HV (Tabla 1).
El menor NHV encontrado para los tratamientos con remoción de HC a los 3, 6 y 9dde, se puede explicar, en términos de los reportes de Bisognin et al. (2005), en relación a que las plántulas de pepino presentan fuerte dependencia de la actividad fotosintética de las HC durante su fase inicial de establecimiento, mientras apareció la primera hoja verdadera, a los 4dde. En este sentido, de acuerdo con lo reportado por Bandurska et al. (2011), la eliminación de hojas cotiledonales provocó bajo contenido o falta de clorofila, lo que resulta en una situación, en la cual, los órganos no son capaces de cumplir sus funciones fotosintéticas y conduce a formación alterada de las hojas y, ocasionalmente, muerte de plántulas, como sucedió con el tratamiento de remoción de HC, a los 3dde.
En lo que respecta a AHV, los tratamientos testigo y con remoción de HC, a los 15dde, presentaron área foliar de 0,0088m2, a los 20dde y fueron estadísticamente iguales entre sí y superiores a los tratamientos con remoción de HC, a los 3, 6, 9 y 12dde, con los que se obtuvieron 0, 0,0065 y 0,0070cm2, respectivamente (Tabla 1).
Teniendo en cuenta lo anterior, la remoción de HC, a los 3, 6, 9 y 12dde, se constituyó en una situación perturbadora para el crecimiento con generación de estrés que, en concordancia con lo reportado -para pepino- por Kokilavani & Rajendiran (2014) y Savvides et al. (2017), provocó una respuesta de plasticidad fenotípica, manifestada en la capacidad para disminuir AHV, como un cambio en la expresión del potencial genético moldeando y adaptando su morfología, estructura y fisiología, de tal manera, que se obtienen plántulas con poco vigor y menos capacidad competitiva, por la oferta de factores ambientales, durante el establecimiento.
MST. Los tratamientos testigo y con remoción de HC, a los 15dde, presentaron mayor acumulación MST y fueron estadísticamente iguales y superiores en grado significativo a los tratamientos con remoción de HC, a los 3, 6, 9 y 12dde (Tabla 1).
La menor acumulación de MST con remoción de HC, 3, 6, 9 y 12dde, se puede considerar, de acuerdo con lo reportado por Haque et al. (2009), como una respuesta de las plántulas al estrés, ocasionado en el proceso de crecimiento, por la remoción de los principales órganos fotosintéticos durante, al menos, los primeros 15dde de las plántulas, ya que se podría disminuir o hacerse nula la captación y el aprovechamiento de la radiación fotosintéticamente activa, como principal factor que regula la fotosíntesis, la acumulación de materia seca y el rendimiento en el cultivo y, de acuerdo con estudios de Yu et al. (2016), puede tener manifestaciones inmediatas en el crecimiento, que se observaron en disminución de la magnitud de variables AP, DT, NHV y AHV.
Las principales características fenotípicas del material vegetal, listo para trasplante a los 15dde, vislumbrada a través de los resultados obtenidos con las variables del crecimiento, se pueden resumir como plántulas con AP, de 0,19m; DT, de 0,006m; NHV, de 5 y AHV, de 0,0088m2.
Es importante considerar, con relación a los resultados presentados, que el manejo agronómico, para obtener plántulas de pepino con vigor y calidad morfológica y fisiológica, que permitan un buen establecimiento y expresión del máximo potencial genético, debe estar dirigido, en cuanto a HC, hacia el cuidado de dichas estructuras, de cualquier factor adverso, que las afecte durante los primeros 15dde, ya que son los principales órganos fotosintéticos, de los cuales, depende el crecimiento durante los primeros días después de la emergencia, lo que, en concordancia con lo reportado por Cho et al. (2007) y Mello et al. (2016), es fundamental para la obtención de plántulas de alta calidad, uno de los factores que más determina la producción del cultivo de pepino.
Conflictos de intereses: El manuscrito fue preparado y revisado por el autor, quien declara que no existe conflicto de intereses que ponga en riesgo la validez de los resultados presentados. Financiación: Este estudio fue financiado por la Universidad de Córdoba.
BIBLIOGRAFÍA
1. ADEOYE, I.; BALOGUN, O. 2016. Profitability and efficiency of cucumber production among smallholder farmers in Oyo state, Nigeria. J. Agr. Sci. (Sri Lanka).61(4):387-398.
2. ALBANNA, L.; SALEM, N.; AWWAD, A. 2016. Seed germination and growth of cucumber (Cucumis sativus): effect of nano-crystalline sulfur. J. Agric. Sci. (Canadá). 8(10):219-225.
3. AMARANTE, C.; BISOGNIN, D.; CANCI, P. 1995. Contribuição das folhas cotiledonares para o crescimento inicial de plantas de abóbora híbrida cv. Tetsukabuto. Ciênc. Rural. (Brasil). 25(1):17-21.
4. ASAHINA, M.; YAMAUCHI, Y.; HANADA, H.; KAMIYA, Y.; KAMADA, H.; SATOH, S.; YAMAGUCHI, S. 2007. Effects of the removal of cotyledons on endogenous gibberellin levels in hypocotyls of young cucumber and tomato seedlings. Plant Biotechnol. (Japón). 24:99-106.
5. BANDURSKA, H.; KRZYSZKOWSKA, J.; MOLINSKI, K.; ZIELEZINSKA, M. 2011. A method of early selection of cucumber genotypes insensitive to chilling based on data mining. Acta Sci. Pol. (Polonia). 10(2):225-233.
6. BISOGNIN, D.; VELASQUEZ, L.; WIDDERS, I. 2005. Cucumber seedling dependence on cotyledonary leaves for early growth. Pesq. Agropec. Bras. (Brasil). 40(6):531-539.
7. CALVO, R.; GONZÁLEZ, J.; PÉREZ, S. 1994. Manual de modelos no lineales en los ámbitos agronómico, ganadero y forestal. Ministerio de Agricultura, Pesca y Alimentación. Instituto Nacional de Investigación y Tecnología Agraria y Alimentaria. Madrid, España.110p.
8. CELIS, R.; PEÑA, C.; TREJO, C.; AGUIRRE, J.; CORDOVA, L.; CARBALLO, A. 2008. Consumo de reservas de la semilla de frijol para la emergencia y desarrollo inicial en diferentes profundidades de siembra. Agron. mesoam. (Costa Rica). 19(2):167-177.
9. CHO, Y.; SUNGBONG, O.; MYOUNG, M.; SON, J. 2007.
Estimation of individual leaf area, fresh weight, and dry weight of hydroponically grown cucumbers (Cucumis sativus L.) using leaf length, width, and SPAD value. Sci, Hortic. (Holanda). 111:330-334.
10. CLIMATE-DATA.ORG. 2016. Clima: Montería, Colombia. Disponible desde Internet en: http://es.climate-data.org/location/5123/ (con acceso el 14/07/2016).
11. FERREIRA, O.; ROSSI, F.; ANDRIGHETTO, C. 2009. DDA-Determinador digital de áreas. Software para determinação de área foliar, índice de área foliar e área de olho de lombo. Versão 1.2. Instituto Federal de Educação, Ciéncia e tecnologia. Farroupilha. Campus Santo Augusto. Brasil.
12. HAQUE, M.; HASANUZZAMAN, M.; RAHMAN, M. 2009. Morpho-physiology and yield of cucumber (Cucumis sativa) under varying light intensity. Acad. J. Plant. Sci. (Emiratos Árabes Unidos). 2(3):154-157.
13. HYAMS, D. 2003. Curve Expert 1.3. A comprehensive curve fitting system for Windows©. Unregistered evaluation copy. USA.
14. JAFARI, S.; ARVIN, S.; KALANTARI, K. 2015. Response of cucumber (Cucumis sativus L.) seedlings to exogenous silicon and salicylic acid under osmotic stress. Acta Biol. Szeged. (Hungría). 59(1):25-33.
15. JELLANI, G.; ATIF, M.; ULLAH, H.; ALI, M.; MUSA, M. 2015. Influence of seedling age on cucumber (Cucumis sativus L.) production. SAARC J. Agri. (Bangladesh). 13(2):214-221.
16. KOKILAVANI, V.; RAJENDIRAN, K. 2014. Ultraviolet-b induced changes in the leaf architecture of Cucumis sativus L. VAR. CO 1. Int. J. Geo. Earth Env. Sc. (India). 4(2):208-215.
17. MELLO, B.; TREVISAN, M.; STEINER, F. 2016. Quality of cucumber seedlings grown in different containers. Rev. Agr. Neot. (Brasil). 3(1):33-38.
18. MORAN, R.; VERNON, L.; PORATH, D.; ARZEE, T. 1990. Developmental stages of cucumber seedlings. Plant. Physiol. (Estados Unidos de América). 92:1075-1080.
19. PENNY, M.; MOORE, K.; LOVELL, P. 1976. The effects of inhibition of cotyledon photosynthesis on seedling development in Cucumis sativus L. Ann. Bot. (Inglaterra). 40(4):815-824.
20. PRAKASH, J.; BAIG, M.; MOHANTY, P. 2001. Differential changes in the steady state levels of thylakoid membrane proteins during senescence in Cucumis sativus cotyledons. Z. Naturforsch. (Alemania). 56:585-592.
21. PROCKO, C.; CRENSHAW, C.; LJUNG, K.; NOEL, J.; CHORY, J. 2014. Cotyledon-generated auxin is required for shade-induced hypocotyl growth in Brassica rapa. Plant Physiol. (Estados Unidos de América). 165:1285-1301.
22. SAS INSTITUTE INC. 2008. Statistical analysis system. The SAS© system for Windows© version 9.1.3. The Power to Know. Cary, NC, EEUU.
23. SAVVIDES, A.; IEPEREN, W.; DIELEMAN, J.; MARCELIS, L. 2017. Phenotypic plasticity to altered apical bud temperature in Cucumis sativus: more leaves-smaller leaves and viceversa. Plant. Cell. Environ. (Estados Unidos de América). 40:69-79.
24. SHIBUYA, T.; ENDO, R.; KITAYA, Y. 2016. Growth analysis and photosynthesis measurements of cucumber seedlings grown under light with different red to far-red ratios. Hort. Sci. (República Checa). 51(7):843-846.
25. THOMSON, V.; CUNNINGHAM, S.; BALL, M.; NICOTRA, A. 2003. Compensation for herbivory by Cucumis sativus through increased photosynthetic capacity and efficiency. Oecologia. (Alemania). 134:167-175.
26. TISCHLER, C.; POLLEY, H.; JOHNSON, H.; PENNINGTON, R. 2000. Seedling response to elevated CO2 in five epigeal species. Int. J. Plant Sci. (Estados Unidos de América). 161(5):779-783.
27. YU, X.; ZHOU, R.; WANG, X.; KJÆR, K.; ROSENQVIST, E.; OTTOSEN, C.; CHEN, J. 2016. Evaluation of genotypic variation during leaf development in four Cucumis genotypes and their response to high light conditions. Environ. Exp. Bot. (Inglaterra). 124:100-109.
28. ZHANG, H.; ZHOU, D.; MATTHEW, C.; WANG, P.; ZHENG, W. 2010. Photosynthetic contribution of cotyledons to early seedling development in Cynoglossum divaricatum and Amaranthus retroflexus. New Zeal. J. Bot. (Nueva Zelanda). 46(1):39-48.
29. ZHANG, S.; ZHAO, C.; LAMB, E. 2011. Cotyledon damage affects seed number through final plant size in the anual grassland species Medicago lupulina. Ann. Bot. (Inglaterra). 107:437-442.
30. ZHENG, W.; WANG, P.; ZHANG, H.; ZHOU, D. 2011. Photosynthetic characteristics of the cotyledon and first true leaf of castor (Ricinus communis L.). Aust. J. Crop. Sci. (Australia). 6:702-708.
Recibido: Agosto 1 de 2017 Aceptado: Octubre 11 de 2017

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.