
CIENCIAS EXACTAS Y NATURALES-Artículo Científico
DESARRROLLO Y EVALUACIÓN DE UN INÓCULO DE BACTERIAS CELULOLÍTICAS
DEVELOPMENT AND EVALUATION OF AN INOCULUM OF CELULOLYTIC BACTERIA
Paola Andrea Viteri Flórez1, David Arturo Castillo Guerra2, Silvio Edgar Viteri Rosero3
1 Ingeniera Agrónoma, M.Sc. Grupo Manejo Biológico de Cultivos, Escuela de Ingeniería Agronómica, Universidad Pedagógica y Tecnológica de Colombia. Av. Central del Norte, Tunja, Boyacá (Colombia), e-mail: gmbc@uptc.edu.co
2 Ingeniero Agrónomo, M.Sc. Grupo Manejo Biológico de Cultivos, Escuela de Ingeniería Agronómica, Universidad Pedagógica y Tecnológica de Colombia. Av. Central del Norte, Tunja, Boyacá, e-mail: gmbc@uptc.edu.co
3 Ingeniero Agrónomo, M.Sc., Ph.D., Docente titular, Programa Ingeniería Agronómica. Universidad Pedagógica y Tecnológica de Colombia. Av. Central del Norte, Tunja, Boyacá, e-mail: silvio.viteri@uptc.edu.co.
Rev. U.D.C.A act. & Div. Cient. 18(1): 207-215, Enero-Junio, 2015
RESUMEN
En Colombia, el manejo inapropiado de residuos sólidos continúa generando serios problemas relacionados con la contaminación de suelos, agua y aire. El objetivo de esta investigación fue desarrollar un inóculo de bacterias celulolíticas y evaluar su efectividad en la transformación de residuos sólidos orgánicos. El estudio incluyó muestras de suelo de cinco bosques nativos y cinco fincas productoras de cereales y de tres composteras. De cada muestra, se preparó una serie de dilución hasta 10-4. De cada dilución, se inocularon tubos que contenían medio mineral líquido y una tira de papel filtro. De las tiras de papel, que indicaron crecimiento de microorganismos, se realizaron subcultivos: primero, en medio Agar Nutritivo y, luego, en medio mineral sólido, suplementado con celulosa. Los aislamientos bacterianos obtenidos fueron evaluados por su capacidad celulolítica y los que mostraron mayor capacidad, probados por su compatibilidad para crecimiento. En total, se obtuvieron veinte aislamientos celulolíticos, 19 procedentes de los bosques nativos y uno de una compostera. No todos los aislamientos mostraron igual capacidad celulolítica; en cinco, no se visualizó el halo de hidrólisis y, en los otros 15, la amplitud del halo varió entre 0,10 y 0,65cm. Con base en la capacidad celulolítica y compatibilidad, el inóculo fue conformado con los aislamientos 1 (Bacillus sp.); 6 (Pseudomonas sp.) y, 7 (Erwinia sp.). La inoculación de las composteras con las bacterias celulolíticas seleccionadas o con los microorganismos del EM® y Agroplux®, no produjo efectos que, en el proceso de compostaje, se diferencien estadísticamente de los naturalmente producidos por los microorganismos nativos.
Palabras clave: Celulosa, microorganismos celulolíticos, biodegradación, descomposición.
SUMMARY
In Colombia, the inappropriate management of solid waste continues generating serious problems related with soil, water, and air contamination. The objective of this research was to generate an inoculum of cellulolytic bacteria and evaluate its effectiveness for the transformation of organic solid waste. The study included soil samples from five native forests and five cereal producing farms and from three compost piles. From each sample a serial dilution until 10-4 was prepared. From each soil dilution test tubes containing liquid mineral medium and a strip of filter paper were inoculated. From the filter paper strips which showed zones of degradation the microorganisms were streaked, first on Agar Nutrient and then on solid mineral medium, supplemented with cellulose. The bacteria isolates obtained were evaluated for their cellulolytic capacity and those which showed the highest capacity tested for growth compatibility. In total, 20 isolates of cellulolytic bacteria were obtained, 19 from the native forests and one from a compost pile. Not all the isolates showed equal cellulolytic capacity, 5 of them did not show a halo of hydrolysis of cellulose and in the other 15 the amplitude of the halo varied between 0.1 and 0.7cm. Based on the cellulolytic capacity and compatibility for growth the isolates 1 (Bacillus sp.), 6 (Pseudomonas sp.), and 7 (Erwinia sp.) were selected to generate the inoculum. The inoculation of the compost piles with the selected cellulolytic bacteria or with the EM® and Agroplux® microorganisms did not produce effects statistically different to those naturally produced by the native microorganisms in the composting process.
Key words: Cellulose, cellulolytic microorganisms, biodegradation, decomposition.
INTRODUCCIÓN
Colombia está catalogada como una sociedad de consumo en continuo crecimiento, donde la producción de residuos aumenta diariamente, asociada a factores, entre los cuales, sobresalen la tasa de urbanización, los patrones de consumo, las prácticas culturales de manejo, los ingresos, el uso de tecnologías y el desarrollo industrial (Penagos et al. 2011; Puerta, 2004).
La cantidad de residuos generada diariamente en el país es de 28.800 toneladas, de las cuales, 18.720 se clasifican como residuos orgánicos y 10.080, como inorgánicos (Rojas, 2005). De esta cantidad, el 88,5%, se dispone en rellenos sanitarios; el 8,7%, en botaderos a campo abierto; el 2,4%, en plantas de aprovechamiento; el 0,3% son enterrados y más del 0,1%, arrojados a las fuentes de agua o quemados a cielo abierto (MAVDT, 2008).
La descomposición de la fracción orgánica en los sitios de disposición genera productos que pueden contaminar el suelo, el aire y hasta las aguas subterráneas con metales pesados, como mercurio, plomo y cadmio y con sustancias cancerígenas, como el benceno o tóxicas, como el tricloroetileno. Cuando los residuos son lanzados directamente a los cuerpos de agua acelera el consumo del oxígeno, que es vital para la fauna y la flora acuática, generando riesgos sanitarios, malos olores y escasez de alimento, para las poblaciones que derivan su sustento, en gran parte, de la pesca (Sans & Ribas, 1989; Giraldo, 1998).
La parte orgánica de los residuos sólidos municipales se encuentra constituida por una fracción, fácilmente biodegradable, representada por azúcares simples, aminoácidos, ácidos alifáticos, grasas, aceites, ceras, resinas, pigmentos, proteínas y minerales y una fracción resistente a la biodegradación constituida, principalmente, por celulosa (15 a 60%) y, en menor proporción, por hemicelulosa (10 a 30%) y lignina (5 a 30%) (Alexander, 1977; Sylvia et al. 2005). La degradación de la celulosa requiere la presencia y la actividad de microorganismos, que tienen la particularidad de sintetizar enzimas específicas, conocidas como celulasas. Entre dichos microorganismos, se encuentran bacterias, hongos, actinomicetos y protozoarios (Gupta et al. 2012). En el grupo de bacterias, se han reportado los géneros Cytophaga, Polyangium, Cellulomonas, Bacillus, Clostridium, Corynebacterium, Sporocytophaga y Vibrio (Alexander, 1977; Thomas & Schaechter, 2012). Según Sylvia et al. (2005), las bacterias de los géneros Streptomyces, Pseudomonas y Bacillus son importantes en la despolimerización inicial de la celulosa.
En los países en vía de desarrollo, el uso de microorganismos celulíticos se ha encaminado, principalmente, a la transformación de residuos sólidos orgánicos, mediante el proceso conocido como compostaje (Cariello et al. 2007; Tortarolo et al. 2008; Vásquez et al. 2010). El objetivo de la presente investigación fue desarrollar un inóculo de bacterias nativas, seleccionadas por su mayor capacidad celulolítica y evaluar su efectividad en la transformación aerobia de residuos sólidos orgánicos, como alternativa para mitigar los problemas de contaminación ambiental generados por el manejo inapropiado de los residuos sólidos orgánicos.
MATERIALES Y MÉTODOS
Toma de muestras. Se tomaron muestras de suelo en los bosques de plantas nativas del Páramo El Malmo, el Páramo El Horizonte, la Reserva Natural de Iguaque, el trayecto IguaqueArcabuco y la hoya del río Pomeca (10 muestras por bosque) y en 5 fincas de la vereda Pirgua y una muestra representativa de 5 lotes por finca, en el departamento de Boyacá. Adicionalmente, se tomaron muestras de dos composteras en la etapa inicial de estabilización, una ubicada en el municipio de Arcabuco y otra en Miraflores (Boyacá) y de una compostera ubicada en Puente Piedra (Cundinamarca), de propiedad de FUNDASES (Fundación de Asesorías para el Sector Rural); en total, se tomaron 58 muestras. En la compostera de Arcabuco, se estaba procesando residuos orgánicos de plaza de mercado; en la de Miraflores, residuos de flores y café y, en la de Puente Piedra, residuos de flores y hortalizas.
Aislamiento de las bacterias celulolíticas. De cada muestra se pesaron 10g, se colocaron en una botella de dilución, con 95mL de solución salina (NaCl 0,85%), se agitó el contenido por treinta minutos y se preparó una serie de dilución, hasta 10-4. De cada dilución, se inocularon cuatro tubos de ensayo, cada uno, de los cuales, contenía 5mL de medio líquido mineral (NaNO3 0,5g; KH2PO4 1g; MgSO4 0,5g; KCl 0,5g; FeSO4x7H2O 0,01g por litro) y una tira de papel filtro (Whatman No. 1) (Gupta et al. 2012). Para cada dilución, se dejó un tubo sin inoculación, como control. Los tubos fueron incubados a 30°C, durante tres semanas. Después de la primera semana, los tubos fueron observados diariamente, con el fin de detectar en las tiras de papel la aparición de manchas de color marrón, indicativas del crecimiento de microorganismos (Ramirez & Coha, 2003). De las tiras de papel que indicaron presencia de microorganismos, se realizaron subcultivos en medio agar nutriente (AN) (MCDR Laboratorios S.A.), en secuencia repetitiva, hasta obtener colonias individuales. Luego, de cada crecimiento, se realizaron subcultivos en medio sólido mineral, suplementado con celulosa pulverizada (20g/L), como única fuente de carbono y energía (Gupta et al. 2012). A las bacterias que crecieron, utilizando celulosa como fuente de C y energía, se les determinó la morfología de la célula y su respuesta a la Tinción de Gram.
Determinación de la capacidad celulítica de los aislamientos. Para esta determinación, se utilizó el método del colorante Rojo Congo, que ha permitido visualizar los halos de hidrólisis de celulosa producidos por diferentes microorganismos (Suyama et al. 1993; Mikan & Castellanos, 2004; Gupta et al. 2012). Utilizando una colonia individual de cada uno de los aislamientos de bacterias celulolíticas, se preparó una suspensión de células en solución salina, en un tubo de ensayo. Siguiendo el procedimiento descrito por IGAC (2006), de la suspensión se tomaron cuatro alícuotas de 10µL y se distribuyeron equidistantemente a 3cm, en la superficie de una caja Petri, que contenía medio mineral sólido, modificado con CMC (carboximetilcelulosa), como única fuente de carbono (CMC, 10g; NaNO3, 0,5g; K2HPO4, 1,0g; MgSO4.7H2O, 0,5g; KCl, 0,5g; FeSO4.7H2O 0,001g por Litro) (Waghmare et al. 2014). Las cajas, se incubaron a 30°C y, a los tres días de crecimiento, la superficie de la caja se cubrió con una solución de Rojo Congo, al 0,05%, durante diez minutos; seguidamente, se retiró el Rojo Congo y se cubrió con solución salina 1M, durante una hora. Al término de la hora, se eliminó la solución salina y se cubrió con ácido acético al 2%, por diez segundos; finalmente, se descartó el ácido acético y se midió el diámetro de la colonia y la amplitud del halo de hidrólisis de celulosa.
Determinación de la compatibilidad para crecimiento entre los aislamientos. De los aislamientos en los que se observó un halo alrededor de la colonia, se seleccionaron los de mayor amplitud y cada uno fue probado por su compatibilidad, para crecimiento con los demás. Para tal efecto, de cada aislamiento se preparó una suspensión celular y se hicieron siembras en medio de cultivo CMC, enfrentándolos uno a uno, a una distancia de 1cm. Las cajas, se incubaron a temperatura de 25°C, durante una semana. Los crecimientos que no mostraron interferencia fueron registrados como compatibles y en los que se observó una zona clara entre ellos, como incompatibles.
Selección e identificación de los aislamientos para la generación del inóculo. Los tres aislamientos que mostraron la mayor capacidad celulítica y además compatibilidad en cuanto a crecimiento fueron seleccionados para la conformación del inóculo. Los tres asilamientos fueron identificados, siguiendo los protocolos descritos por Mac Ffadin (2003), Barrow & Feltham (2004) y Brenner et al. (2005).
Selección del sustrato para la multiplicación masiva del inóculo. Se evaluaron tres sustratos, utilizando un diseño Completamente al Azar, con tres repeticiones. Los sustratos evaluados fueron: 1) Sustrato del Caldo Rizósfera (SCRY) (Méndez & Viteri, 2007); 2) Sustrato del caldo rizósfera, cambiando el yogurt por leche (SCRL) y, 3) Sustrato que FUNDASES (Fundación de Asesorías para el Sector Rural) utiliza para la multiplicación del Agroplux® (SF). Cada sustrato fue distribuido en cantidades de 200mL en Erlenmeyers. Luego, cada Erlenmeyer fue inoculado con el respectivo aislamiento y colocado en un agitador rotatorio, a temperatura ambiente. A los 15 días, se realizó el conteo de células, utilizando una cámara Petroff Hausser y un microscopio Nikon®. Según los resultados del conteo de células, el sustrato seleccionado para la multiplicación fue el del Caldo Rizósfera, suplementado con leche. Inicialmente, se prepararon 2,25L de este sustrato, se colocaron en una caneca de 20L de capacidad, se inoculó con cada uno de los tres aislamientos selecciona dos y después de cubrir la caneca con un lienzo se la ubicó en cuarto oscuro y se agitó el contenido diariamente, para facilitar el crecimiento. A los ocho días se adicionaron 2,25L del sustrato y se continuó con el proceso, hasta completar quince días.
Evaluación de la efectividad del inóculo. La efectividad del inóculo fue comparada con la de los microorganismos del EM® y del Agroplux® en composteras, que albergan una gran diversidad de microorganismos nativos, elaboradas con residuos orgánicos de plaza de mercado (90%), de haba, maíz, quinua, rosas y clavel (5%), estiércol vacuno y equino (3%) y suelo (2%). Los tratamientos evaluados fueron: T1, Inoculación con bacterias celulolíticas; T2, Inoculación con EM® y Agroplux® y, T3, Control (sólo microorganismos nativos). El diseño experimental utilizado fue el de Bloques Completos al Azar, con tres repeticiones. El EM® y el Agroplux® son bioinsumos distribuidos a nivel comercial por FUNDASES. Los residuos fueron picados en trozos de 1 a 5cm y, después de ser mezclados con el estiércol y el suelo, dispuestos en capas, conformando una pila de 1,5m de largo x 1,5m de ancho x 1,5m de alto (Gil et al. 2006). La inoculación, se realizó al momento del montaje de las composteras y se repitió en cada volteo, realizado para oxigenar y regular la temperatura, a los 15, 30 y 45 días. La cantidad del inóculo utilizada por compostera fue de 1,5L diluidos en 6,7L de agua, siguiendo las instrucciones para la aplicación del Caldo Rizósfera (Méndez & Viteri, 2007); la inoculación del EM® y Agroplux®, se realizó siguiendo las instrucciones de FUNDASES (Gil et al. 2006). Al final del montaje, la humedad de los materiales, en cada compostera, se ajustó a 60% y se cubrió con un plástico de color negro, para protegerla de la lluvia y conservar la temperatura.
Variables determinadas. Las variables de respuesta en las composteras fueron: formación de agregados, temperatura, pH, conductividad eléctrica (CE) y evolución de CO2. La formación de agregados, se determinó en muestras de 250g, las cuales, fueron secadas bajo sombra y, luego, zarandeadas por dos minutos, en un agitador integrado por una serie de siete tamices (4,75; 3,35; 2,00; 1,00; 0,50; 0,212 y 0,038mm); en una balanza, se pesó la cantidad de agregados acumulados en cada uno de los tamices; la temperatura, se determinó en el centro de las pilas, con un termómetro de mercurio de 270°C; el pH, se midió en una relación compost:agua 1:1, de acuerdo con IGAC (2006); la CE, se determinó en pasta de saturación, siguiendo el procedimiento de Marín et al. (2002) y la evaluación de la tasa de respiración microbiana, se efectuó a los 45 días del proceso, según el procedimiento descrito por Anderson (1982).
RESULTADOS Y DISCUSIÓN
Aislamientos de bacterias celulolíticas obtenidos. De 97 aislamientos de bacterias obtenidos, inicialmente en medio AN, 20 crecieron en medio sólido mineral, utilizando celulosa, como única fuente de carbono y de energía, catalogándose así como celulolíticos. De estos aislamientos, seis, procedieron del Páramo El Malmo; seis, del Páramo El Horizonte; tres, de la Reserva Natural de Iguaque; uno, de un bosque del trayecto Iguaue-Arcabuco; tres de la hoya del río Pómeca y, uno, de la compostera de Fundases. La morfología celular y la respuesta a la Tinción de Gram, se registran en la tabla 1. Respecto a la morfología, la mayoría de las bacterias aisladas mostraron forma bacilar y en cuanto a la Tinción de Gram, aproximadamente la mitad, resultaron positivas (Gram+) y la otra, negativas (Gram-). El grupo específico de bacterias celulíticas bacilos Gram+ y Gram- también ha sido reportado en otros estudios (Alexander, 1977; Atlas & Bartha, 1981; Wirth & Ulrich, 2002; Cariello et al. 2007).

Capacidad celulítica de los aislamientos. La amplitud de los halos de hidrólisis de celulosa visualizados, también se reporta en la tabla 1. En cinco aislamientos no se visualizó halo alrededor de la colonia y, en los otros quince, independiente del diámetro de la colonia, la amplitud del halo varió entre 0,65 y 0,1cm. Estos valores son bajos con relación a los de 0,74 a 2,14cm visualizados con aislamientos bacterianos, procedentes de suelos cultivados con stevia (Gutiérrez et al. 2008), pero superiores a los valores entre 0,002 y 0,012cm, obtenidos con aislamientos del intestino de termitas (Lara & Acosta, 2013). Estos datos permiten inferir que la capacidad de producir la enzima extracelular, responsable de la hidrólisis de celulosa, varía entre los aislamientos, lo cual, es importante, por cuanto permite clasificar y seleccionar las bacterias celulolíticas para aprovechar mejor su potencial. La figura 1 ilustra los halos visualizados en tres de los aislamientos.
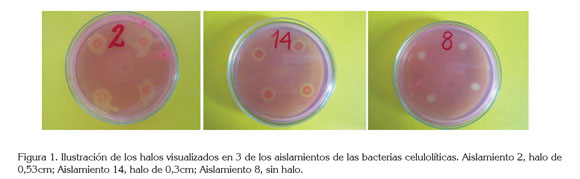
Compatibilidad entre los aislamientos celulolíticos. Los resultados de las pruebas de compatibilidad indicaron que en cuanto a crecimiento, la mayoría de las bacterias celulolíticas aisladas son compatibles, a excepción de los aislamientos 7 y 53. Esta observación permite inferir que en su hábitat natural la mayoría de bacterias celulolíticas pueden coexistir e interaccionar favorablemente entre ellas y con el resto de poblaciones microbianas.
Aislamientos seleccionados para el inóculo. Los aislamientos 1, 6 y 7 figuraron entre los de mayor capacidad celulolítica(Tabla 1), además, demostraron compatibilidad para crecimiento entre ellos y con el resto de aislamientos, por lo tanto, los tres fueron seleccionados para la conformación del inóculo. Según las pruebas de identificación, el aislamiento 1 pertenece al género Bacillus sp.; el aislamiento 7, al género Pseudomonas sp. y, el aislamiento 6, al género Erwinia sp. Especies de los géneros Bacillus sp. y Pseudomonas sp. han sido ampliamente reportadas como celulolíticas (Alexander, 1977; Atlas & Bartha, 1981; Sylvia et al. 2005; Trujillo et al. 2013; Faraco, 2013). En cuanto al género Erwinia sp., algunas de las especies, conocidas como fitopatógenas, han sido señaladas por su capacidad para producir, además de celulasas, otras enzimas de degradación, como proteasas y pectinasas (Agrios, 1985; Gonzáles, 1985; Rocha et al. 2004).
Sustrato para la multiplicación masiva del inóculo. Los datos de la tabla 2 indican que en cuanto a crecimiento, se presentaron diferencias entre sustratos en los aislamientos 1 y 7, excepto en el aislamiento 6. En el caso de estos dos aislamientos, la diferencia resultó a favor de los sustratos SCRY y SCRL, sugiriendo que cualquiera de los dos podría ser utilizado, obteniéndose resultados similares, en cuanto a crecimiento. Teniendo en cuenta que tanto el yogurt como la leche son ingredientes recomendados para la multiplicación de bacterias y de fácil consecución en los mercados, para la multiplicación masiva del inóculo, se optó por el sustrato utilizado en la preparación del Caldo Rizósfera (Méndez & Viteri, 2007), suplementado con leche.

Cantidad de agregados producidos en las composteras. La formación de agregados, como resultado de la transforma ción de los residuos, fue progresiva, a través del proceso de compostaje, sin presentarse diferencias estadísticas entre tratamientos, en ninguno de los muestreos, es decir, no hubo efecto con el inóculo, tal como lo han reportado otros estudios (Faure & Deschamps, 1991). La mayor cantidad de agregados formados ocurrió en el tamaño entre 2 y 4,75mm, como se ilustra en la figura 2.

Evolución de la temperatura en las composteras. La temperatura evolucionó positivamente a partir del montaje y en respuesta a los volteos en los días 15, 30 y 45. A partir del montaje y de cada volteo, se presentó un incremento de temperatura seguido de un descenso, sin mayor variación entre tratamientos, excepto en el último volteo, en el cual, la temperatura en el tratamiento correspondiente a las bacterias celulolíticas, subió notoriamente, en comparación a los otros dos tratamientos, indicando aún mayor actividad microbiana (Figura 3). El pico máximo de temperatura alcanzado después del montaje de las composteras fue de 64,7°C, en el tratamiento con bacterias celulolíticas y, de 64°C, en el tratamiento con EM® y Agroplux® y el control, coincidiendo con Cariello et al. (2007) y Tortarolo et al. (2008), quienes en composteras inoculadas obtuvieron también el pico de temperatura (63°C), una semana después del montaje y, con López (2002), que señala que al principio del proceso la temperatura sube hasta el rango entre 60 y 70°C y que, posteriormente, el intervalo de temperatura aceptable para los microorganismos que intervienen en el proceso de compostaje, oscila entre 35 a 55°C. A excepción de lo registrado en la fase final del proceso, a partir del último volteo, los efectos de la inoculación sobre la temperatura no fueron concluyentes.

pH. A diferencia de los pH ligeramente ácidos obtenidos en otros experimentos (Cariello et al. 2007; Tortarolo et al. 2008), los valores de pH al inicio del proceso fueron altos, en el rango fuertemente alcalino (pH 8,5 a 9), en los tres tratamientos. De los 15 a los 30 días, se registró un leve incremento, seguido de un moderado descenso, hasta el día 75. Los valores en la etapa final del proceso concuerdan con lo afirmado por Tchobanoglous et al. (1994) y Labrador (2001), en el sentido que en la etapa termofílica el pH tiende a subir de 8 a 8,5. Las diferencias entre los tratamientos inoculados y el control fueron mínimas y, por lo tanto, no reflejaron efectos de la inoculación. Inicialmente, se presentó en este estudio un descenso, por la transformación de materia orgánica de rápida degradación y, posteriormente, un incremento.
Conductividad eléctrica. Los valores en los tres tratamientos fluctuaron entre 3,8 y 4,5 dS m-1, indicando que el producto obtenido podría ser utilizado con cierta precaución, ya que, según Richards (1980), valores de CE entre 2 y 4 dS m-1 restringen el rendimiento de cultivos muy sensibles y valores entre 4 y 8 dS m-1, el de varios cultivos. El margen de riesgo de salinidad que dejan entrever los valores obtenidos se minimiza, si se tiene en cuenta que el producto sería incorporado en suelos tropicales, los cuales, son generalmente ácidos y, por lo tanto, se diluiría el efecto adverso de la CE.
Evolución de CO2. Los datos reflejaron una mayor tasa de respiración en las muestras inoculadas en comparación al control. Particularmente, en la muestra inoculada con las bacterias celulolíticas, la cantidad de CO2 aumentó considerablemente, a partir del día 3, superando, inclusive, a los microorganismos del EM® y Agroplux® (Figura 4). Aunque las diferencias entre tratamientos no alcanzaron a ser significativas estadísticamente, los datos permiten entrever que la actividad microbiana, inclusive a los 45 días del proceso, fue mayor en las composteras inoculadas.
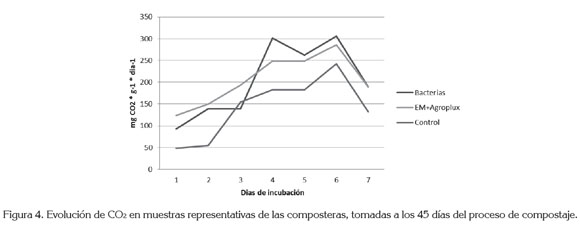
La ausencia de diferencias estadísticas entre tratamientos en las variables determinadas con relación a la evaluación del inóculo indica que la inoculación con las bacterias celulolíticas seleccionadas o con los microorganismos del EM® y Agroplux®, no produjo efectos en el proceso de compostaje que se diferencien significativamente de los producidos por los microorganismos nativos. En resumen, el proceso de descomposición de los residuos orgánicos utilizados no fue potenciado por la inoculación. Una de las razones pudo ser que la relación C:N en la mezcla de residuos utilizada fue menor de 30 y, en consecuencia, independientemente de la inoculación, los microorganismos nativos presentes fueron suficientes para activar, de manera adecuada, el proceso de compostaje, como ocurrió en el estudio de Faure & Deschamps (1991), con pulpa de vid. Esta información constituye una alerta para las empresas e instituciones que invierten recursos en la compra de inoculantes, con el fin de acelerar el proceso de compostaje de residuos orgánicos, procedentes de las basuras municipales; sin embargo, respecto a las bacterias seleccionadas por su mayor capacidad celulolítica, aún queda la posibilidad de evaluar su efectividad con residuos con una relación C:N entre media a alta, como en el caso del bagazo de caña o residuos de maíz, trigo, avena, cebada o cascarilla de arroz.
Los resultados de esta investigación, además de establecer la alerta respecto al uso de inoculantes para el compostaje de residuos orgánicos procedentes principalmente de plazas de mercado, amplían el conocimiento sobre la existencia y la capacidad de las bacterias celulolíticas en hábitats tropicales. Esta información es útil para proyectar un mejor aprovechamiento del potencial de las bacterias celulolíticas, inclusive, en el sector industrial, como lo reportan varios autores (Ovando-Chacón & Waliszewski, 2005; Kuhad et al. 2011).
Agradecimientos: Los autores expresan un cálido agrade cimiento al profesor Jorge Blanco Valbuena, por su colaboración en la identificación de las bacterias celulolíticas y a la Universidad Pedagógica y Tecnológica de Colombia, por haber suministrado parte de los recursos para el desarrollo de la investigación. Conflictos de interés: El manuscrito fue preparado y revisado con la participación de todos los autores, quienes declaramos que no existe conflicto de intereses que ponga en riesgo la validez de los resultados presentados.
BIBLIOGRAFÍA
1. AGRIOS, G. 1985. Plant Pathology. Ed. Elsevier Academic Press (Estados Unidos). 304p.
2. ALEXANDER, M. 1977. Introduction to soil microbiology. Second Edition. Ed. John Wiley and Sons. (New York). 467p.
3. ANDERSON, J. 1982. Soil respiration. En: Page A.L., Millar R.H.; Keeney D.R. (eds.) Methods of soil analysis. Part 2, Chemical and microbiological properties. Ed. American Society of Agronomy-Soil Science Society of America (Madison, Wisconsin). p.831-871.
4. ATLAS, R.; BARTHA, R. 1981. Microbial ecology: Fundamentals and applications. Ed: Addison-Wesley Publishing (Estados Unidos). p.357-358.
5. BARROW, G.I.; FELTHAM, R.K.A. 2004. Cowan and Steel's manual for the identification of medical bacteria. Ed. Cambridge University Press (United Kingdom). 115p.
6. BRENNER, D.J.; KRIEG, N.R.; STALEY, J.T. 2005. Bergey's manual of systematic bacteriology. Volume 2: The Proteobacteria Part A, Introductory Assays. Ed. Springer. (Estados Unidos). 304p.
7. CARIELLO, M.; CASTAÑEDA, L.; RIOBO, I.; GONZÁLEZ, J. 2007. Inoculante de microorganismos endógenos para acelerar el proceso de compostaje de residuos sólidos urbanos. R.C. Suelo. Nutr. Veg. (Chile). 7(3):26-37.
8. FARACO, V. 2013. Cellulolytic Bacillus strains from natural habitats. Chemistry Today. (India). 31(2):49-52.
9. FAURE, D.; DESCHAMPS, A.M. 1991. The effect of bacterial inoculation on the initiation of composting of grape pulps. Bioresour. Technol. 37:235-238.
10. GIL, M.; RUEDA, P.; SALGADO, A.; VARELA, A. 2006. EM, en manejo de residuos sólidos orgánicos. Ed. Servimpresiones Corporación Minuto de Dios. (Colombia). 8p.
11. GIRALDO, E. 1998. Manejo Integrado de residuos sólidos municipales. Ed. Universidad de los Andes Colombia. (Colombia). 185p.
12. GONZÁLES, L.C. 1985. Introducción a la Fitopatología. Ed. IICA (Costa Rica). 148p.
13. GUPTA, P.; SAMANT, K.; SAHU, S. 2012. Isolation of cellulose-degrading bacteria and determination of their cellulolytic potential. Int. J. Microbiol. (India). 12 (ID 578925):1-5.
14. GUTIÉRREZ, V.; PINZÓN, A.; CASAS, J.; MARTÍNEZ, M. 2008. Determinación de la actividad celulolítica del suelo proveniente de cultivos de Stevia rebaudiana Bertoni. Agr. Col. 26(3):497-504.
15. IGAC. 2006. Métodos analíticos de laboratorio de suelos. Ed. Instituto Geográfico Agustín Codazzi. (Colombia). 648p.
16. KUHAD, R.C.; GUPTA, R.; SINGH, A. 2011. Microbial cellulases and their industrial applications. Enzyme Res. (India). 2011:1-10.
17. LABRADOR, J. 2001. La materia orgánica en los agroecosistemas. Ed. Ediciones Mundi-Prensa (España). 168p.
18. LARA, C.; ACOSTA, P. 2013. Bacterias celulolíticas aisladas del intestino de termitas (Nasutitermes nigriceps) con características probióticas y potencial en la degradación del pasto. Rev. Col. Biotecnol. (Colombia). 15(1):8-16.
19. LÓPEZ, P. 2002. Compostaje de residuos orgánicos. Ed. Universidad del Valle. (Colombia). 92p.
20. MAC FFADIN, J. 2003. Pruebas bioquímicas para la identificación de bacterias de importancia clínica. Ed. Médica Panamericana. (Argentina). 856p.
21. MARÍN, M.; ARAGÓN, P.; GÓMEZ, C. 2002. Análisis químico de suelos y aguas: manual de laboratorio. Ed. Universidad Politécnica de Valencia. (España). 34p.
22. MÉNDEZ, M.; VITERI, S.E. 2007. Alternativas de biofertilización para la producción sostenible de cebolla de bulbo (Allium cepa) en Cucaita, Boyaca. Agr. Col. 25(1):168-175.
23. MIKAN, J.; CASTELLANOS, D. 2004. Screening para el aislamiento y caracterización de microorganismos y enzimas potencialmente útiles para la degradación de celulosas y hemicelulosas. Rev. Col. Biotecnol. 6(1):58-71.
24. MINISTERIO DE AMBIENTE, VIVIENDA Y DESARROLLO TERRITORIAL -MAVDT-. 2008. Construcción de criterios técnicos para el aprovechamiento y valorización de residuos sólidos orgánicos con alta tasa de biodegradación, plásticos, vidrio, papel y cartón. Ed. Ministerio de Ambiente, Vivienda y Desarrollo Territorial y EPAM. (Colombia). 14p.
25. OVANDO-CHACÓN, S.L.; WALISZEWSKI, K.N. 2005. Preparativos de celulasas comerciales y aplicaciones en procesos extractivos. Universidad Ciencia (Costa Rica). 21(42):111-120.
26. PENAGOS, J.; ADARRAGA, J.; AGUAS, D.; MOLINA, E. 2011. Reducción de los residuos sólidos orgánicos en Colombia por medio del compostaje líquido. Ingeniare. 11:37-44. v.
27. PUERTA, S. 2004. Los residuos sólidos municipales como acondicionadores del suelo. Rev. Lasallista Invest. 1(1):56-65.
28. RAMIREZ, P.; COHA, J.M. 2003. Degradación enzimática de celulosa por actinomicetos termófilos: Aislamiento, caracterización y determinación de la actividad celulolitica. Rev. Peru. Biol. 10(1):67-77.
29. RICHARDS, L. 1980. Diagnóstico y rehabilitación de suelos salinos y sódicos. Ed. Lumesa. (México). 172p.
30. ROCHA, S.; LOZANO, P.; MARTÍNEZ, I. 2004. Mecanismos de patogenicidad e interacción parásito-hospedero II. 1a ed. Ed. Benemérita Universidad Autónoma de Puebla (México). 87p.
31. ROJAS MOLANO, L. 2005. Rellenos Sanitarios Regionales, Disposición Final de Residuos Sólidos y Perspectivas Ambientales en Colombia. En: Memorias. V Congreso Disposición Final de Residuos Sólidos y Perspectivas Ambientales en Colombia. Expofuturo. Pereira, Risaralda. p.41-51.
32. SANS, R.; RIBAS, J. 1989. Ingeniería ambiental: contaminación y tratamientos. Ed. Marcombo. (España). p.11-16.
33. SYLVIA, D.; HARTEL, P.; FUHRMANN, J.; ZUBERER, D. 2005. Principles and applications of soil microbiology: Ed. Prentice Hall-Inc. (Estados Unidos). 640p.
34. SUYAMA, K.; YAMAMOTO, H.; NAGANAWA, T.; IWATA, T.; KOMADA, H. 1993. A plate count method for aerobic cellulose decomposers in soil by congo red staining. Soil. Sci. Plant. Nutr. (Japón). 39(2):361-365.
35. THOMAS, M.; SCHAECHTER, M. 2012. Topics in ecological and environmental microbiology. Ed. Academic Press. (Estados Unidos). 570p.
36. TCHOBANOGLOUS, G.; THEISEN, H.; VIGIL, S. 1994. Gestión integral de residuos sólidos. Vol. I y II. Ed. Mc Graw Hill (España).1125p.
37. TORTAROLO, M.F.; PEREDA, M.; PALMA, M.; ARRIGO, N.M. 2008. Influence of inoculation of microorganisms on the temperature in the process of composting. CI. Suelo (Argentina). 26(1):41-50.
38. TRUJILLO, Y.; PONCE, A.; VÁSQUEZ, M.; RIVERA, F.; WANG, E. 2013. Diverse cellulolytic bacteria isolated from the high humus, alkaline-saline Chinampa soils. Ann. Microbiol. (Italia). 63(2):779-792.
39. VÁSQUEZ, M.; PRADA, P.; MONDRAGÓN, M. 2010. Optimización del proceso de compostaje de productos post-cosecha (cereza) del café con la aplicación de microorganismos nativos. Cienc. Bioméd. 8(14):213-219.
40. WAGHMARE, P.R.; KSHIRSAGAR, S.D.; SARATALE, R.G.; GOVINDWAR, S.P.; SARATALE, G.D. 2014. Production and characterization of cellulolytic enzymes by isolated Klebsiella sp. PRW-1 using agricultural waste biomass. Emir. J. Food Agric. 26(1):44-59.
41. WIRTH, S. ULRICH, A. 2002. Cellulose-degrading potentials and phylogenetic classification of carboxymethyl-cellulose decomposing bacteria isolated from soil. System. Appl. Microbiol. 25(4):584-591.
Recibido: Abril 21 de 2014 Aceptado: Abril 9 de 2015

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.