CIENCIAS EXACTAS Y NATURALES-Artículo Científico
DESARROLLO Y EVALUACIÓN DE UN INÓCULO DE HONGOS CELULOLÍTICOS
DEVELOPMENT AND EVALUATION OF AN INOCULUM OF CELLULOLYTIC FUNGI
David Arturo Castillo Guerra1, Paola Andrea Viteri Flórez2, Silvio Edgar Viteri Rosero3
1 Ingeniero Agrónomo, M.Sc., Grupo Manejo Biológico de Cultivos, Escuela de Ingeniería Agronómica, Universidad Pedagógica y Tecnológica de Colombia. Avenida Central del Norte, Tunja, Boyacá (Colombia), e-mail: gmbc@uptc.edu
2 Ingeniera Agrónoma, M.Sc., Grupo Manejo Biológico de Cultivos, Escuela de Ingeniería Agronómica, Universidad Pedagógica y Tecnológica de Colombia. Avenida Central del Norte, Tunja, Boyacá (Colombia), e-mail: gmbc@uptc.edu
3 Ingeniero agrónomo, M.Sc., Ph.D, Docente titular, Escuela de Ingeniería Agronómica, Universidad Pedagógica y Tecnológica de Colombia. Avenida Central del Norte, Tunja, Boyacá (Colombia), e-mail: silvio.viteri@uptc.edu.co
Rev. U.D.C.A Act. & Div. Cient. 18(1): 217-226, Enero-Junio, 2015
RESUMEN
La disposición indiscriminada de residuos sólidos urbanos continúa generando problemas ambientales en varios países. El objetivo de esta investigación fue desarrollar un inóculo de hongos celulolíticos y evaluar su efectividad en el compostaje de residuos orgánicos. El estudio incluyó muestras de suelo de bosques y de fincas productoras de cereales y de composteras. De cada muestra, se prepararon diluciones hasta 10-4. De cada dilución, se inocularon tubos que contenían medio mineral líquido y una tira de papel filtro. De las tiras de papel que indicaron presencia de microorganismos, se realizaron subcultivos, primero en medio papa dextrosa agar y, luego, en medio sólido mineral, con celulosa, como fuente de C. Los aislamientos obtenidos fueron evaluados por su capacidad celulolítica y los que mostraron mayor capacidad probados por su compatibilidad para crecimiento. Del total de 39 aislamientos, 32, se identificaron como Penicillium sp.; tres, como Trichoderma sp.; uno, como Mucor sp.; uno, como Chaetomium sp.; uno, como Verticillium sp. y, uno, como Trichurus sp. Los aislamientos difirieron en su capacidad celulolítica, 10 aislamientos no mostraron halo de hidrólisis y, en los 29 restantes, la amplitud del halo varió entre 0,10 y 0,7cm. Con base en la capacidad celulolítica y compatibilidad el inóculo fue conformado con los aislamientos 21 (Trichoderma sp.) y 62 y 66 (Penicillium sp.). La inoculación con los hongos celulolíticos seleccionados o con los microorganismos de los productos comerciales EM® y Agroplux® no produjo efectos en el proceso de compostaje, que se diferencien significativamente de los producidos naturalmente por los microorganismos nativos.
Palabras clave: Celulosa, celulasa, biodegradación, compostaje, rojo Congo.
SUMMARY
The indiscriminate disposal of urban solid waste continues generating environmental problems in various countries. The objective of this research was to develop a fungal cellulolytic inoculum and evaluate its effectiveness in the composting of organic solid residues. The study included soil samples from native forests and cereal producing farms and of compost piles. From each sample a serial dilution until 10-4 was prepared. From each dilution test tubes containing liquid mineral medium and a strip of filter paper were inoculated. From the filter paper strips which showed zones of degradation the microorganisms were streaked, first on potato dextrose agar medium and then on mineral agar medium, supplemented with cellulose as a source of C. The isolates obtained were evaluated for their cellulolytic capacity and those which showed greater capacity were tested for their compatibility for growth. Of the total of 39 isolates, 32 were identified as Penicillium sp., 3 as Trichoderma sp., 1 as Mucor sp., 1 as Chaetomium sp., 1 as Verticillium sp., and 1 as Trichurus sp. The isolates differed in their cellulolytic capacity, 10 did not show a halo of hydrolysis and in the other 29 the amplitude of the halo varied between 0,1 and 0,7cm. Based on the cellulolytic capacity and compatibility the inoculum was generated with the isolates 21 (Trichoderma sp.) and 62 and 66 (Penicillium sp.). The inoculation with the selected cellulolytic fungal isolates or with the EM® and Agroplux® microorganisms did not produce effects significantly different to those which are naturally produced by the native microorganisms in the composting process.
Key words: Cellulose, cellulose, biodegradation, composting, Congo red.
INTRODUCCIÓN
En Colombia, el constante incremento de la población urbana ha originado una mayor dinámica de actividades económicas, comerciales, educativas e industriales y, en consecuencia, un aumento en la cantidad de desechos. En los últimos años, en el país se generan diariamente 28.800ton de residuos sólidos (SSPD, 2011); Según la Superintendencia de Servicios Públicos Domiciliarios (2008), de los 1.088 municipios del país, 635 disponen sus desechos en rellenos sanitarios; 297, en botaderos a cielo abierto; 98, en plantas de aprovechamiento; 10, en corrientes de agua; 19, en sistemas de enterramiento y 11, en quemas a cielo abierto. Mediante estas vías de disposición, se generan serios problemas relacionados, especialmente en lo ambiental, con la contaminación del aire, el paisaje, el suelo y el agua (Castells, 2000; Terraza, 2009). En el suelo, la liberación de lixiviados pueden contaminar hasta las aguas subterráneas con mercurio, plomo, cadmio y sustancias cancerígenas, como benceno o el tricloroetileno (Giraldo, 1998; Rodríguez et al. 2008; Escamirosa et al. 2001).
En las modalidades de disposición no se ha tenido en cuenta que de la cantidad total de residuos sólidos, el 65% corresponde a orgánicos y el 35% a materiales inorgánicos (MAVDT, 2007). Los residuos orgánicos están constituidos por una fracción fácilmente biodegradable y una resistente, representada, principalmente, por celulosa y, en menor proporción, hemicelulosa y lignina (Castells, 2012). La celulosa es un polímero constituido por una gran cadena de moléculas de glucosa unidas por un enlace β-14, insoluble en agua (Sylvia et al. 2005), por lo que la celulosa puede ser degradada solamente por un grupo de microorganismos específicos, conocidos como celulolíticos, dentro de los que figuran hongos, bacterias y actinomicetos (Alexander, 1977; Atlas & Barta, 1981). Entre los hongos, se encuentran los géneros Aspergillus, Chaetomium, Fusarium, Curvularia, Memnoniella, Phoma, Thielaviopsis y Trichoderma (Alexander, 1977; Rajvaidya et al. 2006), que actúan al introducirse en los desechos y liberar celulasas (Castillo, 2005).
Al considerar la gravedad de los problemas ocasionados por la inapropiada disposición de los residuos sólidos, la búsqueda de alternativas para su transformación en productos útiles, es urgente. Una de las alternativas planteadas es el compostaje (Atlas & Barta, 1981). Con el fin de acelerar dicho proceso, se han utilizado activadores biológicos, tales como vinaza, EM® y Agroplux®, sin señalar cuáles de los microorganismos incluidos en dichos bioinsumos se relacionan específicamente, con el proceso de compostaje.
El objetivo de la presente investigación fue desarrollar un inoculante de hongos nativos seleccionados, específicamente por su mayor potencial celulolítico, y evaluar su efectividad en la transformación de residuos sólidos orgánicos por medio del compostaje. Esta información es relevante para la generación de tecnologías que conduzcan a solucionar, principalmente, los problemas ambientales generados por el mal manejo de los residuos sólidos orgánicos.
MATERIALES Y MÉTODOS
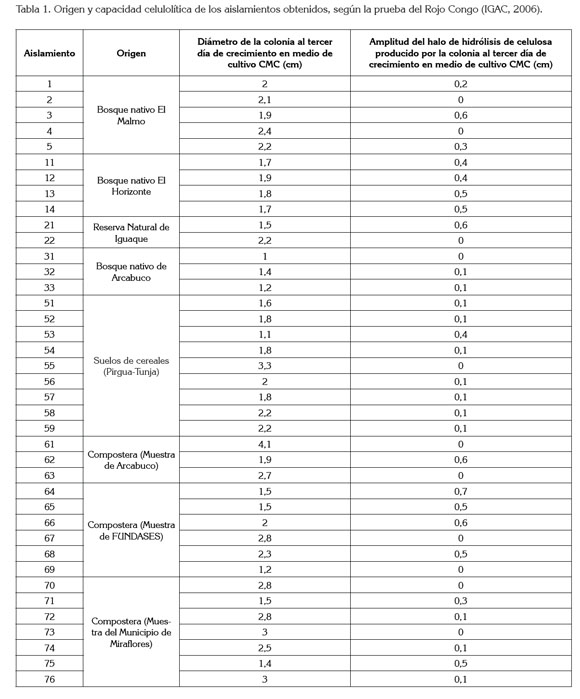
Toma de muestras. Se tomaron muestras de suelo en cinco bosques de especies nativas y cinco fincas productoras de cereales y de dos composteras, en Boyacá y de una compostera, en Cundinamarca. Los bosques fueron el Páramo El Malmo, el Páramo El Horizonte, la Reserva Natural de Iguaque, el trayecto Iguaque-Arcabuco y la hoya del rio Pómeca; en cada bosque, se tomaron diez muestras representativas de cinco submuestras, a distancia de 200m, en un trayecto de 2km. Las fincas fueron ubicadas en la vereda Pirgua, del municipio de Tunja; en cada finca, se tomó una muestra representativa de 5 lotes. Las composteras de Boyacá fueron ubicadas, una en el municipio de Arcabuco y otra en el de Miraflores y la de Cundinamarca, en el Vivero Coraflor, en el municipio de Puente Piedra. En total, se tomaron 58 muestras.
Aislamiento de los hongos celulolíticos. De cada muestra, se pesaron 10g y se colocaron en una botella de dilución con solución salina (NaCl 0,85%). Después de agitar el contenido por 30 minutos, se preparó una serie de dilución, hasta 104. Posteriormente, de cada dilución se tomaron cuatro alícuotas de 1mL y con cada una se inoculó un tubo de ensayo, que contenía medio líquido mineral (NaNO3 0,5g; KH2PO4 1g; MgSO4 0,5g; KCl 0,5g; FeSO4x7H2O 0,01g por Litro) y una tira de papel filtro (Watman No. 1) (Gupta et al. 2012). Para cada dilución, se dejó un tubo sin inoculación, como control. Los tubos fueron incubados a 30°C, durante tres semanas. De las áreas del papel que mostraron descomposición, se realizaron subcultivos en medio Papa Dextrosa y Agar (PDA) (Asimel LTDA®). Luego de cada crecimiento, a partir de una colonia pura, se realizaron subcultivos en medio sólido mineral (Agar 15 g L-1), suplementado con celulosa pulverizada (20 g L-1), como única fuente de C y energía (Gupta et al. 2012). Las cajas fueron incubadas a 30°C.
Evaluación de la capacidad celulolítica de los aislamientos. Se prepararon cajas Petri con medio CMC (Medio mineral Dubos modificado con CMC (Carboximetilcelulosa), como única fuente de carbono (CMC 10g; NaNO3 0,5g; K2HPO4 1,0g; MgSO4.7H2O 0,5g; KCl 0,5g; FeSO4.7H2O 0,001g por Litro) (Waghmare et al. 2014) y mediante un sacabocado, se sembraron en fracciones de crecimiento de cada aislamiento, un aislamiento por caja, tres cajas por aislamiento. Las cajas fueron incubadas por tres días. Luego, siguiendo el protocolo del IGAC (2006), se cubrió el crecimiento superficial con una solución de Rojo Congo al 0,05%, durante 10 minutos; se retiró el Rojo Congo y se cubrió con solución salina 1M, durante una hora; se descartó la solución salina y se cubrió con ácido acético al 2%, por 10 segundos. Finalmente, se eliminó el ácido acético y se midió el diámetro de crecimiento de la colonia y la amplitud del halo de hidrólisis de celulosa producido.
Determinación de la compatibilidad para crecimiento entre los hongos celulolíticos. Los aislamientos que mostraron los halos de mayor amplitud fueron probados por su compatibilidad en cuanto a crecimiento. Se prepararon cajas con medio CMC y, en cada una, se colocaron fragmentos de crecimiento de dos aislamientos, a una distancia de 1cm. Las cajas se incubaron a temperatura de 30°C, durante dos a tres semanas. Los crecimientos que no mostraron interferencia fueron registrados como compatibles y aquellos donde se observó una zona clara entre ellos, como incompatibles.
Selección e identificación de los aislamientos para la conformación del inóculo. Los tres aislamientos que mostraron la mayor capacidad celulolítica y que resultaron ser compatibles en cuanto a crecimiento fueron seleccionados para la conformación del inóculo. Dichos aislamientos fueron identificados a nivel de género, siguiendo los protocolos de Barnett & Barry (1998) y Domsh et al. (1980).
Selección del sustrato para la multiplicación masiva del inóculo. Primero, se seleccionó el sustrato utilizando un diseño Completamente al Azar, con cuatro tratamientos y tres repeticiones. Los tratamientos fueron: T1) Arroz suplementado con los ingredientes del Caldo Rizósfera (Méndez & Viteri, 2007) (ACRY); T2) Arroz suplementado con los ingredientes del caldo Rizósfera, cambiando el yogurt por leche (ACRL); T3) Arroz suplementado con el sustrato que Fundases (Fundación de Asesorías para el Sector Rural), que utiliza para la multiplicación del Agroplux® (ASF) y, T4) Arroz y agua destilada (T). La prueba se realizó en bolsas de polipropileno esterilizadas en autoclave. La inoculación de los sustratos, se efectuó por separado con cada uno de los tres aislamientos, empleando fragmentos de 5mm de diámetro de un cultivo joven, en medio CMC. A los 12 días de crecimiento, se formalizó el conteo de conidias, utilizando una cámara neubau er y un microscopio Nikon®. Con base en los resultados, se seleccionó el sustrato utilizado en la elaboración del Caldo Rizósfera, suplementado con leche. Para la multiplicación masiva del inóculo, se prepararon bolsas de polietileno con 1000g de arroz y 900mL del sustrato seleccionado. Cada bolsa fue inoculada con los tres aislamientos y llevada a incubación, a temperatura ambiente, durante 15 días.
Evaluación de la efectividad del inoculo. La efectividad del inóculo fue comparada con la de los microorganismos del EM® y del Agroplux® en composteras, que albergan una gran diversidad de microorganismos nativos, elaboradas con residuos orgánicos de plaza de mercado (90%), de haba, de maíz, de quinua, de rosas y de clavel (5%), estiércol vacuno (3%) y suelo (2%). Los tratamientos evaluados fueron: T1) Inoculación con hongos celulolíticos (HC), T2) Inoculación con EM® y Agroplux® y T3) Microorganismos nativos (Control). El diseño experimental utilizado fue bloques completos al azar, con tres repeticiones. Los materiales fueron picados en trozos de 1 a 5cm y dispuestos en capas, conformando una pila de 1,5m de largo x 1,5m de ancho x 1,5m de alto (Gil et al. 2006). Las inoculaciones, se realizaron al momento del montaje de las composteras y, en cada volteo, a los 15, 30 y 45 días. La cantidad del inóculo, se determinó de acuerdo a la cantidad de residuos utilizada para las tres composteras (1020kg). Para esta cantidad de residuos, se diluyeron 1020g de sustrato en una caneca de 20L de agua, equivalente a 1g de inóculo por kilogramo de residuos. La inoculación con EM® y Agroplux® se realizó a nivel comercial siguiendo las recomendaciones de Fundases (Gil et al. 2006). Finalmente, en cada compostera la humedad se ajustó al 60% y se cubrió con un plástico de color negro.
Variables determinadas en las pilas de compostaje. Las variables determinadas fueron: formación de agregados, temperatura, pH, conductividad eléctrica (CE) y evolución de CO2. Para la determinación de la cantidad de agregados, se pesaron 250g de compost, se colocaron en un agitador con 7 tamices (4,75; 3,35; 2,00; 1,00; 0,50; 0,212 y 0,038mm) y se zarandearon por 2 minutos. Posteriormente, en una balanza, se pesó la cantidad de material que se acumuló en cada uno de los tamices. La temperatura, se determinó diariamente con ayuda de un termómetro de mercurio de 270°C. El pH, se determinó en relación con agua 1:1. La CE fue determinada por el método de pasta saturada (Marín et al. 2002). La tasa de respiración microbiana fue evaluada a los 45 días del proceso, siguiendo el protocolo descrito por Anderson (1982).
RESULTADOS Y DISCUSIÓN
Aislamientos de hongos celulolíticos obtenidos. En total, se obtuvieron 39 aislamientos que crecieron en medio sólido mineral, suplementado con celulosa, demostrando así su capacidad celulolítica. Tanto el número como la procedencia de los aislamientos, se reportan en la tabla 1. Estos resultados confirman que el aislamiento de hongos celuloliticos es posible desde distintos hábitats, como lo registran Cariello et al. (2007), Cruz et al. (2009) y Martínez et al. (2001).

Capacidad celulolítica de los aislamientos. El tamaño de la colonia y la capacidad celulolítica de cada uno de los aislamientos, indicada por la amplitud del halo, se muestran también en la tabla 1. La prueba del Rojo Congo, que fue aplicada en esta determinación, ha sido efectuada en varias investigaciones (Mikan et al. 2004; Gutiérrez et al. 2008).
Los resultados obtenidos indican que no todos los hongos celulolíticos tienen la misma capacidad para hidrolizar celulosa; de los 39 aislamientos solamente en 29 se visualizó el halo de hidrólisis. Los valores correspondientes al tamaño de la colonia de los aislamientos son similares a los reportados por Martínez et al. (2001). Independientemente del crecimiento de la colonia, la amplitud de los halos fluctuó entre 0,1 y 0,7cm, destacándose, en primer lugar, el aislamiento 64; en segundo lugar, los aislamientos 3, 21, 62 y 66; tercero, los aislamientos 13, 14, 65, 68 y 75 y, en cuarto lugar, los aislamientos 11, 12 y 53, con halos de 0,7, 0,6, 0,5 y 0,4cm, respectivamente. Esta observación en relación a la variación de la capacidad celulolítica de los aislamientos es importante, por cuanto genera la posibilidad de clasificar los aislamientos y seleccionar los de mayor capacidad, para un mejor aprovechamiento de su potencial, así como lo indican Mikan et al. (2004). En la figura 1, se ilustran los halos de hidrólisis de celulosa obtenidos en cuatro de los aislamientos.

Compatibilidad entre los aislamientos de mayor capacidad celulolítica. Los resultados obtenidos en las pruebas de compatibilidad entre los aislamientos de mayor capacidad celulolítica (Amplitud del halo entre 0,4 y 0,7cm) permiten entrever que la interacción entre hongos celulolíticos, en su hábitat natural, seguramente en procura de los factores de crecimiento, es intensa. Cada uno mostró compatibilidad e incompatibilidad con varios de los aislamientos, a excepción del No. 21, que resultó ser compatible con todos los demás aislamientos incluidos en la prueba. Se destaca que este aislamiento figura entre los de mayor capacidad celulolítica, con un halo de 0,6cm de amplitud.
Aislamientos seleccionados para el inóculo. De acuerdo con los datos de la tabla 1 y las pruebas de compatibilidad, en cuanto a crecimiento, el inóculo fue generado con los aislamientos 21 (Trichoderma sp.) y 66 y 62 (Penicillium sp.). El aislamiento 64, que mostró el mayor halo de amplitud alrededor de la colonia, no fue incluido, debido a su crecimiento muy lento en medio de cultivo CMC. Otro criterio tenido en cuenta para la selección de los aislamientos fue su importancia desde el punto de vista agronómico o ambiental. En este sentido, las especies de Trichoderma han sido destacadas en el biocontrol de varios fitopatógenos, a través de los mecanismos de competencia por el sustrato, micoparasitismo, antibiosis, desactivación de enzimas del patógeno y resistencia inducida (Quiroz & Ferrera, 2008; Reyes et al. 2008; Torres et al. 2008; Infante et al. 2009) y, además, por su potencial en cuanto a la producción de biocombustibles (Mukherjee et al. 2013); por su parte, las especies del género Penicillium han sido destacadas por su capacidad celulolítica (Alexander, 1977; Sylvia et al. 2005).
Sustrato para la multiplicación masiva del inóculo. Los resultados sobre la producción de conidias no mostraron diferencias significativas entre sustratos en ninguno de los tres aislamientos, indicando que cualquiera de los sustratos evaluados podría ser utilizado para la producción masiva del inóculo. Particularmente, en el caso del Trichoderma, el número de conidias, aunque alto, resultó inferior al reportado por otros autores, en sustratos diferentes (Agamez et al. 2008; Aceves et al. 2008). Con base en la facilidad de consecución de los insumos para la multiplicación masiva del inóculo, se optó por suplementar el arroz con leche y los ingredientes del Caldo Rizósfera (Méndez & Viteri, 2007).
Cantidad de agregados producidos en las composteras. La formación de agregados a partir de los residuos orgánicos utilizados fue progresiva, a través del proceso de compostaje, sin presentarse diferencias significativas entre tratamientos, en ninguno de los muestreos. La mayor cantidad de agregados ocurrió en el tamaño entre 2 y 4,75mm, tal como se ilustra en la figura 2.
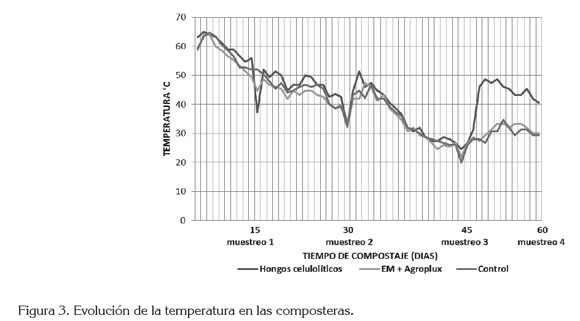
Evolución de la temperatura en las composteras. En los tres tratamientos, la temperatura subió hasta un máximo de 66°C, durante los primeros cinco días después del montaje, similar a lo observado por Cariello et al. (2007) y Nair et al. (2010). La subida de la temperatura en la etapa termofílica es responsable de la eliminación de microorganismos patógenos y de semillas de arvenses; además, su incremento es un indicativo de la efectividad en el proceso de compostaje, ya que dichas temperaturas se alcanzan solamente si el material tiene condiciones físicas adecuadas, si las pilas están bien montadas y si existe una participación activa de los microorganismos (Mendoza et al. 1998). Después del primer volteo, la temperatura bajo hasta 35°C, en el día 30, cuando se realizó el segundo volteo. Como efecto de la reinoculación en dicho volteo, se registró un nuevo aumento de temperatura hasta 50oC, seguido de un descenso a 20oC, en el día 45, cuando se efectuó el tercer volteo. Después de la re-inoculación en el tercer volteo, se presentaron diferencias entre tratamientos, mientras en las pilas inoculadas con los hongos celulolíticos la temperatura subió a valores cercanos a los 50oC, estabilizándose, al final del proceso, en valores cercanos a los 40oC, en las pilas inoculadas con EM® y Agroplux® y en el control el aumento no fue considerable, fluctuando entre 26oC a 30oC, hasta el final del proceso (figura 3). Esta observación concuerda con Stentiford & Bertoldi (2011), quienes afirman que la fase siguiente a la termofílica se caracteriza por un número creciente de microorganismos, capaces de degradar los polímeros celulosa, hemicelulosa, lignina y pectinas, entre los cuales, predominan hongos y actinomicetos.
pH y conductividad eléctrica en las composteras. Los valores de pH al inicio del proceso fueron altos en los tres tratamientos, en el rango fuertemente alcalino (pH 8,5 a 9). De los 15 a los 30 días, se registró un leve aumento, debido a que los microorganismos mineralizaron el nitrógeno en las composteras, generando liberación de amonio y, por consiguiente, elevando el pH (Moreno & Moral 2007). Desde los 30 días hasta el final del proceso, el pH descendió moderadamente, a valores entre 8,1 y 8,5, que corresponden a pilas de compost en estado de maduración (Brunt et al. 1985). Por su parte, los resultados de la CE, obtenidos a los 45 y 60 días, giran alrededor de 4 dS m-1, dentro del rango entre 4 y 10 dS m-1, establecido para cultivos sensibles a la concen tración de sales (Epstein, 1997). Según Díaz et al. (2007), la salinidad es un parámetro que se puede convertir en un factor limitante para el uso de los composts, especialmente en germinadores y cultivos de invernadero, en los cuales, la concentración total de sales solubles en el sustrato final no debe exceder de 1.5 dS m-1. En general, se prevé que el uso de compost con los valores de CE obtenidos ayudaría a la neutralización de la acidez del suelo y a minimizar los costos de encalamiento.
Evolución de CO2. La evolución de CO2 en las muestras de las composteras, tomadas a los 45 días del proceso, se presenta en la figura 4, en la que se aprecia un incremento gradual de la evolución de CO2 en las composteras inoculadas, indicando que, tanto los hongos celulolíticos como los microorganismos del EM® y Agroplux®, promovieron una actividad más intensa que los microorganismos nativos en las composteras control. En el día siete, al final de la prueba, los valores en las muestras descendieron hasta un rango entre 0,5 y 0,8 mg CO2 g-1 día-1, aproximándose a lo señalado por Sullivan y Miller (2005), en el sentido que una pila de compost en estado de maduración debe presentar valores de emisión menores a 2mg CO2 g-1 día1, como requisito para considerase como un compost estable.

Pese a que en las variables determinadas con relación a la efectividad del inóculo se presentó cierta tendencia a favor de los hongos celulolíticos y los microorganismos del EM® y Agroplux®, la falta de diferencias significativas entre los tratamientos sugiere que, con la clase de residuos que en este estudio se llevó a efecto el proceso de compostaje, la inoculación de las composteras activó el proceso, pero no alcanzó a producir efectos de importancia, indicando que la eficiencia de los microorganismos nativos fue suficiente para llevar, a feliz término, el proceso de compostaje. Resultados similares fueron obtenidos por Lu et al. (2004), Nair et al. (2010) y Somjai & Siriwan, 2014), quienes encontraron que la inoculación con microorganismos específicos no es garantía para acelerar el proceso de compostaje de desechos orgánicos. Una de las posibles razones pudo ser la relación C:N, la cual, pudo ser muy baja y, en consecuencia, se activó igualmente el proceso en todas las composteras. Lo anterior sugiere que la evaluación de la efectividad de microorganismos específicamente seleccionados, se debería realizar por separado, pero en términos del compostaje, esto no tiene aplicación, ya que los residuos orgánicos naturalmente albergan una gran diversidad de microorganismos, entre los que se encuentra el grupo específico de celulolíticos. De todas maneras, los resultados obtenidos dejan entrever que, en el caso del compostaje de residuos sólidos orgánicos, lo recomendable es optimizar los factores físicos, químicos y ambientales, con el fin de activar, apropiadamente, los microorganismos nativos. Esta información constituye una alerta para las empresas e instituciones que invierten recursos en la compra de inoculantes para acelerar el proceso de compostaje.
Aparte de la alerta respecto a la inoculación de residuos sólidos orgánicos, se resalta que, mediante la presente investigación, se amplía la información respecto a la existencia de hongos celulolíticos en zonas tropicales, como las de Boyacá y, segundo, se verifica la posibilidad de seleccionar los de mayor capacidad celulolítica para su aplicación, no solamente con el propósito de solucionar problemas ambientales sino también con otros fines, ya que según la literatura,los hongos celulolíticos tienen potencial para la producción de papel, textiles, biocombustibles y alimentos, entre otros (Bajpai, 1999; Lon-Wo et al. 2002; Sukumaran et al. 2005; Martínez et al. 2008; Michelena et al. 2009).
Agradecimientos: Los autores expresan un agradecimiento al profesor Jorge Orlando Blanco, de la Escuela de Biología, de la UPTC, por su valiosa colaboración en la identificación de los hongos celulolíticos y a la Universidad Pedagógica y Tecnológica de Colombia, por haber suministrado parte de los recursos para el desarrollo de la investigación. Conflictos de interés: El manuscrito fue preparado y revisado con la participación de todos los autores, quienes declaramos que no existe ningún conflicto de intereses que ponga en riesgo la validez de los resultados presentados.
BIBLIOGRAFÍA
1. ACEVES, M.; OTERO, M.; MARTÍNEZ, R.; RODRÍGUEZ, N.; ARIZA, R.; BARRIOS, A. 2008. Producción masiva de Trichoderma harzianum Rifai en diferentes sustratos orgánicos. Rev. Chapingo Ser. Hortic. (México). 14(2):185-191.
2. AGAMEZ, E.; ZAPATA, R.; OVIEDO, L.; BARRERA, J. 2008. Evaluación de sustratos y procesos de fermentación sólida para la producción de esporas de Trichoderma sp. Rev. Col. Biotecnol. 10(2):23-34.
3. ALEXANDER, M. 1977. Introduction to Soil Microbiology. Second Edition. Ed. John Wiley and Sons. (New York). 148p.
4. ANDERSON, J. 1982. Soil respiration. En: Page, A.L.; Millar R.H.; Keeney D.R. (eds). Methods of soil analysis. Part 2, Chemical and microbiological properties. Ed. Am. Soc. Agr.-Soil Sci. Soc. Am. p.831-871.
5. ATLAS, R.; BARTHA, R. 1981. Microbial Ecology: Fundamentals and Applications. Ed: Addison-Wesley Publ. (Estados Unidos). p.357-358.
6. BAJPAI, P. 1999. Application of enzymes in the pulp and paper industry. Biotechnol. Prog. (Estados Unidos). 15(2):147-157.
7. BARNETT, H.L.; BARRY, B. 1998. Illustrated genera of imperferct fungi. Ed. Burgess Publ. Co. (Estados Unidos). 218p.
8. BRUNT, L.P.; DEAN, R.B.; PATRICK, P.K. 1985. Composting. En: Michael, J. (ed.) Solid Waste Management, selected topics. OMS. (Dinamarca). p.37-77.
9. CARIELLO, M.; CASTAÑEDA, L.; RIOBO, I.; GONZÁLEZ, J.; 2007. Endogenous microorganisms inoculant to speed up the composting process of urban sewage sludge. R. C. Suelo Nutr. Veg. (Chile). 7(3):26-35.
10. CASTELLS, X. 2000. Reciclaje de residuos industriales. Ed. Díaz Santos. (España). 4p.
11. CASTELLS, X. 2012. Métodos de valorización y tratamiento de residuos municipales. Ed. Díaz Santos. (España). 866p.
12. CASTILLO, F. 2005. Biotecnología ambiental. Ed. Tébar. (Madrid). 404p.
13. CRUZ, N.; CASTELLANOS, D.; ARGÜELLO, H. 2009. Degradación de celulosa y xilano por microorganismos aislados de dos tipos de compost de residuos agrícolas en la Sabana de Bogotá. Rev. Col. Cienc. Hort. 3(2):237-249.
14. DÍAZ, L.F.; BERTOLDI, M.; BIDLINGMAIER, W.; STENTIFORD, E. 2007. Compost science and technology. Ed. Elsevier Science. (Boston), 380p.
15. DOMSH, K.; GAMS, W.; ANDERSON, T. 1980. Compendium of soil fungi. Vol. 1, Parte I. Ed. Academic Press (Estados Unidos). 859p.
16. EPSTEIN, E. 1997. The Science of Composting. Ed. CRC Press. (USA). 487p.
17. ESCAMIROSA, L.; DEL CARPIO, C.; CASTAÑEDA, G.; QUINTAL, C. 2001. Manejo de los residuos sólido domiciliarios en la ciudad de Tuxtla Gutiérrez Chiapas. Ed. Plaza y Valdez S.A. (México). p.20-21.
18. GIL, M.; RUEDA, P.; SALGADO, A.; VARELA, A. 2006. EM, en manejo de residuos sólidos orgánicos. Ed. Servimpresiones Corporación Minuto de Dios. (Colombia). 8p.
19. GIRALDO, E. 1998. Manejo Integrado de Residuos Sólidos Municipales. Ed. Universidad de los Andes (Colombia). 185p.
20. GUPTA, P.; SAMANT, K.; SAHU, S. 2012. Isolation of cellulose-degrading bacteria and determination of their cellulolytic potential. Int. J. Microbiol. (India). 12(ID 578925): 1-5.
21. GUTIÉRREZ, R.; PINZÓN, A.; CASAS, J.; MARTÍNEZ, M. 2008. Determinación de la actividad celulolítica del suelo proveniente de cultivos de Stevia rebaudiana Bertoni. Agronomía Colombiana. 26(3):497-504.
22. INFANTE, D.; MARTÍNEZ, B.; GONZÁLEZ, N; REYES Y. 2009. Mecanismos de acción de Trichoderma frente a hongos fitopatógenos. Rev. Prot. Veg. (Cuba).24(1):14-21.
23. INSTITUTO GEOGRÁFICO AGUSTÍN CODAZZI -IGAC-. 2006. Métodos Analíticos de laboratorio de Suelos. Ed. IGAC (Colombia). 648p.
24. LON-WO, E.; DALE, N.; CÁRDENAS, M. 2002. Complejo enzimático celulasa. Su potencialidad en dietas con Saccharina. Rev. Cub. Cienc. Agr. 36(3):231-234.
25. LU, W.J.; WANG, H.T.; HUANG, D.Y.; QIU, X.Y.; CHEN, J.C. 2004. Effect of inoculating flower stalk and vegetable waste with ligno-cellulolytic microorganisms on the composting process. J. Environ. Sci. Health, Part B, Pesticides, Food Contaminants, and Agricultural Wastes. 39:873-889.
26. MARÍN, M.; ARAGÓN, P.; GÓMEZ, C. 2002. Análisis químico de suelos y aguas: manual de laboratorio. Ed. Universidad Politécnica de Valencia. (España). 34p.
27. MARTÍNEZ, A.E.; CHIOCCHIO, V.M.; GODEAS, A.M. 2001. Hyphomycetes Celuloliticos en suelos de bosques de Nothofagus, Tierra del Fuego. Gayana Bot. (Argentina). 58(2):123-132.
28. MARTÍNEZ, C.; BALCÁZAR, E.; DANTÁN, E.; FOLCH, J. 2008. Celulasas fúngicas: Aspectos biológicos y aplicaciones en la industria energética. Rev. Latinoam. Microbiol. (México). 50(3-4):119-131.
29. MÉNDEZ, M.; VITERI, S. 2007. Alternativas de biofertilización para la producción sostenible de cebolla de bulbo (Allium cepa) en Cucaita, Boyacá. Agr. Col. 25(1):168-175.
30. MENDOZA, J.; PALOMORES, A.; MONTAÑES, M. 1998. Ciencia y tecnología del medio ambiente. Ed. Universidad Politécnica de Valencia. (España). 177p.
31. MICHELENA, G.; BUENO, G.; ENG, F.; VIÑALS, M.; ÁLVAREZ, A.; BELL, A.; CARRERA, E.; MANGANELLY, E. 2009. Etanol celulósico: una alternativa energética sustentable sin competencia con los alimentos. Rev. ICIDCA. Sobre los Derivados de la Caña de Azúcar (Cuba). 43(1):10-16.
32. MIKAN, J.; CASTELLANOS, D. 2004. Screening para el aislamiento y caracterización de microrganismos y enzimas potencialmente útiles para la degradación de celulosas y hemicelulosas. Rev. Col. Biotecn. 6(1):58-71.
33. MINISTERIO DE AMBIENTE, VIVIENDA Y DESARROLLO TERRITORIAL -MAVDT-. 2007. Líneas estratégicas 2007-2010. Ed. Imprenta Nacional de Colombia. (Colombia). 48p.
34. MORENO, J.; MORAL, R 2007. Compostaje. Ed. Ediciones Multiprensa (España).124p.
35. MUKHERJEE, P.; HORWITZ, B.; SINGH, U.S.; MUKHERJEE, M.; SCHMOLL, M. 2013. Trichoderma. Biology and applications. Ed. CAB International. (India). 4p.
36. NAIR, J.; OKAMITSU, K. Microbial inoculants for small scale composting of putrescible kitchen wastes. 2010. Waste Manag. 30(6):977-982.
37. QUIROZ, V.; FERRERA, C. 2008. Antagonismo in vitro de cepas de Aspergillus y Trichoderma hacia hongos filamentosos que afectan al cultivo del ajo. Rev. Mex. Micol. 26:27-34.
38. RAJVAIDYA, N.; MARKANDEY, D. 2006. Agricultural Applications of Microbiology. Ed. Efficient offset printers. (New Delhi). 55p.
39. REYES, Y.; MARTÍNEZ, B.; INFANTE, D. 2008. Evaluación de la actividad antagónica de trece aislamientos de Trichoderma spp. sobre Rhizoctonia sp. Rev. Prot. Veg. (Cuba). 23(2):112-117.
40. RODRÍGUEZ, G.; LONDOÑO, B.; HERRERA, G. 2008. Ciudades ambientalmente sostenibles. Ed. U. del Rosario (Colombia). 158p.
41. SOMJAI, K.; SIRIWAN, N. 2014. Effects of microbial inoculation on composting of household organic waste using passive aeration bin. Int. J. Recycling Organic Waste Agr. 23(4):113-119.
42. STENTIFORD, E.; BERTOLDI, M. 2011. Composting: process. En Christensen, T. (ed.), Solid Waste Technology and Management. Ed. John Wiley & Sons. (New Jersey). p.515-532.
43. SULLIVAN, D.M.; MILLER, R.O. 2005; Propiedades cualitativas, medición y variabilidad de los composts. En: Stofella, P.J.; Kahn, B.A. (eds) Utilización de compost en los sistemas de cultivo hortícola. Ed. Mundi-Prensa. (España). p.95-119.
44. SUPERINTENDENCIA DE SERVICIOS PÚBLICOS DOMICILIARIOS, SSPD. 2011. Situación de la disposición final de residuos sólidos en Colombia- diagnostico 2011. Ed. Imprenta Nacional (Colombia). 5p.
45. SUPERINTENDENCIA DE SERVICIOS PÚBLICOS DOMICILIARIOS, SSPD. (2008). Polticas colombianas para el agua potable y el saneamiento básico: experiencia, logros y retos. Santiago de Chile 42p.
46. SUKUMARAN, R.; RANI, R.; PANDEY, A. 2005. Microbial cellulases-production, applications and challenges. J. Scientific Industr. Res. (India). 64:832-844.
47. SYLVIA, D.; HARTEL, P.; FUHRMANN, J.; ZUBERER, D. 2005. Principles and applications of soil microbiology. Ed. Prentice Hall. (New Jersey). 640p.
48. TERRAZA, H. 2009. Lineamientos para un servicio integral sustentado e inclusivo. Banco Interam. de Desarrollo. (New York). 6p.
49. TORRES, E.; IANNACONE, J.; GÓMEZ, H. 2008. Biocontrol del moho foliar del tomate Cladosporium fulvum empleando cuatro hongos antagonistas. Bragantia. (Brazil). 67(1):169-178.
50. WAGHMARE, P.R.; KSHIRSAGAR, S.D.; SARATALE, R.G.; GOVINDWAR, S.P.; SARATALE, G.D. 2014. Production and characterization of cellulolytic enzymes by isolated Klebsiella sp. PRW-1 using agricultural waste biomass. Emir. J. Food. Agric. 26(1):44-59.
Recibido: Abril 21 de 2014 Aceptado: Abril 23 de 2015

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.