CIENCIAS AGROPECUARIAS Y BIOLÓGICAS - Artículo Técnico
FLUIDOTERAPIA EN GANADO BOVINO
FLUID THERAPY IN BOVINE CATTLE
Johann R. Baquero-Parrado1; Edgar E. Fuentes-Reyes.2
1MVZ, Esp. Área Promoción y Prevención, Secretaría Seccional de Salud, Gobernación del Meta, Calle 37 No 41-80 Barzal Alto, Villavicencio, Colombia. Correo electrónico:jobaquero@udca.edu.co
2 MVZ, M.Sc, PhD, Profesor Asociado, Director Escuela M.V.Z., Universidad de los Llanos, A.A.: 2621, Villavicencio (Meta).
Rev. U.D.C.A Act. & Div. Cient. 10 (2):3-17, 2007
RESUMEN
Muchas enfermedades tanto en terneros como en el ganado adulto son caracterizadas por deshidratación. Disturbios severos del estado ácido-base, desbalances electrolíticos así como cambios bioquímicos, ocurren frecuentemente en este cuadro y es la fluidoterapia una herramienta valiosa para corregir estos imbalances. Sin embargo, es esencial corregir el problema subyacente tan rápidamente como sea posible. Teniendo en cuenta que el acceso a pruebas auxiliares de laboratorio a nivel de campo es restringido, el Médico Veterinario deberá definir, en la medida de lo posible, a través de una historia exacta y un examen clínico completo, si existe un verdadero déficit de agua corporal y/o desequilibrio ácido-base o si existe un déficit de electrolitos, para así seleccionar la vía de administración, el tipo de solución y el volumen de líquidos a administrar, los cuales serán útiles para todos los clínicos de medicina interna bovina.
Palabras clave: bovinos, deshidratación, electrolitos, fluidoterapia.
SUMMARY
Many diseases of both calves and adult cattle are characterized by dehydration, severe disturbances of the acid-base state, electrolyte imbalances as well as biochemical changes, being the fluid therapy a valuable tool for correction of these imbalances. However, it is essential to correct the underlying problem as quick as possible. Taking into count that the access to the laboratory ancillary tests is restricted in the field, the Veterinary Medic will have to define if possible, through an accurate history and complete clinic examination, if the patient has a true acid-base disturbance and/or deficit in corporal water, or if there is an electrolytes lack, in order to select the route of administration, solution type and volume of liquids to administer, which will be useful to all professionals of bovine internal medicine.
Key words: bovines, dehydration, electrolytes, fluid therapy.
INTRODUCCIÓN
Los objetivos principales de la fluidoterapia corresponden a normalizar la hipovolemia y corregir la deshidratación por medio de soluciones electrolíticas, de acuerdo a las necesidades terapéuticas establecidas por el clínico. Esta revisión bibliográfica pretende proporcionar los diferentes elementos de juicio con los que cuenta el clínico de campo para estimar el grado de deshidratación, estado electrolítico y ácido-base y calcular los requerimientos adecuados para corregir tales condiciones. Se plantean así los diferentes parámetros clínicos y de laboratorio para realizar una correcta hidratación y corrección del equilibrio ácido-base, de acuerdo a las investigaciones realizadas sobre el tópico. También enfatiza sobre las posibles áreas donde sería necesario investigar, contribuyendo al mejoramiento y al bienestar animal, evitando pérdidas económicas en los sistemas de producción bovina.
CONSIDERACIONES GENERALES
Los bovinos experimentan cambios en su estado hídrico-electrolítico y ácido-base en diferentes etapas (Vermorel et al. 1989; Besser et al. 1990; Bajcsy et al. 1999). La deshidratación va acompa?ada de grandes pérdidas del volumen del fluido extracelular y de electrolitos que, a su vez, alteran el estado ácido-base y de no corregirse a tiempo, podrían conducir a la muerte.
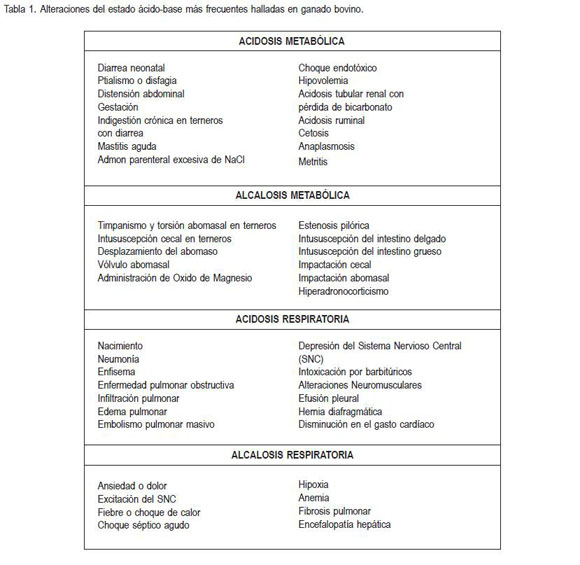
Cabe anotar que la composición de la dieta (Tucker et al. 1988), la frecuencia de alimentación (Rodehutscord et al. 1994; Eicher et al. 1999), la supresión del consumo de agua (Parker et al. 2003), la altura sobre el nivel del mar (Ramírez et al. 1992) y en especial las enfermedades del tracto gastrointestinal (Rousell et al. 1998), también comprometen el estado ácido-base (tabla 1).

ESTADO ÁCIDO-BASE
El modelo tradicional para la evaluación del estado ácido-base es la ecuación Henderson-Hasselbach que categoriza cuatro disturbios primarios: acidosis respiratoria (tensión de dióxido de carbono -PCO2-incrementada), alcalosis respiratoria (PCO2 reducida), acidosis metabólica (reducción del exceso de base extracelular) o alcalosis metabólica (incremento del exceso de base extracelular). Como el pH es el logaritmo negativo de [H+], la ecuación de Henderson-Hasselbach es expresada como: pH= pK+log [HCO3-] / s x PCO2, donde (pK) es el logaritmo de una constante de disociación y (S) es un factor de solubilidad que convierte PCO2 en moles/L. Este modelo es adecuado en la práctica clínica y se recomienda siempre y cuando las concentraciones séricas de proteínas totales, albúmina y fosfato sean cercanas a la normalidad (Figge et al. 1991; 1992; 1998). Sin embargo, cuando las concentraciones son muy anormales conduce a menudo a conclusiones incorrectas del origen de la alteración ácido-base (Constable, 2000).
De otra parte, el modelo de iones fuertes de Stewart parte de la base de que las concentraciones de bicarbonato ([HCO3-]) e hidrógeno ([H+]) son dependientes de las concentraciones de las variables independientes o primarias: PCO2, ácidos débiles totales o proteínas e iones fuertes (Stewart, 1983; Baquero-Parrado, 2005a). Según Stewart, los tres componentes principales de consideración que garantizan la evaluación del estado ácido-base son las variables primarias o independientes, las variables desconocidas o secundarias y las constantes de disociación de sus respectivas variables. Las tres variables independientes predominantes son PCO2, proteínas o ácidos débiles totales y la diferencia entre las cargas positivas y negativas de los iones fuertes, de modo que una disminución en la diferencia de iones fuertes (DIF), por debajo de lo normal, resulta en acidosis (incremento en H+) y un incremento en la diferencia de iones fuertes, por encima de lo normal, resulta en alcalosis (disminución en H+) (Whitehair et al. 1995); aunque una disminución en la [DIF] también se podría atribuir en principio a un incremento en la concentración de cloro (Wilkes, 1998).
Por último, el nuevo modelo físico-químico para evaluar el estado ácido-base utiliza el Modelo de Iones Fuertes Simplificado (Constable, 1997a, Constable et al. 2005) para categorizar seis alteraciones primarias: acidosis respiratoria (presión parcial de dióxido de carbono en sangre arterial -PaCO2-incrementada), alcalosis respiratoria (PaCO2 reducida), acidosis por iones fuertes (diferencia de iones fuertes [DIF+] reducida), alcalosis por iones fuertes ([DIF+] incrementada), acidosis por iones buffer no volátiles (concentraciones plasmáticas incrementadas de albúmina, globulina o fosfato) y alcalosis por iones buffer no volátiles (concentraciones plasmáticas reducidas de albúmina, globulina o fosfato). Este modelo sostiene que los componentes plasmáticos actúan como iones fuertes (DIF+), iones buffer volátiles (HCO3-) o iones buffer no volátiles (A-). Por lo tanto, el plasma sanguíneo contiene tres tipos de componentes con carga: DIF+, HCO3- y A- . La necesidad de mantener la electroneutralidad determina que en todo momento la concentración de iones fuertes [DIF+] iguala a la suma de la concentración del ion buffer bicarbonato [HCO3-] más la concentración del ion buffer no volátil [A-] , de manera que: [DIF+] - [HCO3-] - [A-] = 0.
La ecuación sostiene que todas los componentes ionizados en el plasma se pueden clasificar como un ion fuerte (DIF+), un ion buffer volátil (HCO3-) o un ion buffer no volátil (A-). Esta teoría fundamenta el modelo de iones fuertes simplificado, de suerte que los factores más importantes que determinan el pH plasmático en un cuadro clínico son la PCO2, la [DIF+] y la concentración de buffers plasmáticos no volátiles individuales (como albúmina, globulina y fosfato). Una modificación en cualquiera de estas variables producirá un cambio directo y predecible sobre el pH plasmático (Constable, 1999).
Los iones buffer no volátiles han sido determinados en terneros (Staempfli et al. 1994), en equinos (Constable et al. 1998b), en bovinos (Constable, 2002), en felinos (McCullough & Constable, 2003), en caninos (Constable & Staempfli, 2005) y en seres humanos (Staempfli & Constable, 2003), facilitando el uso del modelo de iones fuertes simplificado y, por ende, el diagnóstico y el tratamiento de los disturbios ácido-base en pacientes críticamente enfermos. En Colombia, se ha encontrado que en vacas Holstein Friesian en la Sabana de Bogotá, a los días 30 y 60 de producción láctea, el pH, el PaCO2 y el HCO3- disminuyen indicando, una acidosis metabólica -de acuerdo con el modelo Henderson-Hasselbach- , atribuida a la máxima movilización de las reservas de ácidos grasos del cuerpo, a la alta lipólisis y al nivel elevado de cuerpos cetónicos en los estados de lactación, lo cual provoca un balance energético negativo, resultando finalmente una disminución del pH (Velásquez, 1993).
Entre las causas más frecuentes de acidosis metabólica, se encuentran la falla renal, sobrecarga por carbohidratos, cetosis e hígado graso, mientras que el vólvulo abomasal, desplazamiento e impactación abomasal, intususcepción y torsión cecal son causas de moderada a severa alcalosis (Simpson et al. 1985; Roussel, 1993). El secuestro de cloro en el intestino delgado proximal, abomaso y rúmen conllevan a alcalosis hipoclorémica. La alcalosis y la anorexia resultan en hipokalemia, mientras que el ganado lechero lactante está a menudo hipocalcémico (Roussel, 1993).
GRADO DE DESHIDRATACIÓN
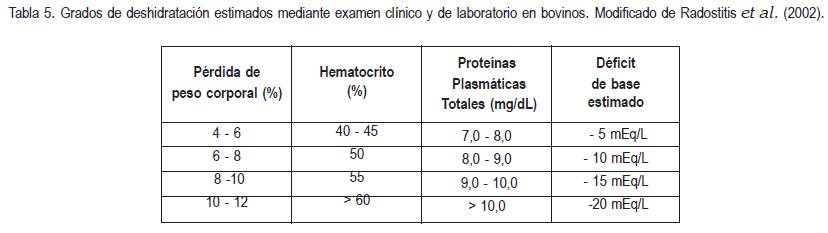
El monitoreo seriado del peso corporal es requisito indispensable para determinar con precisión el estado de deshidratación y el nivel de rehidratación en terneros; sin embargo, en el campo, este método no es práctico y, por tal motivo, se han establecido diferentes parámetros para realizar dicha estimación. Los parámetros clínicos para determinar la deshidratación son: el grado de retracción del globo ocular en la órbita, la elasticidad de la piel del cuello y el tórax y la concentración de proteínas plasmáticas (tabla 2).
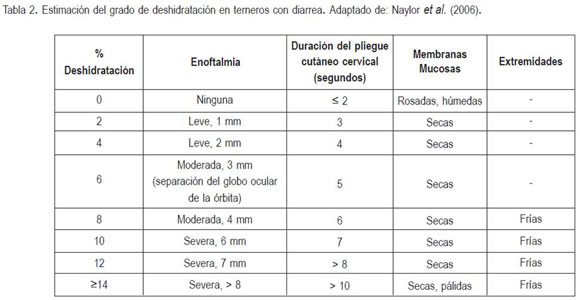
Las limitaciones de los anteriores parámetros, se relacionan con diarrea crónica (emaciación) y con redistribución en el fluido extracelular (pérdida de líquido al tercer espacio), pues la posición del globo ocular dentro de la órbita depende también de los depósitos de grasa retroorbitaria y no solamente del estado de hidratación (Constable et al. 1998a). Normalmente, los bovinos diarreicos o hipovolémicos presentan hemoconcentración, por lo tanto, se recomienda determinar seriadamente el hematocrito durante el transcurso de la hidratación, mientras éste se reestablece dentro de los parámetros normales. Así mismo, antes y durante la hidratación, se debe determinar la concentración de electrolitos séricos sanguíneos, gases sanguíneos (PCO2, PO2, HCO3-) y pH de los pacientes deshidratados o en choque (tabla 3).
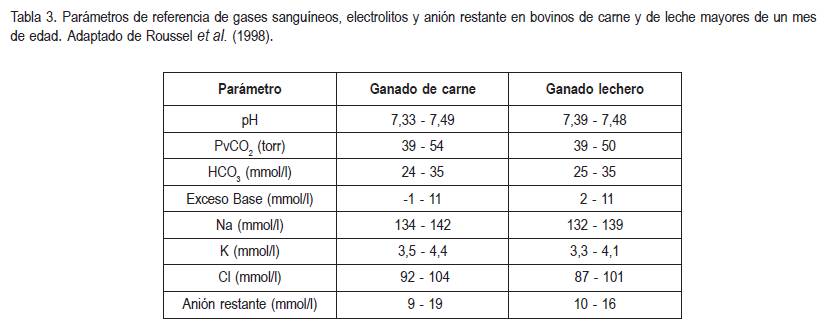
Además, se debe determinar la concentración de proteínas plasmáticas totales y la presión osmótica coloidal (Thomas & Brown, 1992; Brown et al. 1994) para disminuir los riesgos de sobrehidratación y edema pulmonar o cerebral (Carlson, 1989; Angelos et al. 1999; Oh & Kim, 2002). Se recomienda realizar, mediante el método de diagnóstico orientado al problema, la reevaluación del paciente durante el transcurso de la hidratación (Tyler & Schumacher, 1992)
Entre las enfermedades más comunes en bovinos asociadas con deshidratación, se encuentran la diarrea neonatal indiferenciada y septicemia neonatal. Durante la diarrea, la deshidratación ocurre por grandes pérdidas del líquido extracelular, generando una hipovolemia que puede conducir a un choque hipovolémico y a un aumento del metabolismo anaeróbico. La disminución en la concentración de bicarbonato plasmático, debida a la pérdida de bicarbonato fecal, tiende a ser sustancialmente menor a 8,2mEq/L por cada día de diarrea (Constable et al. 2005). La acidosis depende de la edad, siendo más intensa en terneros de ocho días que en menores de esa edad (Naylor, 1987b), debido a la anaerobiosis, la pérdida intestinal de bicarbonato, la insuficiencia renal (Grove-White & White, 1993; Baquero-Parrado, 2005b) y a las altas concentraciones de D-Lactato sérico (Omole et al. 2001; Ewaschuk et al. 2004; Ewaschuk et al. 2005) (tabla 4).
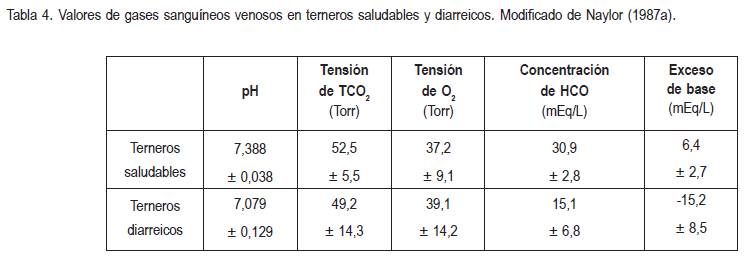
La hipoglucemia es común y cuando ocurre, se producen grandes pérdidas de sodio, de cloruro y de potasio. El desequilibrio de potasio intracelular-extracelular es marcado, provocando una disminución del potencial de reposo de la membrana celular y una alteración de la capacidad contráctil del músculo cardíaco y esquelético. Se considera que las arritmias cardíacas auscultables en terneros diarreicos deshidratados indican la presencia de hiperpotasemia grave [K+] › 8mEq/L (Naylor, 1996). Por último, los efectos de la pobre absorción de nutrientes, se combinan con las escasas reservas energéticas halladas en neonatos (Phillips, 1985), pues luego de cinco días de inanición, se produce una depleción marcada de las reservas corporales (Schoonderwoerd et al. 1986).
FLUIDOTERAPIA ORAL
La rehidratación oral durante una diarrea por mala absorción por ejemplo, rotavirus, coronavirus, puede agravar el problema, pues como resultado de la inadecuada digestión y absorción, se presenta acumulación de lactosa y de carbohidratos digestibles, los cuales son fermentados por bacterias, empeorando la diarrea a causa de un aumento en la presión osmótica. Además, se produce hipermotilidad intestinal, generando una disminución en el tiempo de tránsito y contacto de la ingesta con la pared y, por ende, problemas de digestión y absorción (Torres-Medina et al. 1985). Bajo estas condiciones, se recomienda usar fluidoterapia intravenosa (Phillips, 1985), pues el reestablecimiento es más rápido con respecto a la administración oral de fluidos. No obstante, la fluidoterapia oral es la más económica y, por lo tanto, la más aconsejable, considerando que los terneros pueden consumir ad libitumdel 12% al 19% de su peso corporal en agua, pero la rápida ingestión de grandes cantidades de agua causa hemólisis y hemoglobinuria en terneros (Constable, 2003).
Se ha demostrado que las soluciones electrolíticas orales demoran como mínimo 24 horas para rehidratar adecuadamente los terneros con un grado de deshidratación del 8% (Constable et al. 1996). Por tal motivo, los terneros que se encuentran en decúbito lateral, muy deprimidos, comatosos o con reflejo de succión ausente necesitan reanimación con fluidos intravenosos (Constable et al. 1998a; Roussel, 1993).
El retiro de la leche podría ser benéfico únicamente en terneros que estén perdiendo su interés en amamantar, pues el llenado gástrico con soluciones electrolíticas tienden a reducir el consumo de leche (Naylor, 1990). Si al ternero se le suprime de alimentos o se lleva a cabo la terapia de reposición electrolítica podría volver a tomar leche en forma gradual. Se recomienda administrar el 8% del peso corporal en leche, dividido en cuatro tomas durante el primer día y, aumentar gradualmente, a una ingesta diaria durante los próximos tres días (Mullowney & Patterson, 1985) teniendo en cuenta que los requerimientos de mantenimiento y de crecimiento para un ternero son de 55kcal/kg y 3kcal/g, respectivamente (Rager et al. 2002). Mencionan los mismos autores que los lacto reemplazadores deberían contener al menos un 22% de proteína cruda derivada de proteínas de la leche, un 20% de grasa cruda derivada de fuentes animales y un 38% de extracto libre de nitrógeno suministrado únicamente por lactosa.
Por otra parte, los terneros alimentados con baldes beben mucho más rápidamente la leche que los alimentados mediante tetina, lo que provoca un pasaje más acelerado del alimento a través del abomaso y del intestino, debido a que hay coagulación menos eficiente de proteínas de la leche y de proteólisis gástrica reducida. Estos factores dan por resultado una mayor concentración de proteínas no digeridas o parcialmente digeridas en el intestino, lo que altera la flora bacteriana.
De acuerdo a la posición de la tetina de la botella, se afecta la entrada de leche al abomaso, pues si llega a estar por encima de la cabeza del ternero es probable que no se cierre la gotera esofágica y la leche pase directamente al rúmen obteniendo fermentaciones no deseadas (Mullowney & Patterson, 1985). Lo correcto es ubicarla a la altura que corresponde a la ubre de la vaca. El cierre de la gotera esofágica, se puede inducir administrando de 100 a 250mL de solución de bicarbonato de sodio al 10% (Constable, 1993).
La frecuencia con que se suministra el alimento influirá en la formación del coágulo de la leche en el abomaso y la subsiguiente digestión. Si los terneros son alimentados una vez al día, la leche no se digiere muy bien, por lo tanto, hay la probabilidad de sobrecarga osmótica, con relación a los terneros alimentados varias veces (Mullowney & Patterson, 1985; Okine et al. 1998). Además, aumentando la frecuencia del amamantamiento con el lactorreemplazador, se incrementa significativamente el pH luminal abomasal y podría ser eficaz en la profilaxis de ulceración abomasal en el amamantamiento de terneros (Ahmed et al. 2002).
La adición de glutamina a soluciones electrolíticas orales, como precursor para la síntesis de otros aminoácidos, no ha demostrado renovar significativamente la morfología intestinal en terneros con diarrea (Naylor et de Psyllium mucilloid podría mejorar la absorción de glucosa (Cebra et al. 1998), pero tampoco mejoraría la adición de lactosa hidrolizada (Gutzwiller, 2000). De este modo, el acetato sódico y el propionato sódico son los componentes apropiados para la corrección de la acidosis metabólica leve en terneros deshidratados, debido a que son metabolizados con facilidad por los tejidos periféricos, proveyendo una fuente de energía, estimulan la absorción de agua y sodio en el intestino delgado y no alcalinizan el abomaso y el intestino. Por su parte, el bicarbonato permite la proliferación de bacterias en el abomaso alcalinizado y, por último, el acetato y el propionato, no interfieren con la coagulación de la leche en el abomaso, no neutralizan el ácido abomasal tal como ocurre con el bicarbonato, y tampoco se unen al calcio, como lo hace el citrato sódico (Naylor, 1992; Constable, 2003).
Una correlación significativa entre el cambio en la diferencia de iones fuertes y el cambio en TCO2, se presenta durante el tratamiento en los terneros que reciben fluidos orales, pero no en los terneros tratados parenteralmente (Grove-White & Michell, 2001). De ahí, que la administración de una solución oral electrolítica con una DIF alta efectiva (79 ? 93mEq/L) es más efectiva corrigiendo la hiponatremia y la acidosis metabólica que una solución DIF mucho más baja efectiva (0 ? 31mEq/L) (Constable et al. 2005).
La vía oral sola, se recomienda en bovinos adultos con deshidratación moderada (<8% del peso corporal), mientras que la fluidoterapia intravenosa, es indicada en casos de deshidratación grave (>8%). En algunos casos, se requiere de 40 a 60L/día y se debe tener en cuenta la relación costo/beneficio (valor genético). La formulación ideal de una solución rehidratante oral para rumiantes adultos debe contener concentraciones óptimas de Na+, K+, Ca2+, magnesio, fosfato y propionato, el cual facilita la absorción de sodio y provee una fuente adicional de energía al animal. El ganado adulto deshidratado puede beber del 10% al 15% de su peso corporal en agua en menos de 10'; sin embargo, estas tasas de ingestión son excesivas y pueden conducir a temblores musculares, debilidad, hipotermia y hemólisis extravascular (Constable, 2003). Roussel (1999) recomendó para administrar intrarruminalmente la siguiente composición: 140g de NaCl, 25g de KCl, 10g de CaCl2 y agua hasta completar 20L.
FLUIDOTERAPIA INTRAVENOSA
Se debe realizar el examen clínico (% deshidratación) y de laboratorio (hematocrito, proteínas plasmáticas totales, gases sanguíneos, electrolitos séricos y pH) para determinar la cantidad y la composición de fluidos a administrar (tabla 5) (Roussel, 1983; Naylor, 1987a; Nappert & Naylor, 2001).
La cateterización de la vena yugular es la más común (Pusterla & Braun, 1996); sin embargo, se puede realizar la venipunción en la vena auricular y en la vena de la glándula mamaria (Roussel et al. 1996). El volumen de líquidos no debe exceder los 80mL/kg/hora en terneros (Kasari & Naylor, 1985; Walker et al. 1998), pues a esta velocidad de infusión, se crea un aumento en la presión venosa central en cerca de un tercio de los terneros deshidratados, con ausencia de signos clínicos del edema pulmonar (Kasari & Naylor, 1985). La sobrehidratación, se puede asociar con anemia e hipoproteinemia, conduciendo a hipoxia al caer el hematocrito por debajo del 15%. La formación de edema intersticial tiene lugar cuando la concentración de proteínas plasmáticas totales es inferior a 4mg/dl (Berchtold, 1999). Sin embargo, cuando se administra a una velocidad más conservadora de 30 a 40mL/kg/hora, un ternero de 40kg con deshidratación del 10% puede ser rehidratado en el plazo de 3 a 4 horas (Roussel, 1983), mientras que tasas de administración de dextrosa mayores a 0,06g/kg/minuto tienen efectos nocivos (Constable, 2003). Además, se deben agregar 80 a 100mL/kg para el mantenimiento diario y hasta 7L/día en las primeras 24 horas para reponer las pérdidas actuales. Si, se reestablece el reflejo de succión con las primeras infusiones, los requerimientos diarios se podrían suministrar por vía oral para reducir los costos (Naylor, 1996; Berchtold, 1999).
A partir de las cantidades calculadas (H2O y NaHCO3- del examen clínico) y de laboratorio (hematocrito, proteínas plasmáticas totales, hemogasometría, pH), se multiplica el déficit de base estimado por el peso corporal, por una constante de 0,5 (50% en terneros neonatos, o sea menores de 28 días y 0,3 para bovinos mayores de 28 días), que da cuenta del volumen de líquido extracelular y se calcula del siguiente modo:

Se necesitan 29,16g de NaHCO3- para reestablecer a un ternero (525mEq de NaHCO3- TOTAL en un ternero saludable de 35kg) con un déficit de base de 10 NaHCO3-/L (déficit de base total hallado de 175 NaHCO3-). Se recomienda administrar por vía intravenosa solo 1/3 del líquido total para reanimar y restaurar la circulación. Durante la administración rápida del primer litro de solución, el veterinario puede controlar y ajustar la velocidad (Roussel, 1993).
El bicarbonato de sodio es el agente de elección para la corrección de la acidosis metabólica en terneros neonatales. Cuando se administra por vía intravenosa produce alcalinización casi instantánea (Kasari & Naylor, 1985). La velocidad de administración intravenosa de NaHCO3 al 5% (hipertónica) no debe exceder de 2ml/kg/minuto (Constable, 2003), aunque se ha reportado, sin efectos deletéreos, la administración de 5mL/kg de NaHCO3 al 8,4% (hiperosmótica) durante cinco minutos que corrigen inmediatamente la acidosis por iones fuertes y la acidosis respiratoria inducida experimentalmente en terneros (Berchtold et al. 2005). La fluidoterapia parenteral con bicarbonato de sodio isotónico (1 a 3%) en terneros diarreicos acidóticos mejora el estado ácido-base, pero ambos, el calcio ionizado y el calcio total, disminuyen significantemente (Grove-White & Michell, 2001).
En vacas con estado ácido-base normal ó alcalosis metabólica (alcalosis por iones fuertes), las soluciones electrolíticas deben contener alrededor de 300 a 500mOsm/L, y además deben contener sodio (135-155mEq/L), cloruro (150-170mEq/L) y potasio (10-20mEq/L) (Roussel, 1999); también se puede utilizar Solución Ringer (Constable, 2003) ó soluciones de NaCl 0,9% con o sin potasio ya que aporta iones cloruro al líquido extracelular a pesar de ser químicamente neutra (Michell et al. 1991; Benjamin, 1991). El suministro de una cantidad adecuada de cloro permite que se reabsorba sodio sin bicarbonato. Al mismo tiempo, algunos iones potasio intracelulares son sustituidos por iones hidrógeno y este desplazamiento de cationes, mediado por el pH, propicia el restablecimiento de los niveles normales de potasio en sangre (Olcott, 1987; Blood & Radostitis, 1992).
De otro lado, en la acidosis respiratoria (PaCO2 incrementada), no se deben usar soluciones alcalinizantes porque disminuyen el flujo sanguíneo cerebral y la capacidad de la hemoglobina para liberar el oxígeno en los tejidos (Benjamín, 1991). Es preferible cambiar el ritmo respiratorio tratando el padecimiento primario; mientras que en la alcalosis respiratoria (PaCO2 reducida) debida a hiperventilación (Carlson, 1989, Halperin & Goldstein, 1999) son contraindicadas las soluciones acidificantes. Se debe procurar cambiar la PaCO2 de la atmósfera, colocando la cabeza del animal dentro de una bolsa de plástico sin asfixiarlo, hasta reestablecer los parámetros de PaCO2 normales (Benjamín, 1991).
CHOQUE
El choque más común en ganado bovino es el séptico. De acuerdo a esto, el tratamiento más importante para el choque en animales de abasto consiste en la rápida administración intravenosa de soluciones cristaloides que reestablezcan la volemia (Roussel, 1993; Cambier et al. 1997). Algunos investigadores, como Constable et al. (1991a; 1991b), han demostrado que la administración de solución salina hipertónica 7,2% a 4mL/kg, vía intravenosa, durante 4?6' en terneros con endotoxemia experimental es un método seguro de proporcionar el líquido. Induce un moderado incremento en la tasa de filtración glomerular y la producción de orina; se produce un aumento significativo en la concentración sérica de cloro y una disminución significativa en la concentración sérica de fósforo (Constable et al. 1991a). Sin embargo, una carga equivalente de sodio con solución salina isotónica (0,9%) a 32mL/kg vía intravenosa durante 4?6 minutos, incrementa el volumen minuto y el volumen sistólico en mayor proporción que la solución salina hipertónica, pero agrava la hipertensión pulmonar inducida por la endotoxemia y puede deprimir la función respiratoria.
Después de 10 a 30', se observa expansión significativa del volumen plasmático en ganado bovino (Constable et al. 1991a, 1991b; 1996; Sargison & Scott, 1996). La expansión sigue al incremento súbito de la osmolalidad plasmática asociado con la inyección rápida de solución salina hipertónica, que determina el movimiento rápido de líquido hacia el compartimiento extracelular desde el espacio intracelular y el tracto gastrointestinal en contra de un gradiente de concentración. Con el paso de varios minutos, la sal agregada se equilibra en el volumen de líquido, lo cual reduce el gradiente de concentración a través de la membrana celular. El agua sigue el movimiento de la sal, por lo cual, aumenta el volumen extracelular.
En terneros deshidratados también existe, como alternativa, la combinación de solución salina hipertónica en dextrán (70 al 6%, 4-5mL/kg vía intravenosa durante 4 minutos) y una solución electrolítica isotónica (74,5mL/kg vía oral cada 8 horas), presentando un incremento inmediato y sostenido del volumen minuto y del volumen plasmático, obteniendo resultados rápidos y eficaces, pero los costos del dextrán limitan su uso (Constable et al. 1996; Wall et al. 1996; Walker et al. 1998). Si el ternero no bebe la solución electrolítica oral isotónica por su propia voluntad después de la administración de la solución salina hipertónica en dextrán, entonces requerirá intubación ororruminal para garantizar su consumo. Las velocidades de administración reportadas de dextrán 70 son de 5 a 40mL/kg/hora, pero se recomienda administrarlo a una velocidad igual o menor de 20mL/kg/hora (Constable, 2003).
En rumiantes adultos deshidratados, endotoxémicos o en choque hemorrágico, se puede recurrir a la administración de solución salina hipertónica 7,2% a 4mL/kg, vía intravenosa durante 4?6' e inmediatamente después se debe suministrar agua corriente (la mayor parte de las vacas beben 5?10gl de agua durante los siguientes 10') y si la vaca no bebe en el plazo de 5', se debe bombear 5gl de agua en el rúmen. Es importante destacar que la solución salina hipertónica nunca se administra sola, sino con agua fresca para beber o con la administración ororruminal de agua. No obstante merece especial atención la infusión de solución salina hipertónica, pues puede inducir a acidemia e hipocloremia, lo cual podría explicar la curva de equilibrio de oxígeno, observada en sangre venosa periférica y arterial (Cambier et al. 1998).
También, se podría considerar, en la reevaluación del paciente, el compromiso renal, pues la hipovolemia causada por la deshidratación y la endotoxemia podría afectar la función renal (Lunn & McGuirk, 1990; Constable et al. 1991b). El monitoreo seriado de creatinina y excreción fraccional de electrolitos proveería un indicador razonable de la filtración glomerular y remoción de electrolitos por parte de los ri?ones (Constable, 1991; Fleming et al. 1991). La edad y la categoría de producción de leche (alta, media y baja) no influyen en la excreción fraccional de electrolitos (Fleming et al. 1992).
POSIBLES COMPLICACIONES
La mala digestión de la lactosa y la xilosa en las diarreas supone un gran problema para al ternero, ya que son pobremente digeridas (Phillips, 1985; Nappert et al. 1993). Así mismo, los errores en la mezcla de soluciones electrolíticas para rehidratar a terneros neonatos diarreicos pueden conducir a hipernatremia fatal (Pringle & Berthiaume, 1988). De otro lado, el gluconato de calcio nunca debe ser adicionado a soluciones de NaHCO3- porque inmediatamente se forma un precipitado blanco, CaCO3-, el cual interfiere con la normal administración de líquidos. Además, el NaHCO3- debe ser esterilizado por ultrafiltración, pues no es estable al calor (Corke, 1988). Se debe tener en cuenta que la administración de citrato de sodio produce signos de hipocalcemia, presuntamente porque remueve al calcio ionizado de la circulación (Naylor & Forsyth, 1986).
Para evitar las complicaciones de la administración intravenosa en la vena yugular (trombos, tromboflebitis, periflebitis y septicemia), se deben tener cuidados de asepsia y usar catéter intravenoso de calibre 14 ó 16 y, en lo posible, evitar el uso de agujas hipodérmicas descartables por causar da?o en la capa íntima de la vena (Pusterla & Braun, 1996). La tromboflebitis puede ocurrir a las 72 horas de la inserción del catéter, a pesar de una desinfección de la piel con un antiséptico yodado (Pusterla & Braun, 1995a). Con dosis bajas de heparina (120UI/kg/12 horas) por vía subcutánea y la reducción de la contaminación bacteriológica de la piel, se previene la tromboflebitis durante períodos hasta por cinco días (Pusterla & Braun, 1996). La periflebitis es caracterizada por una acumulación anecogénica de fluidos infiltrando el tejido perivascular (Pusterla & Braun, 1995b).
CONCLUSIONES
La corrección de los desequilibrios hídricos, electrolíticos y ácido-base, constituye una herramienta fundamental para evitar los efectos adversos de la hipotensión sobre todos los sistemas del organismo y para el reestablecimiento de la volemia, mientras se corrige la patología que los ocasiona. Los parámetros para calcular el grado de deshidratación son el grado de retracción del globo ocular en la órbita, la elasticidad de la piel del cuello y tórax y la concentración de proteínas plasmáticas totales, aunque estos parámetros tienen sus limitaciones. Se recomienda reevaluar los parámetros durante el transcurso de la fluidoterapia y administrar por vía intravenosa en la fase inicial solo 1/3 del líquido total para reanimar al paciente y los requerimientos diarios suministrarlos por vía oral para reducir los costos. La contraindicación más común para la administración de soluciones orales electrolíticas es el íleo. En terneros deshidratados con acidosis metabólica leve, las bases metabolizables preferidas para la fluidoterapia oral son el acetato y el propionato, mientras que por vía intravenosa se recomienda el NaHCO3-. La vía oral sola se recomienda en bovinos adultos con deshidratación moderada (<8% del peso corporal), mientras que la fluidoterapia intravenosa se reserva para casos con deshidratación grave (>8%). El consumo de agua ad libitumen terneros y en bovinos adultos deshidratados se debe evitar, pues el agua se absorbe rápidamente al torrente sanguíneo y los eritrocitos del bovino son muy sensibles a la hipoosmolaridad, lo que puede ocasionar hemólisis. Si el animal no está consumiendo agua, los requerimientos de consumo deben ser calculados para ser incluidos en el cálculo del líquido a suministrar en 24 horas, así como un porcentaje adicional (5-10%) para las pérdidas continuas. La administración de solución salina hipertónica 7,2% además de restaurar el volumen minuto, debido a la expansión rápida del volumen plasmático, revierte las anomalías celulares asociadas a choque hemorrágico, reduce el nivel y la incidencia de bacteriemia después de la hemorragia, previene el incremento de la resistencia vascular pulmonar y la exacerbación del edema pulmonar observados durante la reanimación de los pacientes sépticos con líquidos cristaloides isotónicos.
BIBLIOGRAFÍA
1. AHMED, A.F.; CONSTABLE, P.D.; MISK, N.A. 2002. Effect of feeding and route of administration on abomasal luminal pH in dairy calves fed milk replacer. J. Dairy Sci. (EEUU). 85(6):1502-1508.
2. ANGELOS, S.M.; SMITH, B.P.; GEORGE, L.W.; HOUSE, J.K.; VAN METRE, D.C.; FECTEAU, G.; THACKER, V.C.; ANGELOS, J.A. 1999. Treatment of hypernatremia in an acidotic neonatal calf. J. Am. Vet. Med. Assoc. 214(9):1364-1367.
3. BAJCSY, C.A.; REICZG J.; SZENCI, O. 1999. Circadian changes in blood ionized calcium, sodium, potassium, and chloride concentrations and pH in cattle. Am. J. Vet. Res. 60(8):945-948.
4. BAQUERO-PARRADO, J.R. 2005a. The acid-base status in clinically healthy and diseased cattle. En: Resúmenes VIII Encuentro Nal Investig. de las Ciencias Pecuarias. Rev. Col. Cienc. Pec. 18(4) Suplemento: 377.
5. BAQUERO-PARRADO, J.R., 2005b. Electrolyte and acid-base disturbances in neonatal calves with diarrea. En: Resúmenes VIII Encuentro Nal Investig. de las Ciencias Pecuarias. Rev. Col. Cienc. Pec. 18(4) Suplemento: 377.
6. BENJAMIN, M.M. 1991. Líquido y electrolitos. Manual de Patología Clínica en Veterinaria. 3? reimpresión, Edit Limusa, México, D.F. p.251-267.
7.BERCHTOLD, J. 1999. Intravenous fluid therapy of calves. Vet. Clin. North Am. Food Anim. Pract. 15(3):505-531.
8. BERCHTOLD, J.;CONSTABLE, P.D.; SMITH, G.W.; MATHUR, S.M.; MORIN, D.E.; TRANQUILLI, W.J. 2005. Effects of intravenous hyperosmotic sodium bicarbonate on arterial and cerebrospinal fluid acid-base status and cardiovascular function in calves with experimentally induced and strong ion acidosis. J. Vet. Int. Med. (EEUU) 19(2):240-251.
9. BESSER, T.E.; SZENCI, O.; GAY, C.C. 1990. Decreased colostral immunoglobulin absorption in calves with respiratory acidosis. J. Am. Vet. Med. Assoc. 196(8):1239-1243.
10. BLOOD, D.C.; RADOSTITIS, O.M. 1992. Alteraciones de líquidos orgánicos, electrolitos y equilibrio ácido-base. Medicina Veterinaria. 7a Ed. Madrid, Espa?a, Vol. 1, p. 62-81.
11. BROOKS, H.W.; HALL, G.A.; WAGSTAFF, A.J.; MICHELL, A.R. 1998. Detrimental effects on villus form during conventional oral rehydration therapy for diarrhea in calves; alleviation by a nutrient oral rehydration solution containing glutamine. The Vet. J. (Reino Unido).155(3):263-274.
12. BROWN, S.A.; DUSZA, K.; BOEHMER, J. 1994. Comparison of measured values for colloid osmotic pressure in hospitalized animals. Am. J. Vet. Res. 55(7):910-915.
13. CAMBIER, C.; RATZ, V.; ROLLIN, F.; FRANS, A.; CLERBAUX, T.; GUSTIN, P. 1997. The effects of hypertonic saline in healthy and diseased animals. Vet. Res. Commun. (Países Bajos). 21(5):303-316.
14. CAMBIER, C., DETRY, B., BEERENS, D., FLORQUIN, S., ANSAY, M., FRANS, A.; CLERBAUX, T.; GUSTIN, P. 1998. Effects of hypochloremia on blood oxygen binding in healthy calves. J. Appl. Physiol. (EEUU). 85(4):1267-1272.
15. CARLSON, G.P. 1989. Fluid, electrolyte, and acid-base balance. En: Kaneko, J.J. Clinical and Biochemistry of Domestic Animals. 4a Ed, San Diego California, U.S.A., Academic Press, p.543-575.
16. CEBRA, M.L.; GARRY, F.B.; CEBRA, C.K.; ADAMS, R.; McCAN, J.P.; FETTMAN, M.J. 1998. Treatment of neonatal calf diarrhea with oral electrolyte solution supplemented with Psyllium mucilloid. J. Vet. Intern. Med. 12(6):449-455.
17.CONSTABLE, P.D.; SCHMALL, L.M.; MUIR III, W.W.; HOFFSIS, G.F. 1991a. Respiratory, renal, hematologic, and serum biochemical effects of hypertonic saline solution in endotoxemic calves. Am. J. Vet. Res. 52(7):990-998.
18. CONSTABLE, P.D.; SCHMALL, L.M.; MUIR III, W.W.; HOFFSIS, G.F.; SHERTEL, E.R. 1991 b. Hemodynamic response of endotoxemic calves to treatment with small-volume hypertonic saline solution. Am. J. Vet. Res. 52(7):981-989.
19. CONSTABLE, P.D. 1991. Clinical assessment of renal tubular function through determination of electrolyte and creatinine concentrations. J. Vet. Intern. Med. 5(6):357-358.
20. CONSTABLE, P.D. 1993. Introduction to the ruminant forestomach. En: Howard J.L. Current Veterinary Therapy 3, Food Animal Practice, 3a ed. Philadelphia, W.B Saunders Company, p.706-711.
21. CONSTABLE, P.D.; GOHAR, H.M.; MORIN, D.E.; THURMON, J.C. 1996. Use of hypertonic saline-dextran solution to resuscitate hypovolemic calves with diarrhea. Am. J. Vet. Res. 57(1):97-104.
22. CONSTABLE, P.D. 1997a. A simplified strong ion model for acid-base equilibria: application to horse plasma. J. Appl. Physiol. 83(1):297-311.
23. CONSTABLE, P.D.; WALTER, P.G.; MORIN, D.E.; FOREMAN, J.H. 1998a. Clinical and laboratory assessment of hydration status of neonatal calves with diarrhea. J. Am. Vet. Med. Assoc. 212(7):991-996.
24. CONSTABLE, P.D.; HINCHCLIFF, K.W.; MUIR III, W.W. 1998b. Comparison of anion gap and strong anion gap as predictors of unmeasured strong ion concentration in plasma and serum from horses. Am. J. Vet. Res. 59(7):881-887.
25. CONSTABLE, P.D. 1999. Clinical assessment of acid-base status: Strong ion difference theory. Vet Clin. North Am, Food Anim. Pract. 15(3):447-471.
26. CONSTABLE, P.D. 2000. Clinical assessment of acid-base status: comparison of the Henderson-Hasselbach and strong ion approaches. Vet. Clin. Path (EEUU). 29(4):115-128.
27. CONSTABLE, P.D. 2002. Calculation of variables describing plasma nonvolatile weak acids for use in the strong ion approach to acid-base balance in cattle. Am. J. Vet. Res. 63(4):482-490.
28. CONSTABLE, P.D., 2003. Fluid and electrolyte therapy in ruminants. Vet Clin North Am. Food Anim. Pract. 19(3):557-597.
29. CONSTABLE, P.D.; STAEMPFLI, H.R. 2005. Experimental determination of net protein charge and A(tot) and K(a) of nonvolatile buffers in canine plasma. J. Vet. Intern. Med. 19(4):507-514.
30. CONSTABLE, P.D.; STAEMPFLI, H.R.; NAVETAT, H.; BERCHTOLD, J.; SCHELCHER, F. 2005. Use of a quantitative strong ion approach to determine the mechanism for acid-base abnormalities in sick calves with or without diarrhea. J. Vet. Intern. Med. 19(4):581-519.
31. CORKE, M.J. 1988. Economical preparation of fluids for intravenous use in cattle practice. Vet. Rec. (Reino Unido). 122(13):305-307.
32. EICHER, R.; LIESEGANG, A.; BOUCHARD, E.; TREMBLAY, A. 1999. Effect of cow-specific factors and feeding frequency of concentrate of diurnal variations of blood metabolites in dairy cows. Am. J. Vet. Res. 60(12):1493-1499.
33. EWASCHUK, J.B.; NAYLOR, J.M.; PALMER, R.; WHITING, S.J.; ZELLO, G.A. 2004. D-lactate production and excretion in diarrheic calves. J. Vet. Intern. Med. 18(5):744-747.
34. EWASCHUK, J.B.; NAYLOR, J.M.; ZELLO, G.A. 2005. D-lactate in human and ruminant metabolism. J. Nutrition (EEUU). 7(135):1619-1625.
35. FIGGE, J.; ROSSING, T.H.; FENCL, V. 1991. The role of serum proteins in acid-base equilibria. J. Lab. Clin. Med (EEUU). 117(6):453-467.
36. FIGGE, J.; MYDOSH, T., T.H.; FENCL, V. 1992. Serum proteins and acid-base equilibria: a follow up. J. Lab. Clin. Med. 120(5):713-719.
37. FIGGE, J.; JABOR, A.; KAZDA, A.; FENCL, V. 1998. Anion gap and hypoalbuminemia. Crit. Care Med. (EEUU). 26(11):1807-1810.
38. FLEMING, S.A.; HUNT, E.L.; RIVIERE, J.E.; ANDERSON, K.L. 1991. Renal clearance and fractional excretion of electrolytes over four 6-periods in cattle. Am. J. Vet. Res. 52(1):5-8.
39. FLEMING, S.A.; HUNT, E.L.; BORWNIE, C.; RAKES, A.; MCDANIEL, B. 1992. Fractional excretion of electrolytes in lactating dairy cows. Am. J. Vet. Res. 53(2):222-224.
40. GROVE-WHITE, D.H.; WHITE, D.G. 1993. Diagnosis and treatment of metabolic acidosis in calves: a field study. Vet. Rec. 133(20):499-501.
41. GROVE-WHITE, D.H.; MICHELL, A.R. 2001. Comparison of the measurement of total carbon dioxide and strong ion difference for the evaluation of metabolic acidosis in diarrhoeic calves. Vet. Rec. 148(12):365-370.
42. GUTZWILLER, A. 2000. Glucose and Galactose Absorption after Ingestion of Milk Containing Hydrolysed Lactose in Calves with diarrhea. J. Vet. Med. A. (Alemania). 47(8):495-500.
43. HALPERIN M.L.; GOLDSTEIN, M.B. 1999. Respiratory Acid-Base Disturbances. Fluid, Electrolyte, and Acid-Base Physiology. 3a Ed, Philadelphia, W.B. Saunders, p. 195-224.
44. KASARI, T.R.; NAYLOR, J.M., 1985. Clinical evaluation of sodium bicarbonate, sodium L-lactate, and sodium acetate for the treatment acidosis in diarrheic calves. J. Am. Vet. Med. Assoc. 187(4):392-397.
45. LUNN, D.P.; McGUIRK, S.M., 1990. Renal regulation and acid-base balance in ruminants. Vet. Clin. North Am. Food Anim. Pract. 6(1):1-28.
46. MCCULLOUGH, S.M.; CONSTABLE, P.D. 2003. Calculation of the total plasma concentration of nonvolatile weak acids and the effective dissociation constant of nonvolatile buffers in plasma for use in the strong ion approach to acid-base balance in cats. Am. J. Vet. Res. 64(8):1047-1051.
47. MICHELL, A.R.; BYWATER, R.J.; CLARKE, A.W.; HALL, L.W.; WATERMAN, A.E. 1991. Alteraciones del volumen y de la composición de los fluidos corporales. Fluidoterapia Veterinaria. 1a Ed. Edit. Acribia. p.23-42.
48. MULLOWNEY, P.C.; PATTERSON, W.H. 1985. Therapeutic agents used in the treatment of calf diarrhea. Vet. Clin. North Am. Food Anim. Pract. 1(3):563-581.
49. NAPPERT, G.; HAMILTON, D.; PETRIE, L.; NAYLOR, J.M. 1993. Determination of lactosa and xilosa malabsorption in prerruminant diarrheic calves. Can. J. Ve.t Res. 57(3):152-158.
50. NAPPERT, G.; NAYLOR, J.M. 2001. A comparison of pH determination methods in food animal practice. Can. Vet. J. 42(5):364-367.
51. NAYLOR, J.M., FORSYTH, G.W. 1986. The alkalinizing effects of metabolizable bases in the healthy calf. Can. J. Vet. Res. 50 (4):509-516.
52. NAYLOR, J.M. 1987a. Evaluation of the total carbon dioxide apparatus and pH meter for the determination of Acid-Base status in diarrheic and healthy calves. Can. Vet. J. 28(1,2):45-48.
53. NAYLOR, J.M. 1987b. Severity and nature of acidosis in diarrheic calves over and under one week of age. Can. Vet. J. 28(4):168-173.
54. NAYLOR, J.M. 1990. Oral fluid therapy in neonatal ruminants and swine. Vet. Clin. North Am. Food Anim. Pract. 6(1):51-67.
55. NAYLOR, J.M. 1992. Effects of electrolyte solutions for oral administration on clotting of milk. J. Am. Vet. Med. Assoc. 201(7):1026-1029.
56. NAYLOR, J.M. 1996. Neonatal ruminant diarrhea. En Smith, B.P.: Large Animal Internal Medicine, 2a Ed, St. Louis, Mosby, p.396-346.
57. NAYLOR, J.M.; LEÍBEL, T.; MIDDLETON, D.M. 1997. Effect of glutamine or glycine containing oral electrolyte solutions on mucosal morphology, clinical and biochemical findings, in calves with viral induced diarrhea. Can. J. Vet. Res. 61(1):43-48.
58. NAYLOR, J.M.; ZELLO, G.A.; ABEISEKARA, S. 2006. Advances in oral and intravenous fluid therapy, of calves with gastrointestinal disease. En: Memorias. XXIV World Buiatrics Congress 2006. Nice, Francia.
59. OH, M.S., KIM, H.J. 2002. Basic rules of parenteral fluid therapy. Nephron (Suiza). 92(Suppl. 1):56-59.
60. OKINE, E.K.; MATHISON, G.W.; KASKE, M.; KENELLY, J.J.; CHRISTOPHERSON, R.J. 1998. Current understanding of the role of the reticulum and reticulo-omasal orifice in the control of digesta passage from the ruminoreticulum of sheep and cattle. Can. J. Anim. Sci. 78:15-21.
61. OLCOTT, B. 1987. Desplazamiento del abomaso. En: Memorias, IV Seminario Internacional de Medicina Bovina, ACOVEZ, Santafé de Bogotá, D.C., Colombia, p.54-60.
62. OMOLE, O.O.; NAPPERT, G.; NAYLOR, J.M.; ZELLO, G.A. 2001. Both L- and D-lactate to metabolic acidosis in diarrheic calves. J. Nutr. 131(8):2128-2131.
63. PARKER, A.J.; HAMLIN, G.P.; COLEMAN, C.J.; FITZPATRICK, L.A. 2003. Quantitative analysis of acid-base balance in Bos indicus steers subjected to transportation of long duration. J. Anim. Sci. (EEUU). 81:1434-1439.
64. PHILLIPS, R.W. 1985. Fluid therapy for diarrheic calves: what, how, and how much. Vet. Clin. North Am. Food Anim. Pract. 1(3):541-562.
65. PRINGLE, J.K.; BERTHIAUME, L.M. 1988. Hypernatremia in calves. J. Vet. Intern. Med. 2(2):66-70.
66. PUSTERLA, N.; BRAUN, U. 1995a. Ultrasonographic evaluation of the jugular vein of cows with catheter-related thrombophlebitis. Vet Rec. 137(17) 431-434.
67. PUSTERLA, N.; BRAUN, U. 1995b. Ultrasonographic findings of perivascular jugular vein diseases in cattle. Tier?rztl. Prax. (Alemania) 23(4):360-362.
68. PUSTERLA, N.; BRAUN, U. 1996. Prophilaxis of intravenous catheter-related thrombophlebitis in cattle. Vet. Rec. 139(12):287-289.
69. RADOSTITIS, O.M.; MAYHEW, I.G.J.; HOUSTON, D.M. 2002. Elaborar un diagnóstico. En: O.M., RADOSTITIS; TYLER, J.W.; MAYHEW, I.G.. Examen y Diagnóstico Clínico en Veterinaria. 1a Ed, Madrid, Espa?a, Ediciones Harcourt, p.29.
70. RAGER, K.; HOUSE, J.K.; DEPETERS, E. 2002. Calf Nutrition. Comp. Cont Ed. Pract Vet. (supplement) (EEUU). 24(10):82-91.
71. RAMÍREZ, G.; BITTLE, P.A.; COLICE, G.L.; SANTACRUZ, R.; HIDALGO, A.; NOGUERA, I.; AGOSTI, S.J.; FOULIS, P.R. 1992. Blood biochemical characteristics of cattle at sea level and moderately high altitude (3,000 m). Am. J. Vet. Res. 53(4):547-550.
72. RODEHUTSCORD, M.; PAUEN, A.; WINDHAUSEN, P.; BRINTRUP, R.; PFEFFER, E. 1994. Effects of drastic changes in P intake on P concentrations in blood and rumen fluid of lactating ruminants. J. Vet. Med. A. 41(8):611-619.
73. ROUSSEL, A.J. 1983. Principles and mechanics of fluid therapy in calves. Comp. Cont. Ed. Pract. Vet. (suppl.). 5(6):332-340.
74. ROUSSEL, A.J. 1993. Fluid therapy transfusion, and shock therapy. En: Howard J.L. Current Veterinary Therapy 3, Food Animal Practice, 3a Ed., Philadelphia, W.B Saunders Co. p.1-8.
75. ROUSSEL, A.J.; TALIOFERRA, L.; NAVARRE, C.B. 1996. Cathetherization of the auricular vein in cattle: 68 cases (1991-1994). J. Am. Vet. Med. Assoc. 208(6):905-907.
76. ROUSSEL, A.J.; COHEN, N.D.; HOLLAND, P.S.; TALIAOFERRO, L.; GREEN, R.; BENSON, P.; NAVARRE, C.B.; HOOPER, R.N. 1998. Alterations in acid-base balance and serum electrolyte concentrations in cattle: 632 cases (1984-1994). J. Am. Vet. Med. Assoc. 212(11):1769-1775.
77. ROUSSEL, A.J. 1999. Fluid therapy in mature cattle. Vet. Clin. North Am. Food Anim Pract. 15(3):545-557.
78. SARGISON, N.; SCOTT, P. 1996. Supportive therapy of generalized endotoxaemia in cattle using hypertonic saline. In Practice (Reino Unido). Jan, p.18-19.
79. SCHOONDERWOERD, M.; DOIGE, C.E.; WOBESER, G.A.; NAYLOR, J.M. 1986. Protein energy malnutrition and fat mobilization in neonatal calves. Can. Vet. J. 27(10):365-371.
80. SIMPSON, D.F.; ERB, H.N.; SMITH, D.F. 1985. Base excess as a prognostic and diagnostic indicator in cows with abomasal volvulus or right displacement of the abomasum. Am. J. Vet. Res. 46(4):796-797.
81. STAEMPFLI, H.R.; PETRIE, J.P.; LUMSDEN, J.H., 1994. The weak acid concentration of plasma in Holstein calves. En: Abstract Proceedings VI Congress of the International Society for Animal Clinical Biochem. p.76.
82. STAEMPFLI, H.R.; CONSTABLE, P.D. 2003. Experimental determination of net protein charge and A(tot) and K(a) of nonvolatile buffers in human plasma. J. Appl. Physiol. 95(2):620-630.
83. STEWART, P.A., 1983. Modern quantitative acid-base chemistry. Can. J. Physiol. Pharmacol. 61(12):1444-1461.
84. THOMAS, L.A.; BROWN, S.A. 1992. Relationship between colloid osmotic pressure and plasma protein concentration in cattle, horses, dogs and cats. Am. J. Vet. Res. 53(12):2241-2244.
85. TORRES-MEDINA, A.; SCHAFLER, D.H.; MEBUS, C.A. 1985. Rotaviral and coronaviral diarrhea. Vet. Clin. North Am. Food Anim. Pract. 1(3):471-493.
86. TUCKER, W.B.; HARRISON, G.A.; HEMKEN, R.W. 1988. Influence of dietary cation-anion balance on milk, blood, urine, and rumen fluid in lactating dairy cattle. J. Dairy Sci. 71(2):346-354.
87. TYLER, J.W.; SCHUMACHER, J. 1992. Problem-oriented diagnostics, statistical inference, and clinical decisions. Comp. Cont. Ed. Pract. Vet. 14(7):1009-1015.
88. VERMOREL, M.; VERNET, J.; DARDILLAT, C.; SAIDO, DEMIGNE, C.; DAVICCO, M.J., 1989. Energy metabolism and thermoregulation in the newborn calf; effect of calving conditions. Can. J. Anim. Sci. 69:113-122.
89. VELÁSQUEZ P, J.M. 1993. Homeostasis acido básica en preparto y postparto. CORPOICA, Reg. 8 Villavicencio-Meta, Diciembre, p.29-52.
90. WALL, P.L.; NELSON, L.M.; GUTHMILLER, L.A. 1996. Cost effectiveness of use of a solution of 6% dextran in young calves with severe diarrhea. J. Am. Vet. Med. Assoc. 209(10):1714-1715.
91. WALKER, P.G.; CONSTABLE, P.D.; MORIN, D.E.; FOREMAN, J.H.; DRACKLEY, J.K.; THURMON, J.C. 1998. Comparison of hypertonic saline-dextran solution and lactated Ringer's solution for resuscitating severely dehydrated calves with diarrhea. J. Am. Vet. Med. Assoc. 213(1):113-121.
92. WHITEHAIR, K.J.; HASKINS, S.C.; WHITEHAIR, J.G.; PASCOE, P.J. 1995. Clinical applications of quantitative acid-base chemistry. J. Vet. Intern. Med. 9(1):1-11.
93. WILKES, P. 1998. Hypoproteinemia, strong-ion difference, and acid-base status in critically ill patients. J. Appl. Physiol. 84(5):1740-1748.
Recibido: Septiembre 18 de 2006; Aceptado: Agosto 9 de 2007

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.