CIENCIAS DE LA SALUD - Artículo Cient?fico
EVALUACIÓN DE LA ACTIVIDAD CRIOPROTECTORA DE DOS ALMIDONES DE YUCA SOBRE CÉLULAS MONONUCLEADAS DE SANGRE DE CORDÓN UMBILICAL
EVALUATION OF TWO MANDIOCA STARCHES AS CRIOPROTECTORS OF MONUCLEUS UMBILICAL BLOOD CORD CELLS
Bibiana Ortiz Trujillo1; Benjamín Ospino2; Miosotis Trujillo.3
1Profesional en Química Industrial, U.D.C.A, Carrera 55 No152-40 torre 4 apto 104. Correo electrónico:baibis2004@yahoo.com.ar
2Médico, Hospital Militar Central, Servicio Hematología especial,Correo electrónico:bospinoc@hotmail.com
3Bacterióloga y Profesora de Microbiología, Hospital Militar Central, laboratorio de Química Médica, Correo electrónico:mihos@colomsat.net.co
Rev. U.D.C.A Act. & Div. Cient. 10 (2): 125-133, 2007
RESUMEN
La presente investigación tuvo con fin evaluar la posibilidad de cambiar el hidroxietil almidón HES, crioprotector convencional, por dos clases de almidones de yuca producidos por una industria nacional. El estudio verificó la influencia de los almidones en la concentración de hidrogeniones del medio sanguíneo y su estabilidad en un ámbito que contiene enzimas amilasas y un alto contenido de células mononucleadas, como lo es la sangre de cordón umbilical. Por último, evaluó la viabilidad de las células mononucleadas seis meses después de una criopreservación con cada almidón a ?80?C, teniendo como patrón de comparación el HES. En los resultados, se observó que la sangre de cordón umbilical, fuera del organismo por 30 minutos, puede mantener el pH, aunque el valor se afecta más con los almidones de yuca que con el HES. A pesar de que el almidón es muy similar al HES, en cuanto a estructura molecular, éste es más resistente al ataque enzimático de las amilasas. En la última etapa, se corroboró que el HES mantiene una viabilidad celular del 70%, pero los almidones de yuca, por la influencia sobre la concentración de hidrogeniones, causan muerte celular y evitan la formación de cristales que lisan las células, pero disminuyen al pH a un valor letal para las células. Se concluyó que la amilopectina de los almidones de yuca, con algunas modificaciones en su estructura, como las del tipo hidroxietilación, puede llegar a funcionar como crioprotector para las células mononucleadas en medio sanguíneo, siempre y cuando se controle su baja modificación del pH.
Palabras clave:Crioprotección, hidroxietil almidón, almidón de yuca, reológicas.
SUMMARY
This research determined the possibility to change the hydroxyethyl starch (HES), conventional crioprotector, for two sorts of mandioca starches made by national industry. The study verified the influence of the mandioca starches on the hidrogenions amount in blood and confirmed the estability of starches in umbilical cord blood envelop and established its molecular stability inside a medium with amylases enzymes and mononuclear cells such as the umbilical cordon blood. The mononuclear cells viability six months after being criopreservated with each starch at ?80?C, using HES as a reference or standard, was also assessed. Results showed that the umbilical cord blood, outside the organism for 30 minutes is more affected by the mandioca starches than by HES. In spite of the similar structure of the mandioca starch and HES, the latter one is more resistant in the blood environment to the enzymatic attack of amylases because of its modified structure, therefore it is more resistance to withstand the blood conditions. It was corroborated that HES was able to keep the mononuclear cell viability over 70%, but mandioca starches did not, because of their influence on the pH which became lethal to cells. It was concluded, that the amilopectine of mandioca starches with some modifications in its molecular structure such as hydroxyethylation could work as a crioprotector for mononuclear blood cells, provided that the pH is controlled.
Key words:crioprotection, hydroxyethyl starch, mandioca starch, reologies.
INTRODUCCIÓN
Conforme a lo encontrado por Cuéllar & Falabella (2004), la sangre del cordón umbilical contiene células mononucleadas, entre las que se encuentran las células madre que se criopreservan, se cultivan y, finalmente, se utilizan en transplantes de médula ósea para pacientes con leucemia.
En el tema de criopreservación, los hallazgos de Ramman & Mohanty (2003) definen dos clases de procedimientos: uno, cuando la temperatura de criopreservación es de -80°C, donde se reduce la actividad metabólica y se pueden almacenar los tejidos por un a?o y, el segundo, si la temperatura de criopreservación es de -140°C, cuando se detiene toda actividad catalítica y se habla de preservación efectiva por varios a?os. En ambos procedimientos, la principal barrera que debe superar el proceso es la causada por el agua, por presentar una propiedad fisicoquímica especial, existente tanto en el plasma sanguíneo como en el interior celular. Su densidad en estado líquido es mayor que la densidad del sólido, de tal modo que la masa de agua sólida o congelada ocupa mayor volumen que en estado líquido. Murray & González (2004) ratifican que cuando el agua del plasma y del interior celular se congela, se forman cristales de gran tama?o capaces de romper y de lisar la célula, es decir, causar la muerte celular; sin embargo, cuando se disuelven solutos en el agua, el punto crioscópico disminuye, proporcionalmente, al número de moles de soluto agregado, sin formar estos cristales. De acuerdo con Thomas & Frances (2004) es importante escoger el soluto adecuado para disminuir el punto crioscópico sin alterar el equilibrio osmótico. Para evitar la formación de hielo sin alterar el equilibrio osmótico, se han usado anticongelantes, más conocidos como crioprotectores.
El crioprotector más utilizado es el dimetil sulfóxido (DMSO), un solvente con alto poder de penetración. Según los hallazgos de Galmes & Besalduch (2003) y más adelante el estudio de Shuyang & Woods (2004), se comprueba que el DMSO actúa entrando en la célula, aumentando la concentración de solutos intracelularmente y, de esta manera, descendiendo el punto crioscópico. Sin embargo, a nivel extracelular, no resultó tan efectivo, ya que al adicionar más dimetil sulfóxido para que funcione intra y extracelularmente, se aumenta la concentración de éste en el medio sanguíneo, lo cual conlleva a un efecto tóxico que hace que no todas las células sobrevivan a la criopreservación. Para solucionar este problema, como crioprotector extracelular, se ha venido utilizando el hidroxietil almidón (HES siglas en inglés hydroxyethyl starch). El HES es un almidón modificado de alto peso molecular, el cual se prepara a partir de un almidón ceroso (95% amilopectina), con grupos eterhidroxietil que incrementan la solubilidad en el agua, por la facilidad de la formación de puentes de hidrógeno; además, estos sustituyentes, evitan una hidrólisis enzimática rápida. Para Gallandat & Siemons (2000), el HES resulta ser un coloide sintético, que a diferencia de las soluciones de almidón naturales, las cuales son muy inestables en el plasma al ser rápidamente metabolizadas por las amilasas, permite retardar esta hidrólisis, confiriéndole una gran estabilidad a la solución en el tejido sanguíneo. Además, acorde con el análisis de Boldt & Haisch (2002), por su similitud molecular con el glucógeno, el HES no es tóxico.
Muchos investigadores han realizado diferentes estudios, con el objeto de aumentar la viabilidad durante la criopreservación. Una investigación realizada por Kehuan et al . (1994), en la cual las células de la médula ósea fueron criopreservadas en dos medios, uno con DMSO, HES y albúmina y el otro usando solo el DMSO y serina a ?196°C, por el término de un mes, reveló que la recuperación celular y la viabilidad es más alta en las células congeladas con HES, DMSO y albúmina, que utilizando solo el DMSO con serina. Después de ser criopreservadas, las células se cultivaron y las que más proliferaron fueron las criopreservadas en el primer medio. Los análisis de este estudio demuestran que el uso del HES reduce la aglutinación celular que se presenta solo con el DMSO y que la albúmina proporciona una gran estabilidad celular. Con el HES, albúmina y DMSO la viabilidad fue del 70%. También se concluyó que el papel de los crioprotectores no es solo prevenir el da?o durante el congelamiento sino también en los procesos de descongelamiento. El inconveniente del HES es que se trata de un producto costoso, no elaborado en Colombia y al ser importado, se eleva más su precio. Hasta el a?o 2006, no se han realizado otros estudios en los que se pretenda utilizar diferentes tipos de almidones como crioprotectores.
Dentro de los avances en la criopreservación, se destaca la investigación de criopreservación y de descongelación programada versus no programada. En este punto, sobresale el estudio de Solves & Larrea (2000), quienes realizaron una investigación, en la cual, muestras de sangre de cordón, divididas en dos grupos, se criopreservaron con protocolos distintos. El primer conjunto, se congeló a -80°C diminuyendo la temperatura a una velocidad controlada de 1°C/min y, el otro conjunto, se congeló sin programación a -80°C directamente en un congelador Koxka. Después de 24h, se pasaron ambas muestras a un tanque de nitrógeno líquido a ?180°C y a los siete días las muestras se descongelaron en ba?o de agua caliente a 37°C. Para las células congeladas con un proceso programado de congelación, la viabilidad fue del 71% y para las que siguieron una congelación no programada, la viabilidad fue del 69,5%. Los resultados difieren en 1,5%, por lo que no se justifica la criopreservación programada.
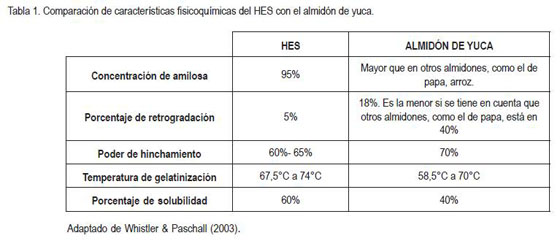
De las muchas clases de almidones existentes, el almidón de yuca manifiesta algunas características similares al HES en los comportamientos reológicos, es decir, por las características que presentan sus soluciones, posterior a la exposición a las altas presiones y temperaturas. Esto resulta relevante, ya que todos los crioprotectores, en el paso previo a la criopreservación, la esterilización, se someten a estas altas presiones y temperaturas. Un trabajo muy extenso sobre la reología de todas las clases de almidones, incluso almidones con modificaciones moleculares y donde se encuentra extensa información con énfasis en la retrogradación, fue el realizado por Whistler & Paschall (2003), hallando valores que prueban la similitud existente entre las características fisicoquímicas del almidón de yuca y el HES; éstos parámetros se incluyen en la tabla 1.

Dentro de los beneficios que traería utilizar el almidón de yuca como crioprotector esta el de costos. Mientras que 6g de HES en solución coloidal de 500ml cuestan alrededor de US$92, sin tener en cuenta los aranceles por la importación, 100g de almidón de yuca, sin preparación en su forma de solución coloidal, solo cuestan US$2. Otro beneficio es el fomento a las industrias almidoneras abundantes en Colombia, con un producto tradicional para una nueva finalidad, la de criopreservar, por lo que se tendría que producir bajo un mayor control de calidad. Además, no se han realizado estudios en lo que se pretenda utilizar otros almidones diferentes al HES como crioprotectores, por lo que esta investigación servirá de soporte para futuros trabajos en este tema (Van der Linden et al. 2005).
El objetivo del presente estudio fue determinar si el HES puede ser reemplazado por el almidón de yuca en su función como crioprotector, para lo cual se plantearon las siguientes hipótesis: la primera es que la sangre de cordón umbilical, aún fuera del organismo, debe poder amortiguar el pH al adicionarle los almidones de yuca, así como lo hace con el HES, en las concentraciones de 3% y 6%, porque sus estructuras moleculares son similares y la liberación de hidrogeniones no sería distinta; en segunda instancia, la degradación por el ataque de las alfa-amilasas de la sangre sobre los almidones de yuca, expuestos en los medios sanguíneos pasados 30 minutos a 14°C, no debería ser significativamente mayor a la degradación enzimática que sufre el HES. Y, finalmente, si los almidones de yuca al adicionarse a las muestras de sangre de cordón umbilical por un periodo de seis meses de criopreservación presentarían una viabilidad de las células mononucleadas superior o igual a la del HES; es posible que dichos almidones podrían actuar como crioprotectores extracelulares y la modificación molecular a través de la hidroxietilación no sería necesaria.
MATERIALES Y MÉTODOS
Para esta investigación, los almidones de yuca utilizados fueron preparados de manera exclusiva por Industrias del Maíz S.A., con dos referencias: la primera, 4704, la cual excluye de su proceso el paso de sulfitación que confiere conservación al almidón y protección contra bacterias, pero a su vez aumenta su toxicidad y el segundo, 160901, con un proceso de producción completo. Ambos almidones conservan las características fisicoquímicas de la variante de yuca expuesta anteriormente. El primer procedimiento de la investigación, se basó en el método potenciométrico descrito en Standard Methods for the Examination of Water and Wastewater; (American Public Health Association, 2003), para determinar el efecto de la adición de los almidones sobre el pH sanguíneo. Se utilizó un potenciómetro, previamente calibrado, marca E 516 Titriskop Metrohm Herisau, realizando las lecturas de pH para cada muestra. El procedimiento, se llevó a cabo por triplicado y los datos se sometieron al análisis estadístico, para determinar si las variables independientes, los tres diferentes almidones y las dos concentraciones, tienen efecto sobre la variable dependiente, el pH del medio sanguíneo. Se empleo el análisis de varianza, que requiere el estadígrafo F para determinar estadísticamente el efecto, puesto que la variación existente se presenta ya sea por el efecto de los tratamientos o por el efecto de los errores. Siguiendo este método estadístico, se halló por fórmula el F calculado, el cual se relacionó con el F tabulado, para conocer si hubo o no efecto (Castillo, 1998).
Las alfa-amilasas de la sangre humana hidrolizan el almidón, razón por la cual, en el segundo procedimiento de esta investigación, se buscó el almidón más resistente a la degradación enzimática en la sangre a temperatura ambiente (ya que las amilasas se inactivan durante la congelación). Para esta etapa, se fija como temperatura ambiente 14?C, que corresponde a la temperatura promedio de Bogotá, D.C, la cual se mantiene constante durante el a?o. Sin embargo, para evitar punto de variación, se utilizó la incubadora ajustada a esa temperatura. El procedimiento que se siguió fue el método de Somogy y para el manejo del espectrofotómetro, la técnica espectrofotométrica de Caraway (Faulkner & Meites, 1982). A los datos corregidos por mínimos cuadrados, se les aplicó el mismo modelo estadístico de la primera etapa, teniendo en cuenta que es una variable dependiente.
En la determinación, la viabilidad celular se aplicó la técnica de conteo de células en suspensión, publicada en el Manual de Laboratorio de Microbiología Básica de Bayona (1999). La técnica de criopreservación, se basó en la citada en el trabajo de Day & McLellan (2000). Para la comprobación de la viabilidad celular, se prepararon tres muestras de sangre de cordón umbilical con DMSO al 10%, con las tres diferentes soluciones de almidones, previamente esterilizadas, para una concentración final de 3% y dextrosa al 5%. Sin dejar las soluciones a temperatura ambiente, se llevaron al congelador a ?80°C durante seis meses. Pasado este periodo, las muestras se descongelan por ba?o a 37°C y se realizó conteo en la cámara de Neubauer. Se aplicó el mismo dise?o estadístico descrito anteriormente.
RESULTADOS Y DISCUSIÓNLa modificación de pH en el medio sanguíneo por adición de almidones es un resultado del cual no se tenía información previa, por lo tanto, no se puede comparar con investigaciones anteriores pero sí en relación al patrón HES, crioprotector por excelencia. La modificación del pH por adición de los dos almidones de yuca y la correspondiente variación por adición del HES, se muestran en la tabla 2. Por los valores obtenidos, se pudo apreciar que la sangre de cordón umbilical fuera del organismo ejerció un efecto buffer y controló la concentración de hidrogeniones que aportaron los almidones, debido a que contiene sales que contribuyen a regular el pH (Campbell & Farrel (2006). Sin embargo, se observó que con la adición de las soluciones de almidón al 6%, la lectura del pH marcó un valor que, bioquímicamente, está muy lejos del valor normal de pH en la sangre (Bishop & Fody, 2004); la concentración de 6% resultó ser nociva para las células sanguíneas, ya que generó problemas de acidosis. No sucedió ésto con la concentración de 3% del almidón 4704 y del HES; la modificación del pH se dio pero en menores proporciones. En esta primera etapa de la experimentación, se tuvo especial cuidado con el control del tiempo y la toma de lecturas, porque la sangre a mayor tiempo fuera del organismo y con la adición de sustancias se hemoliza, como lo mencionan Aulesa et al . (2002). Esto significa que los eritrocitos se rompen, se libera hemoglobina al plasma y así se pierde el equilibrio de hidrogeniones, afectando los valores de pH que varían drásticamente, luego de que ha ocurrido este fenómeno. Se controló el tiempo entre la adición de los almidones y la toma de las lecturas para evitar la hemólisis y asegurar que el efecto de la variación de pH se debiera únicamente al aporte de hidrogeniones de los almidones. Se comprobó que de los tres almidones, el HES es el que menos altera el pH por su estructura molecular, pues es un almidón modificado que se prepara a partir de la amilopectina de otros almidones, mediante la introducción de grupos hidroxietil éter a las unidades de glucosa. Específicamente, el HES presenta sustituyentes hidroxietilados (-O-CH2-CH2-OH) en los carbonos dos, tres y seis, a manera de ésteres. De esta manera, el efecto inductivo es menor en comparación con el del almidón natural y así al HES le es menos fácil ceder hidrogeniones al medio, con relación a los almidones de yuca y, por lo tanto, no acidifica el medio sanguíneo, como lo hacen los otros almidones.

El almidón 4704, en la concentración de 3%, disminuyó en muy baja proporción el pH, debido, probablemente, a que contiene más amilopectina que amilosa, es decir, tiene una estructura más acorde con la del HES, a pesar de no tener sustituyentes en las unidades de glucosa. Se concluyó, que la estructura de amilopectina afecta menos el pH del medio al que se le adiciona y, por ende, es más conveniente que la estructura de amilosa. Este factor podría ser clave para próximos estudios de criopreservación que se requieran hacer con otros polímeros, ya que las estructuras ramificadas, como la amilopectina, pudieran ser de alguna manera más inertes respecto al medio, que las estructuras lineales, como lo es la amilosa.
En la etapa final del estudio, se tuvieron muy en cuenta los cambios del pH, porque corresponden a un factor importante que influye sobre la viabilidad celular. Si se tiene un medio muy ácido o muy básico, las células que se encuentren en él mueren. Estadísticamente, se corroboró que la influencia en el pH fue dada por la concentración de almidón adicionado mas no por el tipo de almidón; lo anterior se pudo comprobar, al analizar únicamente la variación del pH respecto de la concentración de almidón adicionado. Para este caso, sí hubo diferencia estadísticamente significativa, ya que el F calculado correspondió a 12,7, mientras que el tabulado fue de 4,66. Los análisis de la variación del pH respecto de los tipos de almidón adicionados, sin tener en cuenta las concentraciones, no mostraron un efecto estadístico; el F calculado fue de 1,15 mientras que el tabulado fue de 4,1.
En la segunda etapa, la concentración inicial de los almidones en cada muestra de sangre, se calculó en 30000ppm. Ulterior a una exposición de 30 minutos a 14°C, se obtuvo una concentración final por encima de las 23000ppm para el HES y para los almidones de yuca, concentraciones por debajo de 20000ppm; esto se debió a que la sangre contiene enzimas del tipo alfa amilasas que degradan almidones (Higgins, 2007). Por lo tanto, el almidón más resistente a la degradación fue el HES, mientras que los almidones de yuca presentaron susceptibilidad a la degradación por las alfa amilasas en proporción mayor a la del HES.
Con el apoyo de los conocimientos consignados en la bioquímica de Stryer et al . (2003), se analizó el fenómeno llamado impedimento estérico que, para este caso, debido a los sustituyentes hidroxietilados en los carbonos dos, tres y seis que presentan las unidades de glucosa en el HES, hubo impedimento de acceso por parte del HES hacia la enzima alfa amilasa. Por esta razón, no se hidrolizó el HES con la misma velocidad con se hidrolizaron los otros almidones, ya que le fue difícil ingresar al enlace glucosídico entre los carbonos uno y cuatro de las unidades de glucosa del HES. En el caso de los almidones de yuca no hubo obstáculo a la alfa amilasa y se pudo realizar la hidrólisis sin impedimento estérico, puesto que no había sustituyentes. No se determinó la influencia de la resistencia a la degradación respecto de la efectividad en la criopreservación; esta etapa fue dise?ada para dar una orientación a los médicos del tiempo máximo, en el cual las muestras podrían estar a temperatura ambiente antes de ser llevadas al congelador. La idea principal es que no se formen grandes cristales de hielo, lo cual se puede conseguir mientras se tengan moléculas en el plasma que impidan este tipo de cristalización. A mayor volumen o tama?o de la molécula mayor distorsión en las condiciones para la formación de estos grandes cristales. Gracias a los trabajos sobre expansor de volemia de Entholzner et al . (2000), se sabe que las partes peque?as del HES son eliminadas por vía renal en 72 horas. Las moléculas más grandes son hidrolizadas por ?-amilasa sérica en moléculas más peque?as y después son eliminadas en orina, pero tiene una persistencia vascular de 12 horas con una disminución progresiva del efecto de volumen hasta las 24h. De acuerdo a lo anterior, se comprendió el por qué el HES tuvo una buena duración en el medio sanguíneo, lo que no sucedió con los almidones de yuca. En esta segunda etapa, se tomó la decisión de no exponer las muestras de sangre con los almidones a temperatura ambiente por más de 30 minutos, si no que se llevaron directamente al congelador. De nuevo, en el correspondiente soporte estadístico, se obtuvo como resultado que el F calculado es de 8,63 y el F tabulado fue de 3,27, indicando un efecto de esta variable, tipos de almidón, sobre la concentración de almidón remanente en el plasma; esto significa que el HES puede permanecer a temperatura ambiente dentro de la muestra de sangre sin que una inmediata congelación sea imperativa para evitar su degradación, mientras que para los almidones de yuca es indispensable la congelación inmediata si no la molécula se degrada y pierde su función. Esta prueba y análisis, no dise?ado para determinar la viabilidad celular, fue aplicado desde el punto de vista de utilidad del almidón como polímero que evitaría la formación de cristales de hielo. De hecho, no es recomendable dejar las muestras de sangre a temperatura ambiente por varios minutos antes de la congelación sin crioprotección, ya que hay diversos factores, como la precipitación celular, las secreciones celulares y los procesos de coagulación, que empiezan a influir en dicha viabilidad.
En la última etapa, la viabilidad de las células mononucleadas posterior a los seis meses de criopreservación a -80° C, reveló resultados que se ilustran en el gráfico 1. Para los almidones de yuca referencias 160901 y 4704, la viabilidad fue muy baja, menor al 10%, en comparación con la viabilidad obtenida con el HES. Kehuan et al . (1994) comprobaron que una criopreservación con HES, albúmina y DMSO a -140° C por seis meses arroja como resultado una viabilidad celular del 70%. En este estudio, a -80°C utilizando HES, DMSO y dextrosa, se obtuvo un resultado muy cercano, 68%, lo que no sucedió con los almidones de yuca. La interpretación de este resultado ligó la primera etapa de la experimentación con la última, es decir, la relación que tuvo la estabilidad del pH respecto de la viabilidad celular. Se observó cómo el HES presentó ventaja con relación a los otros almidones por su baja influencia en el pH del medio sanguíneo, indicando que los almidones de yuca crearon un medio ácido, lo cual generó mortandad celular y aunque pudieran impedir la formación de grandes cristales de hielo durante la criopreservación, no protegieron las células por la acidosis del medio. Sin embargo, en la primera etapa, el almidón de yuca 4704 al 3%, aciduló el medio solo 0,05 puntos más que el HES, lo cual hizo pensar que los resultados de porcentaje de células vivas criopreservadas, con este almidón, debieron ser similares a los del HES, pero no fue así.
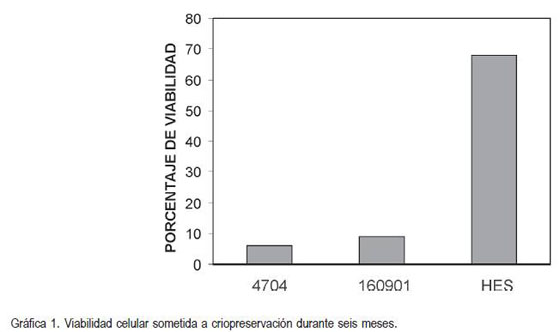
Como el almidón de yuca 4704 comparte factores estructurales con el HES, por poseer estructuras de amilopectinas en la concentración de 3% acidularon muy poco el medio sanguíneo, lo que condujo a plantear dos conclusiones: la primera, que el margen de diferencia en la modificación del pH del medio fue crítica, tan solo 0,05 puntos después de un valor de 7,35, ocasionó una mortandad celular, por la concentración de hidrogeniones. En segundo lugar, se corroboró la importancia de la hidroxietilación para que el almidón cumpliera con las condiciones de crioprotector. Los resultados obtenidos en la segunda etapa representaron una orientación para completar el procedimiento experimental de la tercera, sin afectarla. Las muestras no se dejaron a temperatura ambiente sino que se ingresaron rápidamente al congelador, antes que los almidones de yuca pudieran ser hidrolizados, de esta manera, el efecto sobre la viabilidad no estaría interferido por este factor.
Como el HES fue el único polímero que criopreservó un alto porcentaje de células vivas hasta el final del ensayo, se determinó que la influencia de la amilopectina de la yuca sobre el pH incidió directamente sobre la viabilidad de las células de manera crítica y directa. Del valor del pH sanguíneo normal, (7,4) solo se puede acidular 0,05, es decir, hasta 7,35 por ser éste el valor máximo de concentración de hidrogeniones tolerado por las células mononucleadas (Springhouse Publishing Company Staff, 2006). El análisis estadístico sirvió de base para esta conclusión: el F calculado fue de 30,77 mientras que el F tabulado fue de 4,1, lo cual que indicó que existió un efecto estadísticamente significativo de los tipos de almidón utilizados sobre la viabilidad celular.
CONCLUSIONES
Los almidones de yuca afectaron el pH de la sangre de cordón umbilical y no resistieron el ataque enzimático, por lo cual, no se consideran adecuados para criopreservar células mononucleadas de sangre de cordón umbilical.
Para estudios posteriores relacionados con el uso del efecto de polímeros sobre células en medio sanguíneo, se deben tener en cuenta varios elementos. El primero es que polímeros con estructuras ramificadas que puedan ceder hidrogeniones tienen menos interacción con el medio externo, lo cual es benéfico para las células, porque hay menos modificaciones de las condiciones y se afectaría en menor medida a las células. Una segunda conclusión es que el pH del medio sanguíneo es un parámetro crítico que afecta directamente la viabilidad de las células mononucleadas en la sangre de cordón umbilical. Una sugerencia es el empleo de otras soluciones, como buffers, que pueden ayudar al mantenimiento del pH en el medio sanguíneo para evitar la consecuente mortandad celular. Se evidenció también la importancia que el polímero tenga una estructura molecular con una configuración apropiada que genere impedimento estérico y así evitar su hidrólisis por parte de enzimas que se encuentren en el medio.
Se sugiere continuar con el estudio, buscando dise?os de procesos industriales para hidroxietilar los almidones de yuca, en las industrias de almidón. En las formas de producción que se excluyan pasos como del de la sulfitación y se corrijan factores para hacer del almidón de yuca un polímero que cumpla con las características de bajo nivel de toxicidad hacia las células y conserve la versatilidad para su uso, es decir, facilidad de esterilización y fluidez y, todo esto, sin perder la principal funcionalidad de un crioprotector, la de evitar la formación de grandes cristales de hielo.
AGRADECIMIENTOS
Los autores expresan su agradecimiento al Hospital Militar Central de Bogotá y al doctor Orlando Chaparro, Ph.D.
BIBLIOGRAFÍA
1. AMERICAN PUBLIC HEALTH ASSOCIATION. 2003. Standard methods for the examination of water, sewage, and industrial wastes. Ed. Am. Public Health Assoc., Am. Water Works Assoc., Fed. of Sewage and Industrial Wastes Assoc. (EEUU). 27p.
2. AULESA, C.; RUÍZ, G.; DURÁN, J. 2002. Estudio de la influencia de la hemólisis en un perfil básico de coagulación. Diagnóstico Biológico. (EEUU). 51(2).54-59.
3. BAYONA, M. 1999. Manual de Laboratorio de Microbiología Básica. Ed. Pontificia Universidad Javeriana, Facultad de Ciencias, Departamento de Microbiología, Colombia. p.67-70.
4. BISHOP, M.; FODY, E. 2004. Clinical Chemistry. Ed. Lippincott Williams & Wilkins. EEUU. 344p.
5. BOLDT, J.; HAISCH, G. 2002. Effects of a new modified, balanced hydroxyethyl starch preparation (Hextend®) on measures of coagulation. British J. Anaesthesia. 89(5):722-728.
6. CAMPBELL, M.; FARREL, S. 2006. Biochemistry. Ed. Thomson Brook/Cole. EEUU. 53p.
7. CASTILLO, J. 1998. Estadística Inferencial Básica. Ed Iberoamericana. México. p.340-345.
8. CUÉLLAR, F.; FALABELLA, F. 2004. Hematología. Corp. para Investig. Biológicas. Colombia. 29p.
9. DAY, J.; MCLELLAN, M. 2000. Cryopreservation and freeze-drying protocols. Ed. Humana Press. EEUU. p.235-250.
10. ENTHOLZNER, E.; MIELKE, L.; CALATZIS, A.; FEYTH, J.; HIPP, R.; HARGASSER, S. 2000. Coagulation effects of a recently developed hydroxyethyl starch (HES 130/0,4) compared to hydroxyethyl starches with higher molecular weight. Acta Anesthesiol. Scand. 44(11):16-21.
11. FAULKNER, W.R.; MEITES, S. 1982. Selected Methods for the Small Clinical Chemistry Laboratory. Edit. AACC. EEUU. p.165-174.
12. GALLANDAT, R.; SIEMONS, A. 2000. A novel hydroxyethyl starch (Voluven) for effective perioperative plasma volume substitution in cardiac surgery. J. Can. Anesthesia. 47(1):1207-1215.
13. GALMES, A.; BESALDUCH, J. 2003. Criopreservation of hemaropoietic progenitor cells with 5% dimethyl sulfoxide at ?80?C without rate-controlled freezing. J. Transfusion (EEUU). 36(9):794-797.
14. HIGGINS, C. 2007. Understanding laboratory investigations. Ed. Blackwell Publ. (EEUU). 172p.
15. KEHUAN, L.; GUANQING, W.; QILU, W.; YAN, S.; HUAIBIN, L. 1994. Effect of dimethylsulfoxide and hydroxyethyl starch in the preservation of fractionated human marrow cells. Cryobiology. (EEUU). 31(1):349-354.
16. MURRAY, R.; GONZÁLEZ P. 2004. Bioquímica El Manual Moderno. Ed. Iberoamericana. México. 125p.
17. RAMMAN, B.; MOHANTY, J. 2003. Enzimatic digestion a safe and rapid technique for individual separation of Macrobrachium rosenbergii embryos for cryopreservation studies. Cryobiology. 47(3):242-246.
18. SHUYANG, H.; WOODS, C. 2004. Effects of dimethylsulfoxide and glycine on cryopreservation induced damage of plasma membranes and mitochondria to striped bass sperm. Cryobiology. 48(3):254-262.
19. SOLVES, L.; LARREA, S. 2000. Processing and cryopreservation of placental/umbilical cord blood for unrelated bone marrow reconstitution. Nat. Acad. Sci. 92(2):10119-10122.
20. SPRINGHOUSE PUBLISHING COMPANY STAFF. 2006. Straigh as in Fluids and Electrolytes. Ed. Wlippincott Williams & Wilkins. EEUU. 61p.
21. STRYER, L.; BERG, J.; TYMOCZKO, J. 2003. Bioquímica. 5ed. Edit. Reverté. Espa?a. 687p.
22. THOMAS, M.; FRANCES, C. 2004. Bioquímica. Edit. Reverte. Espa?a. 205p.
23. VAN DER LINDEN, P.; DE HERT, G.S.; DERAEDT, D.; CROMHEECKE, S.; DE DECKE, K.; DE PAEP, R.; RODRIGUS, I.; DAPER, A.; TRENCHANT, A. 2005. Hydroxyethyl starch 130/0.4 versus modified fluid gelatin for volume expansion in cardiac surgery patients: The effects on perioperative bleeding and transfusion needs. Internal. Anesthesia Res. Soc. EEUU. 2005(101):629-634.
24. WHISTLER, R.; PASCHALL, E. 2003. Starch chemistry and technology fundamental aspect. Edit. Academic Press. p.70-105.
Recibido:Agosto 29 de 2006; Aceptado: Octubre 31 de 2007

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.