CIENCIAS AGRARIAS-Artículo Científico
GERMINACIÓN DE SEMILLAS DE MORINGA (Moringa oleifera Lam.) EN DIFERENTES TIEMPOS DE IMBIBICIÓN EN AGUA
GERMINATION OF MORINGA SEEDS (Moringa oleifera Lam.) IN DIFFERENT WATER IMBIBITION TIMES
Fernando Barraza A.1
1 Ingeniero Agrónomo, M.Sc. Horticultura, Ph.D. Horticultura, Profesor investigador, Facultad de Ciencias Agrícolas, Departamento de Ingeniería Agronómica y Desarrollo Rural, Grupo de investigación Agricultura Sostenible. Universidad de Córdoba, carrera 6 No. 76-103, Montería, Colombia, e-mail: fbarraza@correo.unicordoba.edu.co
Rev. U.D.C.A Act. & Div. Cient. 20(1): 71-77, Enero-Junio, 2017
RESUMEN
La siembra del cultivo de moringa con semillas gámicas tiene ventajas sobre la propagación vegetativa con estacas, por la buena disponibilidad de semillas, rapidez en la fase de semillero, facilidad de trasplante, economía en las labores y mejor anclaje definitivo; sin embargo, se ha reportado que las semillas maduras presentan bajo porcentaje de germinación, por lo cual, se hizo una investigación en la Universidad de Córdoba, Colombia, con el objetivo de establecer el efecto de la imbibición de semillas en agua sobre el porcentaje de germinación. Se hizo un bioensayo con semillas extraídas de un árbol de un año de edad, sembrado en el campo experimental de cultivos de hortalizas. El diseño experimental utilizado fue completamente al azar y se aplicaron tres tratamientos: semillas embebidas en agua 24h, semillas embebidas en agua 48h y semillas embebidas en agua 72h, teniendo como testigo semillas sin imbibición en agua. Los datos de porcentaje de germinación PG se ajustaron al modelo logístico y se obtuvieron la velocidad absoluta de germinación VAG y velocidad relativa de germinación VRG. De acuerdo con los resultados, se estableció que, a mayor tiempo de imbibición de las semillas, se disminuyó el porcentaje de germinación, desde 66 hasta 29% y la velocidad absoluta de germinación, desde 29 semillas∙día-1 hasta 7 semillas∙día-1.
Palabras clave: Imbibición en agua, modelo logístico, germinación.
SUMMARY
Sowing of the moringa crop with gamic seeds has advantages over vegetative propagation with stakes due to the good availability of seeds, rapidity in the nursery phase, ease of transplantation, economy in the work and best definitive anchorage. However, it has been reported that mature seeds have a low percentage of germination, therefore a research was made at the Universidad de Córdoba, Colombia, with the objective of establishing the effect of the imbibition of seeds in water on germination percentage. A bioassay with seeds extracted from a one year old tree, planted in the experimental field of vegetable crops was carried out. The experimental design used was completely randomized and three treatments were applied, seed imbibition in water during 24h, seed imbibition in water during 48h and seed imbibition in water during 72h having as control seeds without imbibition in water. The germination percentage GP data were adjusted to the logistic model and the absolute rate of germination ARG and relative rate of germination RRG were obtained. According to the results it was established that the GP decreased at a longer seed imbibition time and AGR decreased from 29 seeds∙day-1 to 7 seeds∙day-1.
Key words: Imbibition in water, logistic model, germination.
INTRODUCCIÓN
Moringa oleífera es nativa del sur del Himalaya. Se ha introducido y cultivado en Bangladesh, en Afganistán, en Pakistán, en Sri Lanka, en el sureste asiático, en Asia occidental, en Península Arábica, en África del este y oeste, en Madagascar, en el sur de Florida, en Islas del Caribe, en América Central, en América del Sur, como por ejemplo en Venezuela (Falasca & Bernabé, 2009); en algunos casos, como en Brasil y en Nicaragua, se introdujo como ornamental. En Cuba tiene uso como poste vivo en cercados y se considera promisoria en la alimentación de ganado, por medio de pastoreo de corte. En la actualidad, se ha valorado en muchos países del mundo, porque diferentes partes de la planta contienen minerales, proteínas, vitaminas, beta-caroteno, aminoácidos y compuestos fenólicos, que le confieren importancia alimenticia, medicinal e industrial (Padilla et al. 2012).
De acuerdo con Del Toro et al. (2011), moringa se adapta a las condiciones climatológicas y de suelos de la región Caribe colombiana y conserva e, incluso, supera las propiedades nutricionales de origen, lo que permite considerarla como planta con un potencial importante.
La propagación de moringa, según Pérez et al. (2010), se puede realizar de manera sexual, con semillas gámicas y, vegetativamente, con estacas. Mediante este método, las plantas presentan menor cantidad de raíces y con patrón de distribución fasciculado, lo que las hace propensas a ser derribadas por el viento y pueden presentar estrés por sequía y menor toma de nutrimentos del suelo (Bernal et al. 2013).
Según Pérez et al. (2010), la forma más utilizada para propagar moringa es la sexual, especialmente, cuando el objetivo es la producción de forraje, ya que, además de investigadores, industriales y agricultores, la planta ha atraído la atención de ganaderos, como alternativa sostenible y de gran importancia ecológica, para implementar bancos proteicos, porque, de acuerdo con Ramos et al. (2015), posee óptimas características nutricionales y de digestibilidad.
Mubvuma et al. (2013) indicaron que las semillas de moringa tienen bajo porcentaje de germinación y Nouman et al. (2012), señalaron que puede fluctuar entre 60 y 90%, por lo que una necesidad prioritaria de investigación es la búsqueda de estrategias para aumentar la germinación y así mejorar el proceso de establecimiento del cultivo.
De acuerdo con lo anterior, se han ensayado tratamientos para vigorizar las semillas entre los que se encuentran acondicionamiento osmótico, cebado hormonal, endurecimiento, imbibición en extracto de hojas de moringa e imbibición en agua (Nouman et al. 2012).
El objetivo de la presente investigación fue determinar el efecto que tiene la imbibición de semillas de moringa en agua sobre el porcentaje de germinación, velocidad absoluta de germinación y velocidad relativa de germinación.
MATERIALES Y MÉTODOS
La investigación, se realizó entre el 29 de octubre y el 27 de noviembre de 2015, en la Universidad de Córdoba-Montería, Colombia, ubicada a 08°49' latitud Norte y 75°51' longitud Oeste, con temperatura anual promedio de 28°C, humedad relativa de 78%, 1.249mm de precipitación anual y altitud de 25msnm. Se hizo un bioensayo de germinación en el laboratorio de fisiología vegetal de la facultad de ciencias agrícolas, con semillas de moringa, recolectadas manualmente de las vainas secas de un árbol de un año de edad, sembrado en el campo experimental de cultivos de hortalizas.
Se utilizó diseño completamente al azar, con cuatro repeticiones y tres tiempos de imbibición de semillas de moringa en agua, a temperatura ambiente 22°C: 24, 48 y 72h, con testigo de semillas sin imbibición. La unidad experimental consistió en una placa petri de vidrio de 90mm de diámetro, en donde se dispusieron, en cada una, 25 semillas de moringa, en patrón circular, sobre papel filtro, humedecido con 25mL de agua destilada estéril, de acuerdo con lo establecido por ISTA (2014). Cada tercer día, se aplicaron 5mL de agua destilada estéril a las placas petri. En total, se utilizaron 16 unidades experimentales y 100 semillas por tratamiento, lo que correspondió a 400 semillas para el bioensayo. Las variables evaluadas fueron: porcentaje de germinación (PG), velocidad absoluta de germinación (VAG) y velocidad relativa de germinación (VRG).
Porcentaje de germinación (PG). Se hizo el conteo diario de semillas con emergencia de radícula y se utilizó la ecuación propuesta por Nouman et al. (2012):
PG=(NSR/NSG)*100
donde:
NSR: número de semillas con emergencia de radícula
NSG: número de semillas colocadas a germinar
Para conocer el comportamiento inicial de los datos de PG, se utilizó el software Curve Expert versión 1.3 (Hyams, 2003). Por las características de la información obtenida, se seleccionó el modelo logístico para realizar el ajuste, de acuerdo con lo indicado por Calvo et al. (1994):
y=A/(1+B*e-Cx)
donde:
y: porcentaje de germinación (PG) A: máximo valor observado en PG
B: no tiene significado biológico y solo toma lugar en el tiempo inicial x=: 0
x: tiempo (días) después de colocadas a germinar las semillas
C: parámetro relacionado con el valor de x para el punto de inflexión
e: constante matemática base del logaritmo natural =2,718281828
Para establecer la aproximación de los datos experimentales a los modelos logísticos obtenidos, se hizo el cálculo del coeficiente de determinación R2: proporción de la variabilidad presente en los datos experimentales, que es explicada por el modelo de análisis de la varianza, mediante la siguiente ecuación:
R2=SCt/SCT
donde:
SCt = suma de cuadrados de los tratamientos
SCT= suma de cuadrados total
Velocidad absoluta de germinación (VAG). Se calculó como la primera derivada del modelo logístico y', de acuerdo a lo indicado por Calvo et al. (1994):
y'=(A*B*C*e-Cx)
Velocidad relativa de germinación (VRG). Se calculó, según lo indicado por Calvo et al. (1994), mediante la ecuación:
VRG=VAG/PG
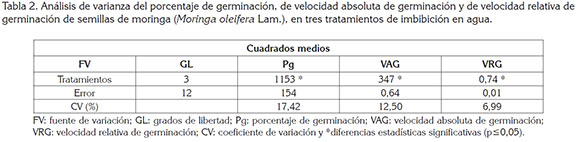
A los datos de PG, VAG y VRG, se les hizo análisis de regresión no lineal, mediante el procedimiento PROC NLIN; análisis de varianza, mediante el procedimiento PROC ANDEVA y pruebas de comparación de medias de Tukey (p ≤ 0,05), con el software SAS versión 9.1.3 (SAS Institute, 2008).
RESULTADOS Y DISCUSIÓN
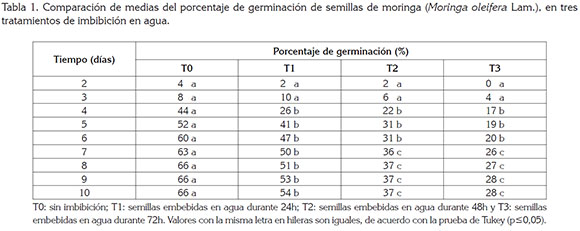
Porcentaje de germinación (PG). Como se observa en la tabla 1, la germinación inició a los dos días después de colocadas las semillas a germinar, lo que estuvo en concordancia con lo reportado por Mubvuma et al. (2013) y Medina et al. (2007), en el sentido de que las semillas de moringa pueden germinar rápidamente una vez son sembradas y encuentran las condiciones necesarias para la germinación. A los 2 y 3 días no hubo diferencias estadísticas entre tratamientos y desde los 4 hasta 10 días, los tratamientos T1, T2 y T3 fueron estadísticamente iguales entre sí y diferentes al tratamiento T0 que, de acuerdo con las tablas 1 y 2, tuvo mayor PG, el cual, estuvo cercano a los valores reportados por Toral et al. (2013), para las accesiones PKM-1 68%, Criolla-Granma 68%, Supergenius 69% y se halla por debajo de los valores indicados para las accesiones Plain 84%, Holguín-Mayarí 80% y Matanzas 78%.

En la tabla 3, se observa que los datos de porcentaje de germinación obtenidos se ajustaron al modelo logístico, lo que coincidió con lo indicado por Bezerra et al. (2004) y Valdés et al. (2014).

Teniendo en cuenta los resultados obtenidos, la imbibición de semillas de moringa en agua durante 24, 48 y 72h tuvo efectos negativos sobre el PG, que descendió para T1, T2 y T3, con respecto a T0, en 18, 42 y 56%, respectivamente.
Por lo anterior, es posible considerar que las semillas, como organismos vivos, se vieron afectadas, ya que con la práctica de remojo en agua, según Eilert et al. (1981), muchas semillas aceleran su germinación cuando se embeben por 8h, pero por periodos de 24h o más, con el exceso de agua, se pueden liberar sustancias inhibidoras de la germinación, como terpenos, lectinas, saponinas, metabolitos secundarios polifenólicos y alcaloides con actividad tóxica, de acuerdo con lo indicado por Igwilo et al. (2013) y Rabbani et al. (2013). Al respecto, estudios de Njehoya et al. (2014) muestran que, con remojo de semillas en agua durante 12 horas, se pudo alcanzar 90% de germinación, mientras que con remojo durante 24 y 36 horas, se obtuvo solo el 15%.
Velocidad absoluta de germinación (VAG). En la figura 1, se observa que la VAG aumentó hasta alcanzar valores máximos y, posteriormente, descendió a valores cercanos a cero, lo que correspondió a un comportamiento gráfico de distribución normal en forma de campana, que concuerda con lo indicado por Moravec et al. (2008) y Hegazi (2015).
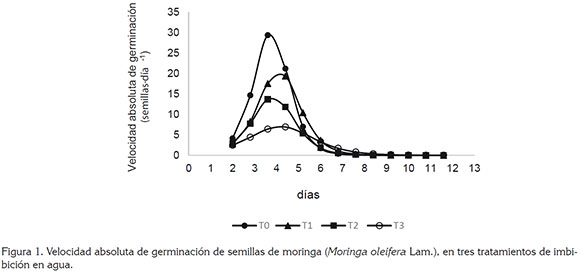
En la tabla 1 y figura 1, se observa que desde los 3 hasta 5 días, el tratamiento T0 fue estadísticamente superior a los tratamientos T1, T2 y T3 y obtuvo la mayor VAG, a los 4 días. El tratamiento T3 presentó menores valores de VAG, con respecto a los demás tratamientos.
El efecto negativo observado sobre la VAG, por efecto de la imbibición de semillas en agua durante diferentes tiempos, puede estar relacionado con lo indicado por Alves et al. (2005), en cuanto a que el proceso de germinación se vio afectado en el nivel crítico de hidratación, necesario para reactivar el metabolismo y producir el crecimiento embrionario, ya que la evolución del proceso de imbibición, a través del tiempo, afecta las diferentes fases de la germinación y, de acuerdo con Moravec et al. (2008), la imbibición de las semillas de moringa ocurre rápidamente durante las primeras tres horas después de la siembra, ya que los tejidos de lascubiertas son altamente permeables al agua y puede ocurrir sofocación del embrión o disminución de oxígeno.
Velocidad relativa de germinación (VRG). Como se observa en la figura 2, a partir de los 2 días, la VRG tuvo valores máximos, que presentaron disminución en su magnitud hasta alcanzar valores cercanos a cero, cuya trayectoria gráfica coincidió con lo reportado por Ferreira et al. (2011). Se presentaron diferencias estadísticas entre tratamientos y se encontró que tratamiento testigo T0 mostró a los 2 días mayor VRG, en relación a los tratamientos T1, T2 y T3, como se observa en la tabla 1, lo que muestra, según Ferreira et al. (2011), que las semillas de M. oleifera sin tratamiento de imbibición en agua no presentaron daños en su estado fisiológico, con respecto a las semillas embebidas en agua, permitiendo que su vigor de germinación se pudiera expresar, a través de un mayor porcentaje de germinación y a una velocidad más rápida, en comparación con los tratamientos con imbibición en agua.
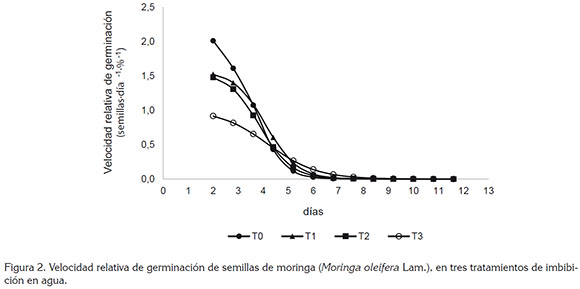
Desde los 6 hasta los 10 días no se presentaron diferencias estadísticas entre tratamientos, lo que indica que al inicio del proceso de germinación los tratamientos T1, T2 y T3 pudieron alcanzar valores de VRG iguales o superiores a los de T0, pero que funcionalmente las semillas estuvieron afectadas en la velocidad con que ocurrió el proceso de germinación, según los tratamientos, ya que la imbibición en agua pudo haber provocado daños irreversibles que, de acuerdo con lo indicado por Rabbani et al. (2012), se evidencian, a través de respuestas bioquímicas, que alteran la respiración y la estructura física de las membranas celulares, lo que modifica la tasa de hidratación, de liberación de enzimas, de transporte iónico, pH y contenido de inhibidores de la germinación.
Además de lo anterior, es importante señalar que, de acuerdo con Animashaun & Toye (2013) y Hegazi (2015), las semillas de moringa tienen una excelente y rápida capacidad de propagación durante largos periodos de sequía, con lo cual, es posible considerar que la imbibición en agua aumentó la velocidad de asimilación de agua por parte de las semillas que, cuando es rápida en esta especie, de acuerdo con lo indicado por Gomaa y Picó (2011), Ferreira et al. (2011) y Rabbani et al. (2013), puede ocasionar fallas en membranas celulares, daños en la activación de enzimas responsables de liberar ATP, con lo que se pudo afectar el PG y la VRG.
Conflicto de intereses: El manuscrito fue preparado y revisado por el autor, quien declara que no existe conflicto de intereses que ponga en riesgo la validez de los resultados presentados. Financiación: Este estudio fue financiado por la Universidad de Córdoba.
BIBLIOGRAFÍA
1. ALVES, M.; FILHO, S.; BEZERRA, A.; OLIVEIRA, V. 2005. Germinação de sementes e desenvolvimento de plântulas de Moringa oleifera L. em diferentes locais de germinação e submetidas à pré-embebição. Ciênc. Agrotec. (Brasil). 29(5):1083-1087.
2. ANIMASHAUN, J.; TOYE, A. 2013. Feasibility analysis of leaf-based Moringa oleifera plantation in the nigerian Guinea savannah: case study of University of Ilorin moringa plantation. Agrosearch. 13(3):218-231.
3. BERNAL, M.; OQUENDO, G.; SUÁREZ, M.; RODRÍGUEZ, E.; VELA, O. 2013. Evaluación del marco de siembra de Moringa oleifera Lam. Agr. Org. 19(2):23-27.
4. BEZERRA, A.; MOMENTÉ, V.; FILHO, S. 2004. Germinação de sementes e desenvolvimento de plântulas de moringa (Moringa oleifera Lam.) emfunção do peso da semente e do tipo de substrato. Hortic. Bras. 22(2):295-299.
5. CALVO, R.; GONZÁLEZ, J.; PÉREZ, S. 1994. Manual de modelos no lineales en los ámbitos agronómico, ganadero y forestal. Ministerio de Agricultura, Pesca y Alimentación. Instituto Nacional de Investigación y Tecnología Agraria y Alimentaria. Madrid, España.110p.
6. DEL TORO, J.; CARBALLO, A.; ROCHA, L. 2011. Valoración de las propiedades nutricionales de Moringa oleifera en el departamento de Bolívar. Rev. de Cienc. (Colombia). 15:23-30.
7. EILERT, U.; WOLTERS, B.; NAHRSTEDT, A. 1981. The antibiotic principle of seeds of Moringa oleifera and Moringa stenopetala. J. Medic. Pl. Res.42:55-61.
8. FALASCA, S.; BERNABÉ, M. 2009. Zonificación agroclimática de la moringa (Moringa oleifera) en Argentina para producir biodiesel y bioetanol. Av. en Energ. Renov. y M. Amb. (Argentina). 13:65-70.
9. FERREIRA, A.; ROUSE, A.; SILVA, R.; FERREIRA, R.; SOUZA, A. 2011. Water pre-hydration as priming for Moringa oleifera Lam. seeds under salt stress. Trop. and Subtrop. Agroec. (México). 14(1):201-207.
10. GOMAA, N.; PICÓ, X. 2011. Seed germination, seedling traits, and seed bank of the tree Moringa peregrine (moringaceae) in a hyper-arid environment. Amer. J. Bot. 98(6):1024-1030.
11. HEGAZI, M. 2015. Influence of soil type, sowing date and diluted seawater irrigation on seed germination, vegetation and chemical constituents of Moringa oleifera Lam. J. Agr. Sci. (Canadá).7(3):138-147.
12. HYAMS, D. 2003. Curve Expert 1.3. A comprehensive curve fitting system for Windows©. USA.
13. IGWILO, I.; OGOKE, T.; OGBU, D.; IGWILO, E.; ABDUL- SALAMI, M. 2013. Effect of soaked Moringa oleifera seeds on growth rates and the levels of some biochemical parameters in albino rats. Pakistan J. Biol. Sci. 16(1):48-50.
14. INTERNATIONAL SEED TESTING ASSOCIATION – ISTA-. 2014. Rules proposals for the international rules for seed testing. Executive Committee. Bassersdorf, Switzerland.53 p.
15. MEDINA, M.; GARCÍA, D.; CLAVERO, T.; IGLESIAS, J. 2007. Estudio comparativo de Moringa oleifera y Leucaena leucocephala durante la germinación y la etapa inicial de crecimiento. Zootec. Trop. 25(2):83- 93.
16. MORAVEC, C.; BRADFORD, K.; LACA, E. 2008. Water relations of drumstick tree seed (Moringa oleifera): imbibition, desiccation, and sorption isotherms. Seed Sci. & Technol. (EE.UU). 36:311-324.
17. MUBVUMA, M.; MAPANDA, S.; MASHONJOWA, E. 2013. Effect of storage temperature and duration on germination of moringa seeds (Moringa oleifera). Greener J. Agr. Sci. 3(5):427-432.
18. NJEHOYA, C.; BOUROU, S.; AWONO, K.; BOUBA, H. 2014. Évaluation du potentiel de germination de Moringa oleifera dans la zone soudano-guinéenne du Cameroun. J. Appl. Biosci. 74:6141-6148.
19. NOUMAN, W.; SIDDIQUI, M.; BASRA, S.; AFZAL, I.; REHMAN, H. 2012. Enhancement of emergence potential and stand establishment of Moringa oleifera Lam. by seed priming. Turk. J. Agric. For. 36:227-235.
20. PADILLA, C.; FRAGA, N.; SUÁREZ, M. 2012. Effect of the soaking time of moringa (Moringa oleifera) seeds on the germination and growth indicators of the plant. Cuban J. Agr. Sci. 46(4):419-421.
21. PÉREZ, A.; SÁNCHEZ, T.; ARMENGOL, N.; REYES, F. 2010. Características y potencialidades de Moringa oleífera Lamark. Una alternativa para la alimentación animal. Pastos y For. (Cuba). 33(4):1-16.
22. RABBANI, A.; MANN, R.; FERREIRA, R.; PESSOA, A.; BARROS, E.; MESQUITA, J. 2012. Restrição hídrica em sementes de moringa (Moringa oleifera L.). Rev. Cient. UDO Agr. (Venezuela). 12(3):563-569.
23. RABBANI, A.; SILVA, R.; FERREIRA, R.; VASCONCELOS, M. 2013. Pré-embebição em sementes de moringa. Sci. Plena (Brasil).9(5):1-8.
24. RAMOS, O.; CASTILLO, J.; SANDOVAL, J. 2015. Efecto de intervalos y alturas de corte en la productividad forrajera de Moringa oleifera. Rev. Bio Cienc. (México). 3(3):187-194.
25. SAS INSTITUTE INC. 2008. Statistical analysis system. The SAS© system for Windows© version 9.1.3. The Power to Know. Cary, NC, EEUU.
26. TORAL, O.; CEREZO, Y.; REINO, J.; SANTANA, H. 2013. Caracterización morfológica de ocho procedencias de Moringa oleifera (Lam.) en condiciones de vivero. Pastos y For. (Cuba). 36(4):409-416.
27. VALDÉS, O.; MUÑOZ, C.; PÉREZ, A.; MARTÍNEZ, L. 2014. Análisis y ajuste de curvas de crecimiento de Moringa oleifera Lam. en diferentes sustratos. Rev. Cien. Biol. Agrop. Tuxpan. 2(2):66-70.
Recibido: Junio 15 de 2016 Aceptado: Febrero 18 de 2017

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.