Artículo Científico
FOTOSENSIBILIZACIÓN DE TiO2 CON UN COLORANTE COMERCIAL PARA FOTODEGRADACIÓN DE CONTAMINANTES ORGÁNICOS EN AGUA
TiO2 PHOTOSENSIBILIZATION WITH A COMMERCIAL DYE FOR PHOTODEGRADATION OF ORGANIC WATER POLLUTANTS
Juliana Leguizamón1,César Quiñones2, Hilda Espinosa3, Víctor Sarria4
1 Ing. Químico. Grupo de Materiales Fotoactivos, Universidad de América. Bogotá, Colombia. julilegui@gmail.com
2Dr. Sc. Universidad de Nacional, Bogotá, Colombia. cesarquinoness@unal.edu.co
3Ing. Químico. Grupo de Materiales Fotoactivos, Universidad de América. Bogotá, Colombia. Hilda.espinosa@profesores.edu.co, hilespq888@gmail.com
4Ph.D. en Química. Departamento de Química, Universidad de Los Andes. Bogotá, Colombia vsarria@uniandes.edu.co
Rev. U.D.C.A Act. & Div. Cient. 13 (2): 185-190, 2010
RESUMEN
En este estudio, se exploró la fotosensibilización del semiconductor TiO2, mediante un colorante comercial, con el objeto de aumentar sus propiedades catalíticas. Se evaluaron los siguientes parámetros: la concentración de colorante, el tiempo de sensibilización del semiconductor, la cantidad de moles de colorante adsorbidas sobre el semiconductor y el corrimiento de la absorción de la radiación del catalizador modificado hacia la región del espectro visible. Finalmente, se realizaron pruebas de la actividad fotocatalítica del catalizador modificado en la degradación del contaminante modelo (fenol). Se obtuvo una eficiencia de remoción de 33,85% de la concentración inicial de fenol, comparada contra 18,98% usando TiO2 sin modificar. La fotosensibilización del TiO2 con colorantes comerciales aparece como una alternativa técnica y económicamente viable, para incrementar las propiedades fotocatalíticas del TiO2.
Palabras clave: TiO2, sensibilización, ftalocianinas, azul directo 199.
SUMMARY
In this study, the photosensitization of TiO2 semiconductor with a commercial dye in order to increase its catalytic properties was explored. The following parameters were evaluated: the dye concentration used on the sensitization, the semiconductor sensitization time, the amount (unit: mol) of the dye, adsorbed on the semiconductor and the radiation absorption shift on the modified catalyst towards the visible spectrum region. Finally, the photocatalytic activity of the modified catalyst through the degradation of a pollutant model (phenol) was tested. A removal efficiency of 33.85 per cent of the initial concentration of phenol, compared to 18.98 per cent using unmodified TiO2 was obtained. Photosensitization of TiO2 with commercial dyes appears to be a technically and economically feasible alternative, which can be adopted as an option to increase the photocatalytic properties of TiO2.
Key words: TiO2, sensitization, phthalocyanines, direct blue 199.
INTRODUCCIÓN
El dióxido de titanio (TiO2), actualmente, es el material más utilizado para fotocatálisis en aplicaciones ambientales y un óxido metálico semiconductor con propiedades fotocatalíticas, cuando es excitado con luz ultravioleta (Rango de longitud de onda = 300 - 400nm) (Chatterjee, 2005). Cuando incide la radiación UV sobre una partícula de TiO2, los fotones de energía superior a la de su ancho de banda (diferencia energética entre las bandas de conducción y de valencia, Eg) son absorbidos por él mismo. Con una probabilidad bastante alta, estos fotones ceden su energía a los electrones situados en la banda de valencia (BV) y, una vez excitados, tienen energía cinética suficiente como para ocupar un estado energético de la banda de conducción (BC). De esta forma, se crean pares de electrón (e-) y hueco (h+) sobre la superficie del semiconductor, hallándose los primeros en la banda de conducción y los segundos en la banda de valencia (Chatterjee, 2005).
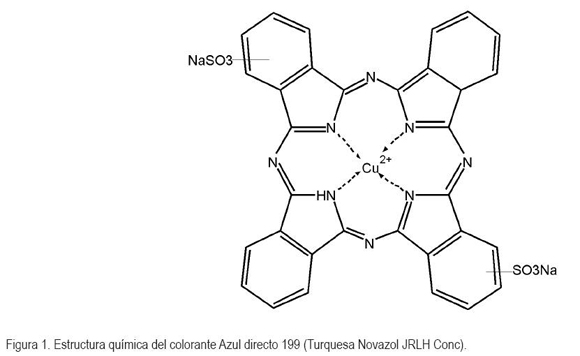
Debido a que solo es activo en la región UV, el TiO2 solo puede aprovechar alrededor de un 4% de la intensidad del espectro de luz solar (Chatterjee, 2005), lo cual, representa un limitante mayor, puesto que no se utilizan al máximo sus propiedades fotocatalíticas; sin embargo, una alternativa que viene siendo explorada para extender su rango de foto-respuesta a la región del visible es emplear compuestos fotosensibilizadores, tales como colorantes. Uno de los colorantes que puede constituir una alternativa es el azul directo 199 (C32H14CuN8Na2O6S2) (Figura 1), que pertenece a la familia química de las ftalocianinas.
Las ftalocianinas son sustancias químicas de colores intensos muy estables, no son tóxicas o contaminantes, presentan propiedades semiconductoras y tienen diversas aplicaciones en la industria, principalmente, en la producción de pigmentos (Garza & Kharisov, 2008). El empleo de ftalocianinas para funciones relacionadas con fotocatálisis heterogénea en remediación ambiental ha sido estudiado por Iliev et al. (2003). Otros trabajos conectados con el uso de ftalocianinas para purificación de aguas son Chen et al. (2005); Zhiyu et al. (2006); Yu et al. (2003) y Kang et al. (2007). Se ha investigado acerca de estudios similares en recopilaciones bibliográficas especializadas (Blake, 2001).
En este artículo, se exploró el uso del DB199, para dopar el semiconductor TiO2, con el ánimo de extender el rango de foto-respuesta a la región del visible y mejorar su actividad fotocatalítica.
MATERIALES Y MÉTODOS
Preparación del fotocatalizador: La selección de la concentración de DB199 para hacer las pruebas de fotosensibilización, se realizó mediante revisión bibliográfica (El Mekkawi et al. 2005); los rangos de concentración manejados oscilan entre 1 x 10-4 M y 1 x 10-5 M.
Se utilizaron 4mL de una solución de DB199 6.25X10-5 M y 0,02 g de TiO2 Degussa P25 (TiO2). Para hacer el seguimiento de la concentración del DB199 y también de la degradación de fenol, se utilizó un espectrofotómetro GENESYS 20, leyendo a longitudes de onda de Λmax = 622 nm y Λmax = 275nm, respetivamente.
Tiempo de sensibilización: La cantidad de colorante adsorbido sobre el TiO2 es proporcional al tiempo de sensibilización (Yu et al. 2003). Se hizo seguimiento a la concentración adsorbida, mediante mediciones espectrofotométricas del filtrado del TiO2, sensibilizado en intervalos de una hora, durante seis horas. Se calcularon los moles de colorantes adsorbidos según Bauer et al. (1999).
Evaluación fotocatalítica: Se manipuló un reactor fotocatalítico, donde se evaluó la degradación del contaminante modelo (Fenol). El foto-reactor consta de un cuerpo fabricado en aluminio de 32cm x 30cm x 72cm, con una puerta frontal, cinco lámparas de luz blanca (20W) y tres agitadores magnéticos. Se usaron 50,100 y 150mg/L de cantidad de catalizador. Se degradaron 50mL de fenol a 10mg/L El pH del medio fue alcalino (pH = 8), porque favorece la acción fotocatalítica de la ftalocianina sobre el TiO2 (Ozoemena et al. 2001). La degradación, se llevó a cabo a temperatura ambiente, dado que la activación fotónica del catalizador no requiere aporte de temperatura, puesto que la energía térmica no produce excitación sobre el catalizador (Fernández, 2004).
La evolución de la concentración de fenol, se efectuó mediante espectrofotometría UV? Visible, retirando el catalizador, a través de filtración; los porcentajes de degradación, se calcularon utilizando la ecuación 1:
RESULTADOS Y DISCUSIÓN
Fotosensibilización de TiO2 con DB199
La figura 2 muestra la variación de la cantidad de moles adsorbidos (mol DB199/g TiO2) frente a la variación de tiempo de sensibilización (t = 1 ? 6 h). Se encontró que en dos horas se fijó 12,2 mol x10-6 mol DB199/g TiO2, siendo este periodo el utilizado para modificar el TiO2 empleado en la degradación del contaminante. Si bien es cierto que los moles adsorbidos en el TiO2 son directamente proporcionales al tiempo, en el proceso, llega un momento donde la superficie del TiO2 adsorbe una cantidad límite de DB199.
Para determinar la adsorción del DB199 sobre el TiO2, se recurrió a los resultados obtenidos en las pruebas de tiempo de sensibilización. Este estudio, se basó en el trabajo de Bauer et al. (1999), donde se afirma que la adsorción de compuestos químicos en los semiconductores, sigue el modelo de la isoterma de Langmuir.
En la adsorción del colorante sobre el TiO2 existe competencia entre el soluto (DB199) y solvente (etanol), para ocupar sitios en la superficie del catalizador (TiO2); por lo cual, el sistema se trata como una reacción de adsorción ? desorción superficial. La isoterma de Langmuir fue construida según (Bauer et al. 1999).
En la figura 3, se presenta la isoterma de Langmuir, construida a partir de la ecuación 2, que muestra formación de monocapa del DB199 sobre el TiO2 (y = 0.0981x ? 0.4579; R2 = 0.9976) y que la cantidad máxima de colorante adsorbida sobre el semiconductor es 10.19 x 10-6 mol DB199/g TiO2.
Donde:
Ceq = Concentración de DB199 en el equilibrio (M)
nads =Moles de DB199 adsorbidos (Mol DB199/g TiO2)
nmax = número total de sitios de adsorción
K = constante de asociación (M-1)
Debido a que los tiempos de adsorción obtenidos se ajustaron a la ecuación 2, se determinó que el DB199 fue adsorbido sobre la superficie del TiO2 en forma de monocapa, ajustándose al modelo de adsorción ? desorción de la isoterma de Langmuir, donde el soluto (colorante) y el solvente (etanol) compiten entre sí, para ocupar sitios en la superficie del catalizador. Se sugiere en un próximo trabajo realizar mediciones que permitan confirmar y precisar la forma de anclaje del colorante sobre el catalizador.
Para conocer en cuánto se extendió el rango de fotorespuesta del semiconductor, se procedió a una medición de transmitancia del TiO2 y del TiO2 ? DB199. En la figura 4, se muestran los espectros del TiO2 y el TiO2?DB199. Se puede observar que hubo una disminución en la transmitancia del TiO2 - DB199 proporcional al aumento de longitud de onda. Dicho fenómeno, se puede interpretar como un incremento de absorción de luz visible por parte del TiO2, consecuencia de la presencia del DB199 en la superficie del semiconductor. El incremento fue desde ? = 400nm a ? = 460nm aproximadamente, donde la última es la longitud de onda de absorción característica del color azul. Los resultados obtenidos están de acuerdo con las lecturas de transmitancia y pruebas de reflectancia difusa de investigaciones, donde se utilizaron complejos ftalocianinicos en la degradación de contaminantes y la caracterización espectral de dichos materiales según Yu et al. (2003); Kumar et al. (2003); Ding et al. (2005); Zhiyu et al. (2006) y Kang et al. (2007).
Evaluación fotocatalítica del TiO2 fotosensibilizador
La figura 5 muestra los resultados experimentales de la degradación de fenol (contaminante modelo) durante seis horas, comparando la eficiencia del catalizador TiO2 y el TiO2-DB199, usando diferentes cantidades de catalizador. No se observaron cambios en la concentración inicial del contaminante antes de comenzar la irradiación con luz visible. Durante las pruebas, el TiO2 presentó una baja eficiencia de degradación. Se puede advertir, que el mayor porcentaje de degradación obtenido fue de 18,98%, correspondiente a una concentración de catalizador de 150mg/L. Cuando se usaron 100mg/L de TiO2?DB199, se logró la mayor disminución del contaminante, 33,85%, lo que se puede atribuir a que a esta concentración de catalizador se absorbió la mayor proporción de fotones. Si se supera este límite, se disminuye el rendimiento de la degradación del contaminante, posiblemente, a reacciones de competición y también al efecto de pantalla que puede ejercer el exceso de TiO2.
Fue viable degradar fenol con el semiconductor modificado, bajo irradiación continua con luz visible, durante seis horas.
Se logró sensibilizar el TiO2 con el colorante comercial DB199. Se necesitaron dos horas para obtener la mayor cantidad de moles de colorante adsorbidas sobre la superficie del catalizador. El colorante provocó el corrimiento de la banda de absorción del TiO2 hacia la región del espectro visible, lo que abre la posibilidad de usar este nuevo material bajo irradiación con luz solar. Usando el TiO2-DB199 fue factible degradar aproximadamente 34% de la concentración inicial del contaminante modelo fenol en el reactor fotocatalítico evaluado. En general, la alternativa de fotosensibilización empleando colorantes comerciales aparece como una alternativa promisoria en busca de alternativas ambientalmente amigables, para la remediación ambiental.
Agradecimientos. La autora principal agradece a los co-autores de este artículo por todo su interés, apoyo y disposición de los medios necesarios para el desarrollo conceptual y experimental de este proyecto de investigación. Financiación: Este trabajo fue realizado gracias a las donaciones de materiales realizadas por Colorquimica S.A., Grupo Alianza Estrategica (GAE) S.A. Se agradece el apoyo económico del Fondo Semilla de la Facultad de Ciencias de la Universidad de los Andes 2010. Conflictos de Intereses: Este manuscrito fue preparado y revisado por todos los autores, quienes declaramos que no existe ningún conflicto de intereses que ponga en riesgo la validez de los resultados presentados.
BIBLIOGRAFÍA
1. BAUER, C.; JACQUES, P.; KALT, A. 1999. Investigation of the interaction between a sulfonated azo dye (AO7) and a TiO2 surface. Chemical Physics Letters. 307:397-406.
2. BLAKE, D. 2001. Bibliography of work on the heterogeneus photocatalytic removal of hazardous compounds from water and air. NREL/TP ? 510 ? 31319. Update # 4 to October 2001 Disponible desde Internet en http://www.nrel.gov/docs/fy02osti/31319.pdf (con acceso: 10/05/10).
3. CHATTERJEE, D.; DASGUPTA, S. 2005. Visible light induced photocatalytic degradation of organic pollutants. J. Photochem. Photobiol. C: Photochemistry Reviews. 6:186-205.
4. CHEN, F.; DENG, Z.; LI, X.; ZHANG, J.; ZHAO, J. 2005. Visible light detoxification by 2,9,16,23-tetracarboxyl phthalocyanine copper modified amorphous titania. Chem. Phys. Letters 415:85-88.
5. DING, H.; ZHANG, X.; KUMAR, R.M.; NICOLINI, C. 2005. Ultrathin films of tetrasulfonated copper phthalocyanine- capped titanium dioxide nanoparticles: Fabrication, characterization, and photovoltaic effect. Journal of Colloid and Interface Science 290:166-171.
6. EL MEKKAWI, D.; ABDEL?MOTTALEB, M.S.A. 2005. The interaction and photostability of some xanthenes and selected azo sensitizing dyes with TiO2 nanoparticles. Internal J. Photoenergy. 7:95-101.
7. FERNÁNDEZ, P. 2004. Propiedades coloidales de partículas de TiO2: Aplicación al tratamiento fotocatalítico solar de aguas. U. de Almería (Dpto. de Física Aplicada), Plataforma solar de Almería ? CIEMAT (Ministerio de Ciencia y Tecnología). p.280-283.
8. GARZA, L.A.; KHARISOV, B. 2008. Pigmentos tipo Ftalocianinas no sustituidas: Obtención y propiedades. Facultad de Ciencias Químicas ? UANL. Revista Ingenierías. 11(38):43-51.
9. ILIEV, V.; TOMOVA, D.; BILYARSKA, L.; PRAHOV, L.; PETROV, L. 2003. Phthalocyanine modified TiO2 or WO3- catalysts for photooxidation of sulfide and thiosulfate ions upon irradiation with visible light. J. Photochemistry and Photobiology A: Chemistry 159:281-287.
10. KANG, C.; LU, Y.; GUO, P.; ZHANG, F.; YU, H.; LIN, X. 2007. Photooxidation of Furfural with phthalocyanine sensitized ? TiO2 particle under Xenon lamp. Chem. Res. Chinese U. 23(2):154-158.
11. KUMAR, G.A.; GIN, J.; VINOY, T.; UNNIKRISHNAN, N.V.; NAMPOORI, V.P.N. 2003. NIR to UV absorption spectra and the optical constants of phthalocyanines in glassy medium. Spectrochimica Acta Part A. 59:1-11.
12. OZOEMENA, K.; KUTZNETSOVA, N.; NYOKONG, T. 2001. Photosensitized transformation of 4 ? chlorophenol in the presence of aggregated and not ? aggregated metallophthalocyanines. J. Photochem. Photobiology A. Chemistry 139:217-224.
13. YU, J.C.; XIE, Y.; TANG, H. Y.; ZHANG, L.; CHAN H. C.; ZHAO, J. 2003. Visible Light ? assisted bacterial effect of metalphthalocyanine ? sensitized titanium dioxide films. J. Photochem. Photobiol. A: Chemistry 156:235- 241.
14. ZHIYU, W.; HAIFENG, C.; PEISONG, T.; WEIPING, M.; FUAN, Z.; GUODONG, Q.; XIANPING, F. 2006. Hydrothermal in situ preparation of the copper phthalocyanine tetrasulfonate modified titanium dioxide photocatalyst. Colloids and Surfaces A: Physicochem. Eng. Aspects 289:207?211.
Recibido: Noviembre 30 de 2009 Aceptado: Octubre 22 de 2010

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.