CIENCIAS DE LA SALUD - Artículo Científico
CARACTERIZACIÓN EPIDEMIOLÓGICA DE LA CRIPTOSPORIDIOSIS EN POBLACIÓN INFANTIL DE LA REGIÓN SABANA CENTRO (CUNDINAMARCA)
EPIDEMIOLOGIG CHARACTERIZATION OF CRYPTOSPORIDIOSIS IN INFANT POPULATION AT THE SABANA CENTRO (CUNDINAMARCA)
Martín Bayona R.1 Catalina Avendaño V2Álvaro Amaya M.3
1Bacteriólogo, Esp., M.Sc. Facultad de Medicina, Universidad de Ciencias Aplicadas y Ambientales, U.D.C.A, Calle 222 No. 55-37, Bogotá D.C. Colombia.Correo electrónico:mabayona@udca.edu.co
2Microbióloga Agrícola y Veterinaria, Esp. Facultad de Ciencias Pecuarias, programa Medicina Veterinaria, Universidad de Ciencias Aplicadas y Ambientales, U.D.C.A. Correo electrónico:cavendano@udca.edu.co
3Estudiante Facultad de Ciencias Pecuarias, programa Medicina Veterinaria, U.D.C.A. Correo electrónico:alamayam89@hotmail.com
Rev. U.D.C.A Act. & Div. Cient. 14 (1): 7-13, 2011
RESUMEN
Criptosporidium parvum es un protozoario intracelular que infecta el epitelio gastrointestinal, ocasionando diarrea autolimitada, en pacientes inmuno-competentes y potencialmente grave en inmuno-comprometidos. El microorganismo, se transmite de persona a persona por contacto con animales infectados, por el agua de bebida, de las piscinas o por alimentos contaminados. El presente trabajo buscó contribuir al conocimiento de la criptosporidiosis en una pequeña población preescolar, mediante un estudio epidemiológico, en la región Sabana Centro (Cundinamarca- Colombia). Se obtuvieron 260 muestras de heces de niños menores de cinco años, entre julio de 2009 y abril de 2010, provenientes de centros hospitalarios y de jardines infantiles, de siete municipios evaluados. Se realizó análisis microscópico de las muestras, consistente en la tinción de Ziehl Neelsen modificada y, posteriormente, se confirmó por inmuno-cromatografía. Para analizar la fuerza de asociación entre las variables estudiadas, se llevó a cabo la prueba de X2 y prueba de Fisher y se halló el p-valor. Para rechazar la hipótesis nula, se tomó como valor de referencia un p<0,05. Se encontró una prevalencia de Cryptosporidium spp., del 7%. En los niños del presente estudio no se registró relación con ningún tipo de diarrea, ubicando la infección, por este parásito, como frecuente y asintomática. Se determinó que Cryptosporidium spp. puede afectar en cualquier momento a los niños menores de cinco años.
Palabras clave: Población infantil, criptosporidiosis, heces, Ziehl Neelsen, parasitosis intestinal.
SUMMARY
Criptosporidium parvum is an intracellular protozoan that infects the gastrointestinal epithelium, causing self-limiting diarrhea in immunocompetent and potentially serious affections in immunocompromised patients. The organism is transmitted from person to person, by contact with infected animals, by drinking water in swimming pools or by contaminated food. The present research was aimed to contribute to the knowledge of cryptosporidiosis in a preschool population through an epidemiological study in the Sabana Center area (Cundinamarca, Colombia). 260 stool samples were obtained from children under five years between July 2009 and April 2010, from hospitals and kindergartens in the seven municipalities evaluated. Microscopic analysis of the samples, consisting in the modified Ziehl Neelsen staining and later confirmation by immunochromatography was performed. To analyze the association between variables the X2 and the Fisher test was used to find the p-value. To reject the null hypothesis as reference p<0.05 was taken. A prevalence of 7% of Cryptosporidium spp. was detected. With the children of this study no relationship with any type of diarrhea was found, placing this parasite infection as frequent and asymptomatic. It was determined that Cryptosporidium spp. can affect children under five years at any time.
Key words: Infant population, criptosporidiosis, feces, Ziehl Neelsen, intestinal parasitosis
INTRODUCCIÓN
Cryptosporidium spp. es un protozoario causante de diarrea en el hombre, su acción es más severa en niños, en adultos mayores y en pacientes inmunocomprometidos. Cryptosporidium spp. posee un complejo apical, como las demás coccidias, se reproduce por ciclos sexuales y asexuales. Se han reconocido 22 especies de Cryptosporidium, doce de las cuales se han encontrado en mamíferos (Plutzer &Karanis, 2009). El agua es un importante vehículo de transmisión, encontrándose resistencia a concentraciones de hasta 80mg/L de cloro. Se han presentado brotes hídricos ocasionados por este parásito en diversas regiones del mundo, tanto en países desarrollados como en vía de desarrollo (Díaz et al. 2003).
La patogénesis de la criptosporidiosis no está totalmente entendida, pero se sabe que el parásito causa destrucción del epitelio intestinal, lo que resulta en una disminución de las micro vellosidades, reduciendo la actividad enzimática y la superficie de absorción, lo que termina en mala absorción y mala digestión produciéndose, entonces, la diarrea (Klein, 2008).
Cryptosporidium spp. está implicado en tres escenarios epidemiológicos: 1) esporádico, relacionado con el agua y brotes de diarrea autolimitada en persona sanas; 2) crónico, asociado con enfermedad que pone en peligro la vida en pacientes inmunocomprometidos y 3) diarrea y desnutrición en niños jóvenes en países en vía de desarrollo (Mor & Tzipori, 2008; Hashimoto et al. 2006).
En Colombia, entre junio de 1996 y octubre de 1998, se realizó el primer estudio serológico de Cryptosporidium spp., en el cual, se registró una seroprevalencia de 83,3%, lo que indicó que la criptosporidiosis es endémica en el país y representa un importante problema de salud pública (Vergara et al. 2000).
En el Hospital Universitario de Cali, entre julio de 1998 y enero de 2005, se analizaron las heces de 70 niños con VIH/ SIDA, de las cuales, el 51,4% fueron positivos al parásito (Siuffi, 2006).
Cryptosporidium, se transmite por aguas y por alimentos, bien sea de persona a persona o animal?persona (zoonosis), de manera fecal?oral (Morrison et al. 2008). Este protozoario tiene un gran potencial de transmisión, a través del agua de bebida, debido a que los ooquistes pueden penetrar las barreras físicas usadas en el tratamiento de aguas, además de ser resistentes a los desinfectantes empleados en este proceso, todo esto ligado a la baja dosis infectante para los humanos y los animales. Los ooquistes presentes en las heces pueden contaminar el agua directa o indirectamente y la disposición de los desechos humanos y animales representan un ítem importante en esta enfermedad (Smith et al. 2007; Fayer et al. 2000). La transmisión de este parásito, se puede dar por ingestión de agua o comida contaminada, por contacto directo o, posiblemente, por vectores (insectos) (Ajjampur et al. 2007).
Cryptosporidium tiene una baja dosis infectante, sólo 9 a 1042 ooquistes pueden causar la enfermedad, además los ooquistes son altamente resistentes al medio ambiente y a los tratamientos del agua, lo que facilita su diseminación (Smith et al. 2007).
De acuerdo con Kim &Corapcioglu (2002), las infecciones intestinales por protozoos y por helmintos continúan siendo un grave problema, sobre todo en países en vía de desarrollo, en donde las precariedades y la falta de recursos de ciertas poblaciones obligan a sus habitantes a adquirir malos hábitos y conductas, que predisponen la adquisición de estas patologías.
La prevalencia de la criptosporidiosis en Sudamérica no se conoce con exactitud, puesto que los estudios epidemiológicos efectuados son escasos, aunque el parásito ha sido identificado en todos los países en los que se investigó su presencia, mediante técnicas coprológicas (Vergara et al. 2000).
En la literatura mundial, las diversas investigaciones de prevalencia de Cryptosporidium spp. han mostrado datos que van desde 0% hasta 46,7%, según la región geográfica, el tipo de población en estudio, la comorbilidad y el estado inmunológico (Xian-Ming et al. 2002; Pollok, 2001; Mosier & Oberst, 2000).
El presente trabajo pretendió contribuir al conocimiento de la criptosporidiosis en la población preescolar, mediante un estudio epidemiológico en la región Sabana Centro (Cundinamarca-Colombia).
MATERIALES Y MÉTODOS
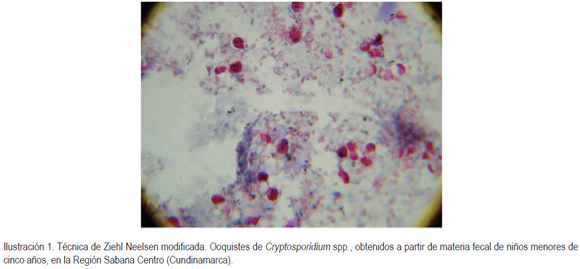
Obtención de las muestras: Se tomaron 260 muestras de heces de niños menores de cinco años, entre julio de 2009 y abril de 2010, provenientes de centros hospitalarios y de jardines infantiles, de las municipios de Cota, de Tocancipá, de Nemocón, de Zipaquirá, de Chía, de Tenjo, de Cajicá y de Tabio. La muestra fue evacuada espontáneamente y recolectada el mismo día para su análisis microscópico, consistente en la realización de la coloración de Ziehl Neelsen modificada y, posteriormente, a las pruebas positivas para dicha coloración (Ilustración 1), se realizó la prueba de inmunocromatografía (método en casette), para la confirmación de C. parvum (Ibáñez et al. 2004).

Las variables que se tomaron en cuenta en esta investigación fueron municipio y presencia de acueducto, edad y consistencia de la materia fecal.
Las 260 muestras fueron tomadas en los municipios, como se indica a continuación: Chía: 53, Nemocón: 31, Zipaquirá: 30, Tenjo: 27, Tabio: 4, Tocancipá: 54, Cota: 38 y Cajicá: 53.
Del total de muestras tomadas, 38 correspondían a niños de un año; 80, de dos; 66, de tres años; 36, de cuatro y 40, de cinco años.
Análisis microbiológicos: Una vez obtenidos los montajes de las muestras, se practicó la tinción de Ziehl Neelsen, descrita por Henricksen &Pohlenz (1981), para lo cual, se realizó un frotis en una lámina, una vez seca la muestra, se fijó con m tanol para, posteriormente, efectuar la tinción modificada.
A las muestras positivas, se les realizó inmunocromatografía para saber si los ooquistes correspondían a C. parvum.
Análisis estadístico: Para analizar la fuerza de asociación entre las variables, se llevó a cabo la prueba de X2 y prueba de Fisher; se halló el p-valor y para rechazar la hipótesis nula, se tomó como valor de referencia un p<0,05.
RESULTADOS Y DISCUSIÓN
De las 260 muestras, en 19 (7%), se observaron ooquistes de Cryptosporidium spp., de acuerdo con la prueba de inmunocromatografía, la cual, es específica para la especie parvum. Las 19 muestras resultaron negativas para la especie parvum, lo que confirma que pueden estar implicadas otras especies en patología humana, como lo afirman Smith et al. (2007), en su estudio, en donde asoció con infección en humanos a C. meleagridis, C. muris, C. suis, C. felis y C. canis. Un porcentaje similar al hallado en el presente estudio, lo reportaron Huiza et al. (2004), al evaluar materias fecales de 79 niños peruanos, las cuales, no presentaban sintomatología alguna con enfermedad diarreica aguda, percibiendo una prevalencia de Cryptosporidium spp., correspondiente al 8,9%. Así mismo, Ajjampur et al. (2007) reportaron, en niños con diarrea de una comunidad semi urbana en el sur de la India, una prevalencia de Cryptosporidium spp., del 7,6%, siendo las especies frecuentemente identificadas: C. hominis, 81%; C. parvum, 12,1% y C. felis, 6%. Hamedi et al. (2005), en una población de niños entre seis meses y siete años, en Irán, reportaron una prevalencia de Cryptosporidium spp., del 7%, asociada con diarrea prolongada y bajo peso.
Cryptosporidium spp. han sido reportados en personas en 106 países. En Estados Unidos, durante el 2003, se describieron 3505 casos de criptosporidiosis; en 2004, 3911 y en 2005, 8269 casos. El incremento de 2005, se atribuyó a un brote producido por aguas recreacionales (Xiao &Fayer, 2008).
El presente estudio buscó encontrar una relación entre la edad de los niños y la presencia de ooquistes en las heces; de las 19 muestras positivas, cuatro eran de niños de cuatro años; nueve, de dos años; tres, de tres años y tres, de cinco años. Ninguna muestra de niños de un año resultó positiva. No se encontró relación estadísticamente significativa entre la edad y la presencia de ooquistes (x2 6,34 p>0,17).
En Colombia, se han reportado prevalencias mayores a la obtenida en este estudio, como es el caso del trabajo realizado en el Departamento de Arauca, por De Arango et al. (2006), quienes analizaron la frecuencia de Cryptosporidium spp., en heces de niños de un mes a 13 años de edad, hallándola en el 46,8%. En la ciudad de Bucaramanga, desde septiembre de 2002 hasta enero de 2004, se analizaron niños con y sin cáncer, encontrándose una prevalencia de 42%, en los que tenían cáncer y 40%, en los niños sin cáncer (Carreño et al. 2005).
En el Hospital Universitario de Cali, entre julio de 1998 y enero de 2005, se analizaron las heces de 70 niños con VIH/ SIDA, de los cuales, el 51,4% fueron positivos al parásito (Siuffi, 2006). En contraste a estas cifras, otros estudios reportan porcentajes inferiores a los obtenidos en la presente investigación, como por ejemplo, De la Ossa et al. (2007), quienes reportaron una prevalencia de Cryptosporidium spp. de 1,9%, en pacientes del Departamento de Barranquilla y tres municipios del Atlántico; así mismo, el estudio de Ibáñez et al. (2004), halló una prevalencia de Cryptosporidium spp., de un 1,9%.
En Brasil, Cabral et al. (2002), al evaluar heces de 445 niños menores de dos años notó una prevalencia C. parvum del 18,7%, percibiendo, dentro de los factores implicados en su transmisión al invierno, la mala higiene en las guarderías y el contacto con niños que presentaban diarrea. Gatei et al. (2006) encontraron en niños Kenianos, menores de cinco años, una prevalencia global de Crypstosporidium spp., del 4%, los cuales, no exteriorizaban manifestaciones clínicas de enfermedad diarreica.
De las 19 muestras positivas, cinco tenían una consistencia líquida, mientras que 14, eran pastosas, ubicando la infección, por este parásito, como bastante frecuente y asintomática, lo que concuerda con lo reportado por De Arango et al. (2006) y en contraste con el trabajo de Siwila et al. (2011), quienes obtuvieron una asociación significativa de diarrea en niños con Cryptosporidium spp. (p = 0,029, OR = 3,7).
Son muchos los patógenos que causan, principalmente, gastroenteritis, donde el 50% de estos casos, se deben al consumo de agua contaminada por heces, tanto humanas como de animales, siendo Cryptosporidium spp. un agente de alta prevalencia, asociado con dichas patologías. Este microorganismo es un protozoario intestinal intracelular que se describió como patógeno humano en 1976, siendo conocido, hasta la fecha, más de 20 especies. Los niños con diarrea representa la tercera o cuarta causa de diarrea infecciosa, después de los rotavirus y Escherichia coli (Kuhls, 2000).
De los 19 niños en los que se observó al menos un ooquiste del parásito, 17 tenía servicio de acueducto, mientras que dos, no. Este hallazgo, se ve soportado con lo reportado por Quilez et al. (2008), quienes argumentan que Cryptosporidium spp. son resistentes a los sistemas de tratamientos de agua.
El principal reservorio es el ganado bovino, específicamente, los terneros, en los que la criptosporidiosis es responsable de una alta tasa de morbilidad neonatal (Broglia et al. 2008). Cryptosporidium spp. tienen un gran potencial de transmisión, a través del agua de bebida, debido a que los ooquistes no son afectadas por el tratamiento de aguas y son tolerantes o resistentes a los desinfectantes usados en este proceso, todo esto, ligado a la baja dosis infectante para los humanos y los animales. Los ooquistes presentes en las heces del ganado pueden contaminar el agua directa o indirectamente y la disposición de los desechos humanos y animales representan un ítem importante en esta enfermedad (Smith et al. 2007; Carey et al. 2004). Estos hechos requieren una especial atención por parte del personal de salud responsable de la desinfección del agua potable.
Por otra parte, la resistencia de los ooquistes a los tratamientos y a los desinfectantes utilizados, rutinariamente, para potabilizar el agua de bebida ha dado gran relevancia a la criptosporidiosis en los últimos años, como enfermedad de transmisión hídrica, siendo considerada como uno de los mecanismos de transmisión de la enfermedad al hombre, de mayor interés (Widme, 1996). De hecho, más de una década y de acuerdo con Slifko (2000), se han documentado un total de 39 brotes hídricos en el Reino Unido, en Estados Unidos, en Canadá y en Japón, destacando el ocurrido en la ciudad norteamericana de Milwaukee, en 1993, donde 400.000 personas resultaron afectadas; un 10% requirieron ingreso hospitalario y, aproximadamente, 54 murieron. La vigilancia de Cryptosporidium en E.U muestra que la incidencia viene en aumento desde 2004, asociados con factores de exposición, como animales infectados, viajes a zonas endémicas e ingestión de alimentos contaminados, como lo afirman Yoder &Beach (2010); de igual manera, Luna et al. (2002) confirman, en su trabajo sobre la presencia de ooquistes de Cryptosporidium spp. en aguas superficiales en Costa Rica, que los métodos usuales de tratamiento de agua no son completamente eficientes en la remoción de los ooquistes. Castro et al. (2008) afirmaron que Cryptosporidium spp., se encuentra constantemente en altas concentraciones en el agua potable destinada al consumo humano y animal, en la cuenca hidrográfica, en el estudio realizado en Galicia (Noroeste de España).
En individuos inmunocompetentes, las manifestaciones usualmente son de corta duración y autolimitadas, mientras que en los individuos no inmunocompetentes la falta de medicamentos efectivos, se constituye en un riesgo, ya que la enfermedad en ellos es severa. Se podría acotar que en pacientes con SIDA y en terapia antirretroviral la mejoría en el nivel de CD4 permite el control de la diarrea y la desaparición de los ooquistes de las heces (Hunter, 2005).
En un estudio longitudinal, desde el nacimiento hasta los cuatro años, en 533 niños en Perú, se encontró que la primera infección con C. hominis se asoció con diarrea, malestar general, vómito y alta excreción de ooquistes, a diferencia de la infección con C. parvum, C. meleagridis, C. canis y C. felis, asociado sólo con diarrea (Cama et al. 2008). Xiao et al. (2001), al analizar 132 muestras de heces de 80 niños peruanos, identificaron cinco tipos de Cryptosporidium: C. parvum humano, C. parvum bovino, C. parvum de perro, C. meleagridis y C. felis, de los cuales, el 29%, de los 85 casos infecciosos, estaban asociados con diarrea, sin registrar diferencias significativas con la edad y el nivel nutricional.
En 142 niños en la unidad de enfermedad diarreica aguda del Hospital San Vicente de Paul de Medellín, 15,5% de ellos presentaron este parásito; de igual manera, en este Departamento, se determinó Criptosporidium (3,6%), en personas inmunosuprimidas, por diferentes causas (Botero et al. 2003).
AGRADECIMIENTOS
A la Universidad de Ciencias Aplicadas y Ambientales U.D.C.A y a cada uno de los jardines y centros hospitalarios participantes. Conflicto de intereses: Los autores del presente escrito declaran que no existe conflicto de intereses que ponga en riesgo la validez de los resultados. Financiación: El presente estudio fue financiado por el fondo de investigación de la Universidad de Ciencias Aplicadas y Ambientales U.D.C.A.
BIBLIOGRAFÍA
1. AJJAMPUR, S.; GLADSTONE, B.; SELVAPANDIAN, D.; MULIYIL, J.; WARD, H.; KANG, G. 2007. Molecular and spatial epidemiology of cryptosporidiosis in children in a semiurban community in South India. J. Clin. Microbiol. 45: 915-920.
2. BOTERO, J.; CASTAÑO, A.; MONTOYA, M.; OCAMPO, N.; HURTADO, M.; LOPERA, M. 2003. A preliminary study of the prevalence of intestinal parasites in immunocompromised patients with and without gastrointestinal manifestations. Rev. Inst. Med. Trop. Sao Paulo. 45:197-200.
3. BROGLIA, A.; RECKINGER, S.; CACCIÓ, S.; NÖCKLER, K. 2008. Distribution of Cryptosporidium parvum subtypes in calves in Germany. Vet. Parasitology (Países Bajos).154(1-2):8-13.
4. CABRAL, M.; ATWILL, E.; PASSOS, A.; ALMEIDA, S.; GARCIA, M. 2002. Intra-familial and extra-familial risk factors associated with Cryptosporidium parvum infection among children hospitalized for diarrhea in Goiania, Goias, Brazil. Am. J. Trop. Med. Hyg. 66:787-793.
5. CAMA, V.; BERN, C.; ROBERTS, J.; CABRERA, L.; STERLING, C.; ORTEGA, Y.; GILMAN, R.; XIAO, L. 2008. Cryptosporidium species and subtypes and clinical manifestations in children, Perú. Emerg. Infect. Dis. 14:1567-1574.
6.CAREY, C.; LEE, H.; TREVORS, J. 2004. Biology, persistence and detection of Cryptosporidium parvum and Cryptosporidium hominis oocyst. Water Research. 38:818-862.
7. CARREÑO, M.; VELASCO, C.; RUEDA, E. 2005. Prevalencia de Cryptosporidium spp. en niños menores de 13 años con afecciones oncológicas. Colombia Médica. 36(2 Supl 1):6-9.
8. CASTRO, J.; GARCÍA, I.; ALMEIDA, A.; GONZÁLEZ, M.; CORREIA, J.; MEZO, M. 2008. Presence of Cryptosporidium spp. and Giardis duodenalis through drinking water. Science of the Total Enviroment. 405:45-53.
9. DE ARANGO, M.; RODRÍGUEZ, D.; PRADA, N. 2006. Frecuencia de Cryptosporidium spp. en materia fecal de niños entre un mes y trece años en un hospital local colombiano. Colombia Médica. 37(2):121-125.
10. DE LA OSSA, N.; FALCONAR, A.; LLINÁS, H.; ROMERO, C. 2007. Manifestaciones clínicas y factores de riesgo asociados a la infección por Cryptosporidium en pacientes de Barranquilla y tres municipios del Atlántico (Colombia). Salud UniNorte. Barranquilla (Col.).23(1): 19-31
11. DÍAZ, M.; LEYVA, E.; MATA, V.; GONZÁLEZ, H. 2003. Incidencia y viabilidad de Cryptosporidium parvum en el agua potable de ciudad de Obregón, Sonora, México. Rev. Int. Contam. Ambient. 19(2):67-72.
12. FAYER, R.; MORGAN, U.; UPTON, S.; 2000. Epidemiology of Cryptosporidium: transmission, detection and identification. Int. J. Parasitol. 30: 1305-1322.
13. GATEI, W.; WAMAE, C.; MBAE, C.; WARURU, A.; MULINGE, E.; WAITHERA, T. 2006. Criptosporidiosis: prevalence, genotype analysis, and symptoms, associated with infections in children in Kenya. Am. J. Trop. Med. Hyg. 75:78-82.
14. HAMEDI, Y.; SAFA, O.; HAIDARI, M. 2005. Cryptosporidium infection in diarrheic children in Sourheastern Iran. Pediatr. Infect. Dis. J. 24:86-88.
15. HASHIMOTO, A.; SUGIMOTO, H.; MORITA, S.; HIRATA, T. 2006. Genotyping of single Cryptosporidium oocysts in sewage by semi-nested PCR and direct sequencing. Water Res. 40:2527-2532.
16. HENRICKSEN, S.; POHLENZ, J. 1981. Staining of Cryptosporidium by a Modified Ziehl-Neelsen technique. Acta Ve. Scand. 22:594-596.
17.HUIZA, A.; ESPINOZA, Y.; ROJAS, R.; SEVILLA, C.; ALVA, P.; VERÁSTEGUI, R.; QUISPE, E.; ROMUALDO, G.; ÁNGELES, Z. 2004. Detección de coccidios en niños asintomáticos mediante esporulación de muestras fecales. An. Fac. Med. Lima, Perú. 65(4):239-242.
18. HUNTER, P. 2005. The zoonotic transmission of Giardia and Cryptosporidium. Internal J. Parasitol. 35(11- 12):1181-1190.
19. IBÁÑEZ, N.; JARA, C.; GUERRA, A.; DÍAZ, E. 2004. Prevalencia del entero parasitismo en escolares de comunidades nativas del alto Amazonas, Perú. Rev. Peru. Med. Exp. Salud Pública. 21(3):126-133.
20. KIM, S.; CORAPCIOGLU, M. 2002. Vertical transport of Cryptosporidium parvum oocystes through sediments. Environ. Technol. 23:1435-1446.
21. KLEIN, P. 2008. Effect of Cryptosporidium parvum infection on the absorptive capacity and paracellular permeability of the small intestine in neonatal calves. Vet. Parasit. 152:53?59.
22. KUHLS, T. 2000. Cryptosporidiosis during childhood. Semin. Pediatr. Infect. Dis. 11:213-219.
23. LUNA, S.; REYES, L.; CHINCHILLA, M.; CATARINELLA, G. 2002. Presencia de ooquistes de Cryptosporidium spp. en aguas superficiales en Costa Rica. Parasitol. Latinoam.57(1-2):63-65.
24. MOR, S.; TZIPORI, S. 2008. Criptosporidiosis in children in Subsaharan Africa; a lingering Challenge. Clin. Infect. Dis. 47:915-921.
25. MORRISON, L.; MALLON, M.; SMITH, H.; MACLEOD, A.; XIAO, L.; TAIT, A. 2008. The population structure of the Cryptosporidium parvum population in Scotland: A complex picture. Infection, Genetics and Evolution. 8:121-129.
26. MOSIER, D.; OBERST, R. 2000. Cryptosporidiosis: A global challenge. Ann New York. Acad. Science. 916:102-111.
27. PLUTZER, J.; KARANIS, P. 2009. Genetic polymorphism in Cryptosporidium species: an update. Vet. Parasitol. 165(3-4):187-199.
28. POLLOK, R. 2001. Cryptosporidiosis and Microsporidiosis. Internal J. Gastroenterol. Hepatol. 49:457-467.
29. QUILEZ, J.; TORRES, E.; CHALMERS, R.; ROBINSON, G.; DEL CACHO, E.; SANCHEZ-ACEDO, C. 2008. Cryptosporidium species and subtype analysis from dairy calves in Spain. Parasitology. 135(14):1613-20.
30. S IUFFI, A. 2006. Relación entre los niveles de carga viral y los niveles de linfocitos CD4 en el diagnóstico de Cryptosporidium spp. en heces de niños de la Clínica Pediátrica de VIH/SIDA del Hospital Universitario del Valle, Cali, Colombia. Colombia Médica. 37(1):3715- 3720.
31. S IWILA, J.; PHIRI, I.; LARSEN, H.; NCHITO, M.; OLSEN, A. 2011. Seasonal prevalence and incidence of Cryptosporidium spp. and Giardia duodenalis and associated diarrhea in children attending pre-school in Kafue, Zambia. Transanctions Royal Soc. Trop. Med. Hig. 105:102-108.
32. S LIFKO, T. 2000. Emerging parasite zoonoses associated with water and food. Internal J. Parasitol. 30(12-13):1379-1393.
33. S MITH, H.; CACCIO, S.; COOK, N.; NICHOLS, R.; TAIT, A. 2007. Cryptosporidium and Giardia as foodborne zoonoses. Vet. Parasitol. 149: 29-40.
34. V ERGARA, C.; SANTOS, S.; SANTOS, F.; ARES, M. 2000. La criptosporidiosis en la región andina de Colombia: seroprevalencia y reconocimiento de antígenos. Rev. Panamericana de Salud Pública. 8(6):373-379.
35. WIDME, G. 1996. Water-borne Cryptosporidium: A perspective from the USA. Parasitology Today. 12(7):286-290.
36. XIAO, L.; BERN, C.; LIMOR, J. 2001. Identification of five types of Crypstosporidium parasites in children in Lima, Perú. J. Infect. Dis. 183:492-497.
37. XIAO, L.; FAYER, R. 2008. Molecular characterisation of species and genotypes of Cryptosporidium and Giardia and assessment of zoonotic transmission. Int. J. Parasitol. 38(11):1239-1255.
38. XIAN-MING, C.; KEITHLY, J.; PAYA, C.; LARUSSO, N. 2002. Current concepts: Criptosporidiosis. N. Engl. J. Med. 346:1723-1731.
39. YODER, J.; BEACH, M. 2010. Cryptosporidium surveillance and risk factors in the United States. Exp. Parasitol. 124:31-39.
Recibido: Noviembre 4 de 2010; Aceptado: Aceptado: Abril 6 de 2011

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.