CIENCIAS AGROPECUARIAS - Artículo Técnico
INTERACCIÓN DE MICROORGANISMOS BENÉFICOS EN PLANTAS: Micorrizas, Trichoderma spp. y Pseudomonas spp. UNA REVISIÓN
A REVIEW OF INTERACTION OF BENEFICIAL MICROORGANISMS IN PLANTS: Mycorrhizae, Trichoderma spp. and Pseudomonas spp.
Mario Alejandro Cano1
1Ingeniero Agrónomo. M.Sc. en Ciencias Agrarias. Docente Facultad de Ingeniería Agronómica. Universidad de Ciencias Aplicadas y Ambientales U.D.C.A, Correo electrónico:mcano@udca.edu.co
Rev. U.D.C.A Act. & Div. Cient. 14 (2): 15-31, 2011
RESUMEN
Existe una amplia gama de interrelaciones entre especies de microorganismos en los ecosistemas, tales como sinérgicas, antagónicas, de competencia física y bioquímica, moduladas por múltiples y complejos factores bióticos y abióticos. En la rizósfera, uno de los principales sitios donde se presentan microorganismos, específicamente funcionales, como fijadores de nitrógeno, solubilizadores de fosfatos, promotores del crecimiento vegetal, biocontroladores y especies patogénicas, normalmente, compiten por espacio y por nutrientes. Estas interrelaciones entre microorganismos inciden en la interacción suelo-planta-microorganismos-ambiente y repercuten, de forma directa, en el crecimiento y en el desarrollo de las especies vegetales. Microorganismos rizosféricos, como los hongos formadores de micorrizas arbusculares (AMF), hongos del género Trichoderma y bacterias del género Pseudomonas, usualmente, catalogados como agentes de control biológico (BCA) y microorganismos promotores del crecimiento vegetal (PGPM), dependen de los factores mencionados para expresar sus potenciales efectos benéficos; sin embargo, en la interacción de estos tres tipos de microorganismos, se pueden presentar efectos sinérgicos, que potencialicen los beneficios o, por el contrario, efectos antagónicos o simplemente que no ocurra ningún efecto en el crecimiento y en el desarrollo de las plantas. De acuerdo a lo anterior, el propósito de esta revisión es brindar información que permita comprender algunas de las interacciones entre microorganismos y, de esta manera, lograr dilucidar la aplicabilidad de la co-inoculación de BCA y PGPM de diferentes especies, con un objetivo común, el control o la regulación biológica de fitopatógenos y, como efecto conjunto y paralelo, la estimulación del crecimiento vegetal.
Palabras clave: Control biológico, microorganismos, promotores del crecimiento, sinergismo, antagonismo.
SUMMARY
A wide range of interactions between species of microorganisms in ecosystems such as synergistic, antagonistic, physical and biochemical competition, modulated by multiple and complex biotic and abiotic factorsdo exsist. In the rhizosphere, one of the main sites where microorganisms are functiona, specifications, such as nitrogen fixers, phosphate solubilizers, plant growth promotion, biocontrol and pathogenic species, usually for space and nutrients are found. These interrelationships between organisms affect the soil-plant-micro-environment and directly influence the growth and development of plant species. Rhizospheric microorganisms such as arbuscular mycorrhizal fungi(AMF), Trichoderma fungi and bacteria of the genus Pseudomonas, usually classified as biological control agents (BCA) and plant growth promoting microorganisms (PGPM), depend on these factors to express their potential beneficial effects. However, the interaction of these three types of microorganisms can be synergistic, potentializing the benefits or otherwise, antagonistic effects do not occur, being the effect on the growth and development of plants absent. According to the above, the purpose of this review was to provide information to understand some of the interactions between microorganisms and thus to clarify the applicability of the co-inoculation of BCA and PGPM from different species with a common goal, the control or biological control of plant pathogens and as a result set and parallel stimulation of plant growth.
Key words: Biological control, microorganisms, growth promoters, synergism, antagonism.
INTRODUCCIÓN
Para efectos prácticos de búsqueda de información para el lector, las siglas y las nomenclaturas empleadas, a través del texto, corresponden a las abreviaturas en el idioma inglés, de los temas relacionados en la lista que se muestra a continuación, debido a que al realizar búsquedas con las abreviaturas en español, la información que aparece es poca o nula.
Lista de abreviaturas en inglés y su significado en español
BCA:Agentes de Control Biológico o Biocontroladores, por sus siglas en idioma inglés: Biological Control Agents.
PGPM:Microorganismos promotores del crecimiento vegetal, por sus siglas en idioma inglés: Plant Growth Promoting Microorganism.
PGPR:Rizobacterias promotoras del crecimiento vegetal, por sus siglas en idioma inglés: Plant Growth Promoting Rhizobacteria.
PGPB:Bacterias promotoras del crecimiento vegetal, por sus siglas en idioma inglés: Plant Growth Promoting Bacteria.
PGPF:Hongos promotores del crecimiento vegetal, por sus siglas en idioma inglés: Plant Growth Promoting Fungi.
PGP:Estimulación del crecimiento vegetal, por sus siglas en idioma inglés: Plant growth promoting.
AMF:Hongos formadores de micorrizas arbusculares, por sus siglas en idioma inglés: Arbuscular Mycorrhizal Fungi.
BCA:Agentes de Control Biológico o Biocontroladores, por sus siglas en idioma inglés: Biological Control Agents.
AMFB:Bacterias del suelo asociadas a los hongos formadores de micorrizas arbusculares, por sus siglas en idioma inglés: Soil bacteria associated with arbuscular mycorrhizal fungi.
Inoculación:Para este caso, introducción de un microorganismo en el sistema con un fin determinado BCA y PGPM.
Co-inoculación:Introducción de más de un microorganismo en el sistema.
La multifuncionalidad de los microorganismos en los sistemas agrícolas, se expresa de acuerdo a una serie de factores bióticos, como la competencia con otros microorganismos, la composición biológica del suelo, el reconocimiento plantamicroorganismo y viceversa. Igualmente, factores abióticos, como la climatología, las características físicas y químicas del suelo, que influyen directamente en el tipo de interacción de estos organismos y la expresión de los efectos benéficos o detrimentales, determinantes en el desarrollo de las especies vegetales (Marschner & Timonen, 2005; Harman, 2006; Hoitink et al. 2006; Siddiqui & Akhtar, 2008; Radjacommare et al. 2010).
La interacción de microorganismos rizosféricos, como los hongos formadores de micorrizas arbusculares (AMF), hongos del género Trichoderma y bacterias del género Pseudomonas, usualmente catalogados como agentes de control biológico (BCA) y microorganismos promotores del crecimiento vegetal (PGPM), dependen de este tipo de factores para expresar sus potenciales efectos benéficos; sin embargo, las interacciones entre los microorganismos son complejas y se pueden presentar efectos sinérgicos que potencialicen los beneficios para la planta o, por el contrario, efectos antagónicos o, simplemente, que no ocurra ningún efecto.
Es difícil predecir el resultado de las interacciones entre plantas y microorganismos benéficos del suelo y, más aún, entre las especies de microorganismos; no obstante, las comunidades microbianas asociadas con el sistema de raíces, se considera que desempeñan un papel clave en el desarrollo de prácticas agrícolas sostenibles. La respuesta de las plantas a la inoculación depende de las compatibilidades funcionales en la fisiología y en la bioquímica de la interacción, entre los componentes microbianos; así arroja diferentes respuestas, dependiendo de la combinación de los microorganismos (Vázquez et al. 2000).
En la presente revisión, se tratará de dar respuesta a los siguientes interrogantes: a) ¿Cuáles pueden ser los efectos benéficos individuales de las especies que integran el consorcio AMF, Trichodermay Pseudomonas?; b) ¿Qué incidencia funcional tienen los AMF, Trichoderma y Pseudomonas en la regulación o control de organismos patógenos en plantas y en la estimulación del crecimiento vegetal?; c) ¿Qué tipo de interacción se presenta entre AMF, Trichoderma y Pseudomonas?; d) ¿Cuál es el tipo, modo y mecanismos de acción común entre AMF, Trichoderma y Pseudomonas?
Metodología: Para llevar a cabo esta revisión, se tomaron artículos científicos y búsquedas de revistas indexadas, entre el 2000 y 2011, con dos o tres excepciones de años anteriores, todos relacionados con la utilización de microorganismos benéficos en la producción agrícola, las posibles interacciones y su aplicación como BCA y PGPM. Esta revisión tardó alrededor de seis meses y se analizaron más de las 90 referencias citadas en este documento. Las principales revistas de consulta fueron: Biological Control, Phytopatology, Plant Protection, Crop Protection, Biocontrol Science and Technology, Fungal Ecology, Soil Biology & Biochemistry, Agriculture Ecosystems and Environment, Biosystems, Plant Biology, entre otras.
Efectos benéficos individuales de las especies que integran el consorcio.
Hongos formadores de micorrizas arbusculares (AMF):Diversos estudios han demostrado los efectos benéficos de la asociación simbiótica entre los AMF y las plantas (Gosling et al. 2006; Franken et al. 2007; Akhtar & Siddiqui, 2008; Kapoor et al. 2008), tales como:
Finlay (2004) menciona que, recientemente, existe una mayor atención en observar la interacción de los AMF con las comunidades microbianas de la rizósfera y las repercusiones en las plantas hospederas. La nueva perspectiva incluye el estudio de la multifuncionalidad de los AMF, en procesos como:
Trichodermaspp.
Trichoderma (teleomorfo Hypocrea) es un género de hongos que se encuentran en los suelos de todas las zonas climáticas del mundo y son importantes descomponedores de materiales leñosos y herbáceos. Trichoderma es un hongo invasor oportunista, que se caracteriza por su rápido crecimiento, por la capacidad de asimilar una amplia gama de sustratos y por la producción de una variedad de compuestos antimicrobianos. Algunas cepas han sido explotadas como agentes de control biológico (BCA) de patógenos, incluyendo hongos y nematodos, todo mediado por la producción de enzimas de degradación de la pared celular, como: celulasas, quitinasas, glucanasas, entre otras, y la producción de antibióticos. También, han sido usadas en biorremediación, por su capacidad de degradar hidrocarburos, compuestos clorofenólicos, polisacáridos y los plaguicidas xenobióticos, utilizados en la agricultura (Verma et al. 2007; Vinale et al. 2008a; Hoyos et al. 2009). Igualmente, debido a la existencia de transposones ABC en sus moléculas (Hoyos et al. 2009), se considera estimulador del crecimiento vegetal (Leandro et al. 2007) e inductor de resistencia sistémica, debido a que modula o estimula algunas respuestas en la planta (Howell & Puckhaber, 2005; Howell, 2006).
Entre los efectos positivos de la inoculación de plantas con Trichoderma (Harman et al. 2004; Harman, 2006), se incluyen:
Pseudomonas spp.
Estas bacterias pueden ejercer un efecto benéfico directo, a través de la síntesis de fitohormonas y de vitaminas, estimulación de la germinación de semillas y emergencia de plántulas, inhibición de la síntesis de etileno, solubilización de fósforo (P) inorgánico. De manera indirecta, por medio de síntesis de antibióticos y fungicidas, competencia por nutrientes, producción de sideróforos o por la inducción de la resistencia sistémica a patógenos. Pueden también actuar como BCA, capaces de proteger a las plantas de la infección, causadas por agentes fitopatógenos (Siddiqui & Shaukat, 2003; Alves et al. 2004; Fgaier et al. 2008; Rosas et al. 2009).
En virtud de su capacidad de adaptación fisiológica y versatilidad metabólica, las bacterias en las zonas de raíces de las plantas son un agente clave del cambio del suelo en los agroecosistemas, con efectos positivos, en cuanto a tolerancia de altos contenidos de sales, aumento en los rendimientos de los cultivos y mejoras en la calidad del suelo, respecto a la disponibilidad de nutrientes; sin embargo, esta regulación está mediada por el quórum sensing de las bacterias, las cuales, se deben adaptar para alcanzar una alta proliferación y, de esta manera, se estimulan, se activan y se mantienen en la zona radicular, por medio de la liberación selectiva de los exudados y lixiviados, por parte de las plantas y otros microorganismos (Brown, 2010).
A su vez, las bacterias de la rizósfera son capaces de generar una amplia variedad de metabolitos secundarios, que pueden tener una influencia positiva (Sturz & Christie, 2003), sobre:
De acuerdo a lo anterior, son muchos los beneficios que se le atribuyen a este tipo de microorganismos, cuando son estudiados de forma individual, ya que cada especie presenta capacidades específicas para ser utilizadas como PGPM y BCA; no obstante, esto no quiere decir que cada función se cumpla por separado. Las tres especies en estudio muestran la multifuncionalidad de sus bondades expresadas en los efectos benéficos, en cuanto a la estimulación del crecimiento vegetal y la protección directa contra patógenos edáficos, principal e indirectamente, contra patógenos aéreos.
En cuanto a la influencia en el estado nutricional y en la promoción del crecimiento y desarrollo de las plantas, bien sea por el aporte de agua y de nutrimentos entre otros, como en el caso de los AMF (aumento en la exploración del suelo, más allá de la zona de agotamiento de nutrientes y de agua) o en la solubilización de compuestos orgánicos y producción de metabolitos secundarios, que actúan de forma análoga a las fitohormonas, influye, directamente, en la disponibilidad de nutrientes y en la estimulación del crecimiento vegetal, como en el caso de Pseudomonas spp. y Trichoderma spp.
De igual forma, los tres microorganismos comparten el efecto en la estimulación del sistema de defensa de las plantas, lo cual, confiere, en éstas, cierto tipo de tolerancia al ataque de patógenos aéreos. Por otra parte, el establecimiento, la adaptación y la posible interacción sinérgica entre los antagonistas en la zona rizosférica, protegen a la planta contra patógenos edáficos, atribuyéndoles a los antagonistas, como un modo de acción directo, la competencia por espacio y por nutrientes e, indirecto, la producción de compuestos antimicrobianos, que regulan o truncan el avance de los patógenos hacia el sistema radicular.
Incidencia funcional del consorcio en la regulación o control de organismos patógenos en plantas y la estimulación del crecimiento vegetal.
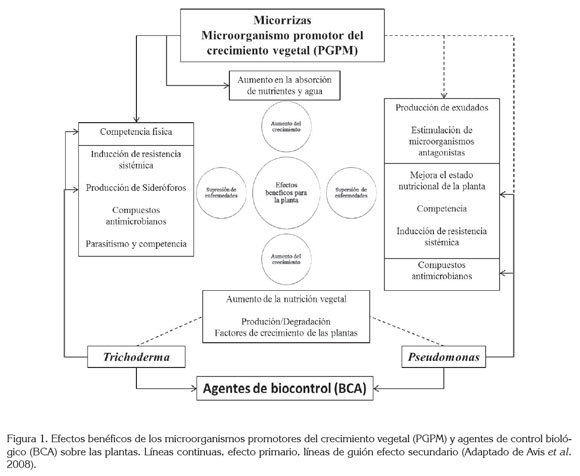
Se ha demostrado que los PGPM, incluyendo PGPR, PGPB, bacterias diazotróficas, fijadores de nitrógeno de vida libre y AMF, tienen un efecto directo o primario en la nutrición vegetal y, por ende, en la estimulación del crecimiento de las plantas; no obstante, estudios recientes muestran la potencialidad del uso de estos inoculantes, como BCA, considerándolo como un efecto secundario de esta interacción. De hecho, Rhizobium y Glomus spp. pueden promover el crecimiento de las plantas y la productividad (efecto primario), pero ahora han mostrado jugar también un papel en la reducción de la enfermedad (efecto secundario) (Guo et al. 2004; Aliye et al. 2008; Yasir et al. 2009). BCA como Trichodermaspp. y Pseudomonas spp. pueden controlar enfermedades en plantas (efecto primario), recientemente, se ha mostrado un efecto en la estimulación del crecimiento de la planta en la ausencia de patógenos (efecto secundario). La figura 1, representa algunos de los efectos primarios y secundarios, de acuerdo al tipo de microorganismo (PGPM ó BCA) y de los beneficios que aportan éstos a las plantas.

Bacterias y hongos de la rizósfera pueden producir sustancias aleloquímicas o antibióticos que impiden el desarrollo de enfermedades causadas por patógenos edáficos en las plantas (Sturz & Christie, 2003). Otro factor relevante del uso de los PGPM es la estimulación del sistema de defensa de las plantas; diferentes especies de PGPR, solas o en mezclas y algunos PGPF, se podrían utilizar como elicitores, para inducir la resistencia sistémica contra diversas enfermedades producidas por agentes causales, como: Ralstonia solanacearum, Colletotrichum gloeosporioides, Rhizoctonia solani, Alternaria solani, Fusarium oxysporum (Jetiyanon & Kloepper, 2002; Latha et al. 2009, Mohandas et al. 2010). Las plantas pueden ser inducidas a desarrollar una mayor resistencia a los patógenos, mediante el tratamiento, con una variedad de inductores bióticos y abióticos. La resistencia inducida es de amplio espectro y puede ser de larga duración, pero rara vez proporciona un control completo de la enfermedad. Una posible razón para esto es que las plantas en el campo ya están inducidas, a través de sus continuas interacciones con el entorno biótico y abiótico (Walters, 2009)
Efectos sinérgicos y antagónicos de la interacción entre AMF, Trichoderma y Pseudomonas.
El mutualismo entre las especies muestra un efecto desestabilizador en la dinámica de la comunidad. De hecho, se pueden presentar tales tipos de competencias entre especies de microorganismos relacionados taxonómicamente, como de especies lejanas, que depriman el crecimiento de las plantas y, por ende, el mutualismo se puede ver afectado y redirigirse hacia un parasitismo (Neuhauser & Fargione, 2004). También se puede manifestar incompatibilidad entre los microorganismos que se combinan o se mezclan (Oyekanmi et al. 2007). Esto se puede deber a que las interacciones mutualistas, generalmente, no son estables, debido a diversos factores bióticos y abióticos. Al respecto, Bae & Knudsen (2005) mencionan que el crecimiento de hifas y la eficacia de biocontrol de Trichoderma harzianum puede depender de su interacción con los componentes bióticos del medio ambiente y del suelo.
Neuhauser & Fargione (2004) adaptaron el modelo Lotka- Volterra, generalmente utilizado para el estudio de interacciones parasitarias, con el fin de observar tanto efectos positivos como negativos entre especies y mostrar cómo se pueden aplicar a los cambios mutualismo-parasitismo. De allí, plantearon dos preguntas: 1) ¿Qué factores determinan si una especie se comporta como un mutualista o un parásito? y, 2) ¿Cuáles son los factores de control de los resultados de la competencia entre un parasito y un mutualista? Con el fin de dar respuesta a estos interrogantes, analizaron la relación mutualista entre AMF y plantas.
La interacción entre el simbionte (el hongo) y su hospedante (la planta) consiste en transferencia de nutrientes: la planta proporciona al hongo compuestos de carbono y el hongo suministra nutrientes, como fósforo, a la planta. Una planta se puede beneficiar de una infección con AMF, especialmente, en suelos con baja disponibilidad de fósforo; la transferencia de carbono de la planta al hongo puede disminuir en estas condiciones, mientras que la transferencia de nutrientes del hongo a la planta puede aumentar. Un aumento en la fertilidad del suelo puede, a su vez, producir el efecto contrario y convertir una relación mutualista en una relación parasitaria. El cambio de mutualismo al parasitismo ocurre, porque como el recurso limitante es más abundante (P), el beneficio relativo de las micorrizas suministro de nutrientes, se reduce. En primer lugar, como los beneficios de la planta se vuelven menos importantes al aumentar la fertilidad del suelo, la interacción entre el hongo y su hospedante se vuelve parasitaria. Segundo, las interacciones competitivas entre dos cepas de MA puede mostrar un cambio a favor de un parásito y esto ocurre cuando el mutualista tiene una mayor tasa de crecimiento, pero el parásito es un buen competidor (Neuhauser & Fargione, 2004).
Estas relaciones sinérgicas o antagónicas entre microorganismos han sido poco documentadas; sin embargo, crece el interés de utilizar diversos microorganismos, con el objetivo de proporcionarle a la planta protección contra patógenos y, al mismo tiempo, promover el crecimiento vegetal. En este sentido, Chandanie et al. (2009) mostraron que la inoculación combinada o co-inoculación de AMF Glomus mosseae y PGPF, como Penicillium simplicissimum GP17-2 y Trichoderma harzianum GT3-2 en plantas de pepino (Cucumis sativus L.), suprimieron la enfermedad damping-off, ocasionada por uno de los agentes causales Rhizoctonia solani; notaron que G. mosseae reducía la incidencia de la enfermedad, si era previamente inoculado en las plantas antes que el patógeno. Igualmente, observaron que la inoculación combinada de T. harzianum con G. mosseae aumentó el porcentaje de colonización radical de las AMF. En contraste, la presencia de G. mosseae disminuyó el desarrollo de la población de T. harzianum alrededor de las raíces; sin embargo, el crecimiento de P. simplicissimum no se afectó. La co-inoculación de G. mosseae con T. harzianum mostró sinérgicamente un mayor crecimiento de las plantas. Curiosamente, los niveles de protección contra las enfermedades alcanzado por la inoculación de cada una de las especies solas, P. simplicissimum, T. harzianum y G. mosseae fue aumentando significativamente, mediante la inoculación combinada de cada PGPF con G. mosseae.
Así mismo, Akhtar & Siddiqui (2008) observaron los efectos de la co-inoculación de G. intraradices, Rhizobium sp. y Pseudomonas straita en el complejo de la enfermedad de la pudrición de la raíz del garbanzo, causada por Meloidogyne incognita y Macrophomina phaseolina, mostrando que la presencia de P. straita y Rhizobium en co-inoculación aumentaron la colonización de raíces por G. intraradices. La inoculación con Rhizobium causa mayor reducción en la multiplicación de los nematodos, seguido por P. straita y G. intraradices. La reducción máxima de la multiplicación de los nematodos, se observó cuando G. intraradices fue inoculado conjuntamente con las bacterias. De igual manera, se ha observado que los exudados de las AMF estimulan el crecimiento de las PGPB y presentan un posible efecto antagónico en contra del crecimiento de los nematodos (Gera & Cook, 2005).
Malusa et al. (2007) evaluaron el efecto en el crecimiento y en los cambios morfológicos de las raíces de los cultivares de fresa Senga Sengana, Kent y Elsanta, tratados con una mezcla de cinco especies de Glomus (G. mosseae, G. intraradices, G. caledonium, G. viscosum G. coronatur), un hongo del suelo (Trichoderma viride) y tres especies de bacterias de la rizósfera (Bacillus subtilis, P. fluorescens y Streptomyces spp.) y fertilizantes foliares, observando diferencias marcadas en el crecimiento de las raíces en los tres cultivares que podrían ser relacionados con la modificación de los procesos de la rizósfera por la actividad de microorganismos y la respuesta genotípica de los cultivares a la inoculación. De igual forma, Gryndler et al. (2002) hallaron un efecto positivo en el crecimiento de las plantas de fresa inoculadas, pero sólo para algunas combinaciones de las especies de Glomus con las cepas de bacterias.
Bennett & Whipps (2008) mencionan que el establecimiento o adaptación de plántulas provenientes de cultivos in vitro es una técnica que requiere diversos cuidados para disminuir los altos índices de mortalidad en la fase inicial de este proceso. Para mejorar el establecimiento y reducir la mortalidad de plántulas realizaron una aplicación de cuatro microorganismos benéficos seleccionados (P. chlororaphis MA342, P. fluorescens CHA0, Clonostachys pitiriasis IK726d11 y T22 T. harzianum) a las semillas de cebolla y zanahoria, notando que todos los microorganismos aplicados disminuyeron la mortalidad de las plántulas y estimularon el establecimiento. De igual forma, advirtieron diferencias en los patrones de supervivencia de los microorganismos en las semillas y en el establecimiento de las plántulas, a través del experimento. Datos similares reportaron Wright et al. (2003), utilizando cinco PGPM o BCA, como: P. fluorescens CHA0, Pseudomonas sp. AB842, MBI600 B. subtilis, T22 T. harzianum y T. virens del G-20, notando la proliferación de los microorganismos en las semillas de zanahoria, de chirivía y de puerro; sin embargo, sugieren que se debe evaluar más la aplicación de los microorganismos a las semillas durante el establecimiento.
Se ha comprobado que los AMF inducen cambios en la composición de los exudados de las raíces modificando la estructura de la comunidad bacteriana de la rizósfera, lo que lleva a la formación de la micorrizosfera, por lo cual, pueden ser utilizados como BCA de enfermedades del suelo; el efecto de los AMF sobre las bacterias de la rizósfera no estaría mediada por los compuestos presentes en los exudados de las raíces de las plantas sino más bien por factores físicos o químicos de compuestos volátiles o superficiales asociados con el micelio del hongo y el sustrato (Lioussanne et al. 2010). En otras investigaciones, se ha observado claramente el efecto del micelio externo de los AMF, siendo éste inhibitorio cuantitativo y cualitativo en las comunidades de distintos microorganismos del suelo (Welc et al. 2010). En contraste con lo anterior, se ha percibido que las esporas de los AMF se pueden encontrar asociadas a bacterias del suelo (AMFB). Algunos AMFB podría contribuir a aumentar la capacidad de los AMF para inhibir los patógenos, adquirir nutrientes minerales y modificar el crecimiento de las raíces de plantas. Por otra parte, las rizobacterias asociadas a las AMF son multifuncionales, mejoran la asociación simbiótica, el crecimiento de las plantas y el antagonismo contra patógenos (Bharadwaj et al. 2008).
Ravnskov et al. (2006) reportan que, a pesar de la mutua inhibición entre los dos inoculantes Clonostachys rosea IK 726 y G. intraradices BEG87, no se afectó la estimulación del crecimiento en plantas de tomate. Ambos inoculantes sufrieron una marcada influencia de otros microorganismos del suelo, que dificultaron la eficiencia, pero no la efectividad de estos microorganismos, expresada en los beneficios para las plantas.
Una de las inquietudes de la implementación de medidas de control biológico es la compatibilidad de éstas con las actividades inherentes al cultivo, ya sean de control cultural, químico o bilógico. Se ha registrado, en diversos estudios, que la compatibilidad de estos inoculantes con el manejo integral de los cultivos, se relaciona con un efecto complementario del manejo y no como supresivo de otras medidas de control (Mommaerts et al. 2008). Al respecto, Stanley et al. (2010) realizaron un estudio sobre la compatibilidad de Diafentiurón (insecticida que inhibe la síntesis de ATP, que se utiliza ampliamente para el manejo de plagas en cardamomo), con microorganismos antagonistas de patógenos de plantas, como T. viride y P. fluorescens, notando que diafentiurón tuvo algún efecto inhibidor sobre el crecimiento micelial de T. viride, pero ningún efecto sobre P. fluorescens. Por lo tanto, pueden ser utilizados simultáneamente para el control de insectos plaga y enfermedades de las semillas transmitidas por el suelo.
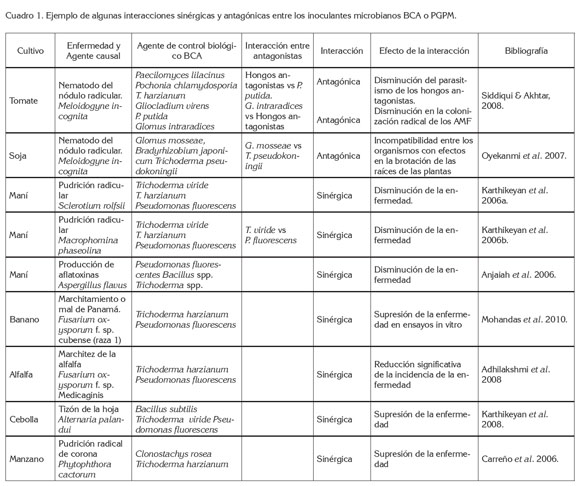
Por otra parte, el sulfato de manganeso puede ser utilizado en mezcla con T. harzianum para el control de Fusarium oxysporum en plantas de alfalfa, notando que es posible el uso de algunos fertilizantes en mezcla con antagonistas de patógenos del suelo y que esta práctica muestra la compatibilidad de los recursos utilizados (Adhilakshmi et al. 2008). Al respecto, Siddiqui & Akhtar (2008) mencionan que la adición de abonos orgánicos puede mejorar la multiplicación y la eficiencia de los hongos antagónicos en la rizósfera. Incluso, en programas de revegetalización en zonas con altos contenidos de Fe, la doble inoculación de rizobios y AMF presentaron un efecto sinérgico, que benefició el crecimiento de las especies vegetales, debido al aumento en la absorción de nitrógeno y de fósforo, estimado en la biomasa de las plantas, que se tradujo en un índice de aumento en la disponibilidad de nutrientes en el suelo, la supervivencia de las plantas, los contenidos de materia orgánica del suelo y la capacidad de retención de agua (Matias et al. 2009). Otros ejemplos al respecto de las interacciones sinérgicas o antagónicas entre los inoculantes microbianos BCA o PGPM, se muestran en el cuadro 1.
No cabe duda de la complejidad de las interacciones entre microorganismos, específicamente AMF, Trichoderma y Pseudomonas; de hecho, se pueden encontrar, normalmente, relaciones antagónicas o sinérgicas en cuanto al establecimiento, adaptación y proliferación de las especies en la rizósfera, mediado o modulado por la producción de compuestos antibióticos por parte de los microorganismos. Por ejemplo, Trichoderma produce compuestos anti-fúngicos, que deprimen la colonización radicular por parte de los AMF y, por el contrario, exudados del micelio de los AMF, pueden estimular la presencia de bacterias, como Pseudomonas, en la rizósfera. Por otra parte, es fundamental entender que aunque se manifieste este tipo de distorsiones en la comunidad microbiana adyacente a las raíces de las plantas, los efectos en el beneficio de las plantas, debida a la co-inoculación, se mantiene, logrando proporcionar un control de enfermedades y una estimulación del crecimiento de las plantas. Es posible que las acciones de estos microorganismos sean complementarias en el beneficio para las plantas aun cuando la competencia de las especies se presente.
Sin embargo, todo este proceso no solamente está mediado por la interacción de los microorganismos, sino por las condiciones del entorno que hacen posible que los beneficios de los inoculantes se expresen en las especies vegetales.
Es difícil entender por completo el funcionamiento de un sistema biológico (Brimner & Boland, 2003). La complejidad de las interacciones planta-suelo-microorganismos-ambiente son variadas; una comprensión completa de todas las relaciones en cuestión es poco probable; sin embargo, los efectos benéficos de las interacciones biológicas que estimulan los rendimientos de los cultivos y mejoran la sanidad de las plantas pueden ser evaluados y quedar en evidencia algunas estrategias generales de la interacción (Sturz & Christie, 2003).
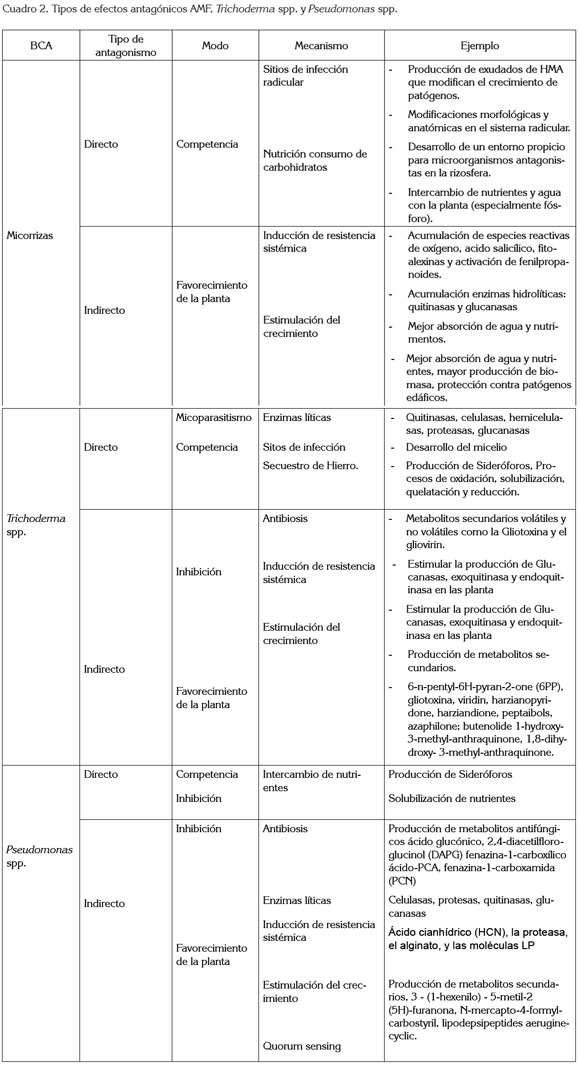
No solamente los factores mencionados son importantes para el desarrollo de las interacciones entre planta-suelomicroorganismos- ambiente; algunas prácticas culturales, como la mecanización, la rotación de cultivos, la utilización del riego, entre otras, modulan la interacción (Douds & Millner, 1999). De igual forma, la amplia variación genética dentro de especies de microorganismos, al igual que en las plantas, explica la necesidad de desarrollar combinaciones específicas de las cepas microbianas con mayor eficacia para una especie vegetal y para conocer la respuesta de éstas en diferentes condiciones ambientales (Malusa et al. 2007). Incluso, en plantas dioicas o monoicas, la interacción con los microorganismos difiere, aunque rara vez ha sido estudiado (Varga & Kyöviita, 2010). Otro aspecto, son las prácticas de fertilización, las cuales, han demostrado modular la eficiencia de la simbiosis AMF respecto al efecto benéfico en el crecimiento de las plantas (Sharma & Adholeya, 2004); no obstante, poco se sabe sobre el efecto de la fertilización foliar sobre las relaciones entre los microorganismos de la rizósfera y las plantas. La fertilización foliar parece afectar también este tipo de interacciones (cuadro 2) (Malusa et al. 2007).
De acuerdo a lo anterior, en la figura 2, se propone un esquema que integre y que trate de explicar los factores que modulan la interacción planta-suelo-microorganismos-ambiente; la parte superior derecha de la figura hace referencia a la importancia de la genética, tanto de las plantas como de los microorganismos, para el reconocimiento mutuo planta-microorganismos. La competencia de las plantas inter e intraespecífica (tipo o especie vegetal), interviene en el desarrollo de las interacciones entre las plantas y los microorganismos, sean estas benéficas o patogénicas. Las condiciones ambientales, como la temperatura, la luminosidad, la precipitación y la humedad relativa modulan directamente el desarrollo de los microorganismos en el suelo y el crecimiento de las plantas, por ende, la interacción entre estos organismos también se ve afectada. De igual forma, la intervención antrópica en los sistemas de producción agrícola puede alterar, la dinámica natural de las interacciones planta-microorganismo. Factores abióticos, como las características físicas y químicas del suelo, que se registran en la parte inferior de la figura, intervienen directamente en el desarrollo de cualquier tipo de interacción, entre las plantas y los microorganismos.
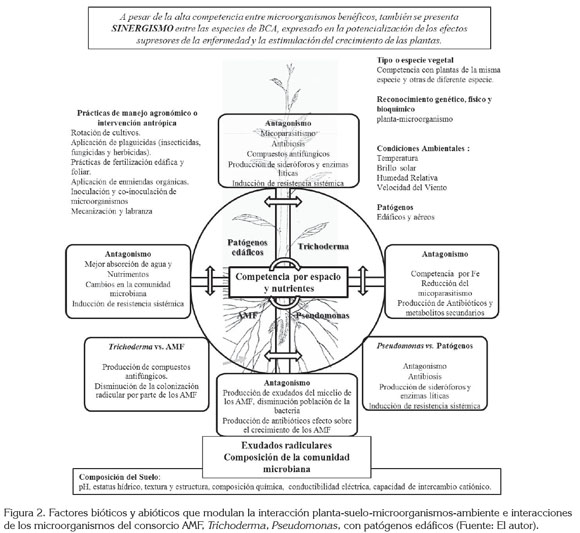
La interacción del consorcio AMF, Trichoderma, Pseudomonas con patógenos edáficos y las plantas, se plantea como tema central en la figura; las especies de los microorganismos mencionados compiten por ocupación de espacio y de nutrientes en la rizósfera de la planta; a su vez, la planta regula las comunidades microbianas, mediante la producción de exudados radicales y el reconocimiento genético y fisiológico con los microorganismos. Se muestra el efecto antagónico de cada una de las especies de BCA, sobre los patógenos edáficos. También se muestran los posibles efectos antagónicos entre las especies de BCA. Por último, en la parte superior de la figura, de forma concluyente, se menciona que, a pesar de presentarse una compleja interacción entre los BCA, se pueden utilizar en conjunto, aportando múltiples beneficios para el desarrollo de las especies vegetales.
Tipo, modo y mecanismos de acción comunes entre AMF, Trichoderma y Pseudomonas
En el cuadro 2, se condensan las estrategias funcionales, como tipo de antagonismo, modo y mecanismos de acción de algunos BCA, como: hongos formadores de micorrizas (Brimner & Boland, 2003; Selosse et al. 2004; Pozo & Azcón- Aguilar, 2007; Avis et al. 2008; Wehner et al. 2010), hongos antagonistas, como Trichoderma spp. (Melo et al. 1997; Brimner & Boland, 2003; Harman et al. 2004; Harman, 2006; García et al. 2006; Karthikeyan et al. 2006b; Olson & Benson, 2007; Verma et al. 2007; Bailey et al. 2008; Vinale et al. 2008b; Hoyos et al. 2008; Hoyos et al. 2009; Ruano & López, 2009; López-Mondéjar et al. 2011) y bacterias, como Pseudomonas spp. (Fakhouri et al. 2001; Lugtenberg et al. 2001; Spencer et al. 2003; Costa et al. 2006; Ji et al. 2006; Kaur et al. 2006; Bardas et al. 2009; Berry et al. 2010; Brown, 2010; Fgaier & Eberl, 2010; Okubara et al. 2010).
Conclusiones: Los microorganismos analizados AMF, Trichoderma spp. y Pseudomonas spp. de forma individual y en mezclas, aportan beneficios importantes para las plantas, como la estimulación del crecimiento y la supresión de enfermedades, notando que la utilización de estos microorganismos es de amplio espectro, en cuanto a las especies vegetales, que abarca y los patógenos que regula.
La estimulación del crecimiento vegetal es posible con el uso de PGPM, bien sea por el aporte de agua y de nutrimentos, como en el caso de los AMF (aumento en la exploración del suelo, más allá de la zona de agotamiento de nutrientes y agua) o en la solubilización de compuestos orgánicos y la producción de metabolitos secundarios, que actúan de forma análoga a las fitohormonas, lo cual, influyen directamente en la disponibilidad de nutrientes y en la estimulación del crecimiento vegetal, como en el caso de Pseudomonas spp. y Trichoderma spp.
En cuanto a la utilización de estos microorganismos, como BCA, se puede indicar que manejan diversos tipos, modos y mecanismos de acción, relacionados con la competencia por espacio y por nutrientes; el parasitismo y la producción de compuestos antimicrobianos, que regulan y modifican la composición de la comunidad microbiana del suelo, aportando así protección contra patógenos edáficos. De igual forma, la estimulación de los mecanismos de defensa natural de las plantas, mediante la inducción de resistencia por el uso de estos inoculantes, confieren tolerancia a patógenos aéreos.
Por otra parte, estos inoculantes, las enzimas, las hormonas y los metabolitos secundarios sintetizados por ellos, pueden ser utilizados como elicitores o efectores biológicos, contribuyendo, de esta manera, a una producción más limpia y sostenible en los sistemas agrícolas.
Queda en evidencia que se pueden presentar interacciones sinérgicas o antagónicas entre las diversas combinaciones de microorganismos benéficos, que pueden repercutir directamente en la funcionalidad de éstos, como BCA o PGPM y en la expresión del benéfico, en el crecimiento de las especies vegetales; sin embargo, este tipo de análisis es complejo y requiere de investigaciones más específicas.
Se observó que las interacciones de los microorganismos que conformaban este consorcio, de acuerdo al análisis, registraban interacciones antagónicas en cuanto a la eficiencia de las especies, entendida como la adaptación y proliferación de Pseudomonas spp. y Trichoderma spp. en la rizósfera de las plantas o de la colonización de las raíces de las plantas, por parte de los AMF, las cuales, en muchos casos, se vio reducida; no obstante, en cuanto a la efectividad, entendida como la expresión de los efectos benéficos en las plantas, en todos los casos, las mezclas de estos inoculantes contribuyen al control biológico de patógenos y a la estimulación del crecimiento vegetal.
Por último, es necesario realizar pruebas bioquímicas, fisiológicas, metabólicas, moleculares, celulares e, incluso, genéticas para poder dilucidar las posibles interacciones sinérgicas y antagónicas entre especies de microorganismos y su efecto en la funcionalidad expresada en los diferentes beneficios para las plantas.
BIBLIOGRAFÍA
1. ADHILAKSHMI, M.; KARTHIKEYAN, M.; ALICE, D. 2008. Effect of combination of bio-agents and mineral nutrients for the management of alfalfa wilt pathogen Fusarium oxysporum f. sp. medicaginis. Phytopath. 99:274-281.
2. AKHTAR, M.S.; SIDDIQUI, Z.A. 2008. Biocontrol of a root-rot disease complex of chickpea by Glomus intraradices, Rhizobium sp. and Pseudomonas straita. Crop Prot. 27:410-417.
3. ALIYE, N.; FININSA, C.; HISKIAS, Y. 2008. Evaluation of rhizosphere bacterial antagonists for their potential to bioprotect potato (Solanum tuberosum) against bacterial wilt (Ralstonia solanacearum). Biol. Control. 47:282-288.
4. ALVES S., H.S.; DA SILVA R., R.; MACAGNAN, D.; DE ALMEIDA H.V, B.; BARACAT P., M.C.; MOUNTEERD, A. 2004. Rhizobacterial induction of systemic resistance in tomato plants: non-specific protection and increase in enzyme activities. Biol. Control. 29:288-295.
5. ANJAIAH, V.; THAKUR, R.P.; KOEDAM, N. 2006. Evaluation of bacteria and Trichoderma for biocontrol of pre-harvest seed infection by Aspergillus flavus in groundnut. Biocontrol Sci. Techn. 16(4):431-436.
6. AVIS, T.J.; GRAVEL, V.; ANTOUN, H.; TWEDDELL, R.J. 2008. Multifaceted beneficial effects of rhizosphere microorganisms on plant health and productivity. Soil Biology & Biochem. 40:1733-1740.
7. BAE, Y.S.; KNUDSEN, G.R. 2005. Soil microbial biomass influence on growth and biocontrol efficacy of Trichoderma harzianum. Biol. Control. 32:236-242.
8. BAILEY, B.A.; BAE, H.; STREM, M.D.; CROZIER, J; THOMAS, S.E.; SAMUELS, G.J.; VINYARD, B.T.; HOLMES, K.A. 2008. Antibiosis, mycoparasitism, and colonization success for endophytic Trichoderma isolates with biological control potential in Theobroma cacao. Biol. Control. 46:24-35.
9. BARDAS, G.A.; LAGOPODI, A.L.; KADOGLIDOU, K.; TZAVELLA-KLONARI, K. 2009. Biological control of three Colletotrichum lindemuthianum races using Pseudomonas chlororaphis PCL1391 and Pseudomonas fluorescens WCS365. Biol. Control. 49:139-145.
10. BEAUCHAMP, V.B.; WALZ, C.; SHAFROTH, P.B. 2009. Salinity tolerance and mycorrhizal responsiveness of native xeroriparian plants in semi-arid western USA. Applied Soil Ecology. 43:175-184.
11. BENNETT, A.J.; WHIPPS, J.M. 2008. Beneficial microorganism survival on seed, roots and in rhizosphere soil following application to seed during drum priming. Biol. Control. 44:349-361.
12. BERRY, C.; DILANTHA, F.W.G.; LOEWEN, P.C.; de KIEVIT, T.R. 2010. Lipopeptides are essential for Pseudomonas sp. DF41 biocontrol of Sclerotinia sclerotiorum. Biol. Control. 55:211-218.
13. BHARADWAJ, D.P.; LUNDQUIST, P-O,; ALSTRÖMA, S. 2008. Arbuscular mycorrhizal fungal spore-associated bacteria affect mycorrhizal colonization, plant growth and potato pathogens. Soil Biology & Biochemistry. 40:2494-2501.
14. BRIMNER, T.A.; BOLAND, G.J. 2003. A review of the non-target effects of fungi used to biologically control plant diseases. Agric. Ecosyst. Environ. 100:3-16.
15. BROWN, D. 2010. A mathematical model of the Gac/ Rsm quorum sensing network in Pseudomonas fluorescens. Biosystems. 101:200-212.
16. CARREÑO P., A.J.; BLANCO, V.J.O.; VILLEGAS, E.B. 2006. Selección de hongos biocontroladores de Phytophthora cactorum, agente causal de la pudrición radical y de corona en manzano. Agron. 14(1):89-96.
17. CHANDANIE, W.A.; KUBOTA, M.; HYAKUMACHI, M. 2009. Interactions between the arbuscular mycorrhizal fungus Glomus mosseae and plant growth-promoting fungi and their significance for enhancing plant growth and suppressing damping-off of cucumber (Cucumis sativus L.). Applied Soil Ecology. 41:336-341.
18. CHEUNG, K.C.; ZHANG, J.Y.; DENG, H.H.; OU, Y.K.; LEUNG, H.M.; WU, S.C.; WONG, M.H. 2008. Interaction of higher plant (jute), electrofused bacteria and mycorrhiza on anthracene biodegradation. Bioresource Technology. 99:2148-2155.
19. COSTA, R.; GOMES, N.C.M.; PEIXOTO, R.S.; RUMJANEK, N.; BERG, G.; MENDONÇA-HAGLER, L.C.S.; SMALLA, K. 2006. Diversity and antagonistic potential of Pseudomonas spp. associated to the rhizosphere of maize grown in a subtropical organic farm. Soil Biology & Biochemistry. 38:2434-2447.
20. DOUDS, D.D., Jr.; MILLNER, P.D. 1999. Biodiversity of arbuscular mycorrhizal fungi in agroecosystems. Agric. Ecosys. Environ. 74:77-93.
21. F AKHOURI, W.; WALKER, F.; VOGLER, B.; ARMBRUSTER, W.; BUCHENAUER, H. 2001. Isolation and identification of N-mercapto-4-formylcarbostyril, an antibiotic produced by Pseudomonas fluorescens. Phytochem. 58:1297-1303.
22. F GAIER, H.; EBERL, H.J. 2010. A competition model between Pseudomonas fluorescens and pathogens via iron chelation. J. Theoret. Biol. 263:566-578.
23. F GAIER, H.; FEHER, B.; MCKELLAR, R.C.; EBERL, H.J. 2008. Predictive modeling of siderphore production by Pseudomonas fluorescensunder iron limitation. J. Theoret. Biol. 251:348-362.
24. F INLAY, R.D. 2004. Mycorrhizal fungi and their multifunctional roles. Mycologist. 18:91-96.
25. F RANKEN, P.; DONGES, K.; GRUNWALD, U.; KOST, G.; REXER, K.H.; TAMASLOUKH, M.; WASCHKE, A.; ZEUSKE, D. 2007. Gene expression analysis of arbuscule development and functioning Phytochem. 68:68-74.
26. GARCÍA, R.; RIERA, R.; ZAMBRANO, C.; GUTIÉRREZ. L. 2006. Desarrollo de un fungicida biológico a base de una cepa del hongo Trichoderma harzianum proveniente de la región andina venezolana. Fitosanidad. 10(2):115-121.
27. GERA H., W.H.; COOK, R. 2005. An overview of arbuscular mycorrhizal fungi–nematode interactions. Basic and Applied Ecology. 6:489-503.
28. GOSLING, P.; HODGE, A.; GOODLASS, G.; BENDING, G.D. 2006. Arbuscular mycorrhizal fungi and organic farming Agric. Ecosyst. Environ. 113:17-35.
29. GRYNDLER, M.; VOSÁTKA, M.; HRŠELOVÁ, H.; CATSKÁ, V.; CHVÁTALOVA, I.; JANSA, J. 2002. Effect of dual inoculation with arbuscular mycorrhizal fungi and bacteria on growth and mineral nutrition of strawberry. J. Plant Nutr. 25:1342-1358.
30. GUO, J.H.; QI, H.Y.; GUO, Y.H.; GE, H.L.; GONG, L.Y.; ZHANG, L.X.; SUN, P.H. 2004. Biocontrol of tomato wilt by plant growth-promoting rhizobacteria. Biol. Control. 29:66-72.
31. HARMAN, G.E.; PETZOLDT, R.; COMIS, A.; CHEN, J. 2004. Interactions Between Trichoderma harzianum strain T22 and maize inbred line Mo17 and effects of these interactions on diseases caused by Pythium ultimumi and Colletotrichum graminicola. Phytopath. 94:147-153.
32. HARMAN, G.E. 2006. Overview of mechanisms and uses of Trichoderma spp. Phytopath. 96:190-194.
33. HAUSE, B.; MROSK, C.; ISAYENKOV, S.; STRACK, D. 2007. Jasmonates in arbuscular mycorrhizal interactions. Phytochem. 68:101-110.
34. HAUSE, B.; SCHAARSCHMID, S. 2009. The role of jasmonates in mutualistic symbioses between plants and soil-born microorganisms. Phytochem. 70:1589-1599.
35. HOITINK, H.A.J.; MADDEN, L.V.; DORRANCE, A.E. 2006. Systemic resistance induced by Trichoderma spp.: Interactions between the host, the pathogen, the biocontrol agent, and soil organic matter quality. Phytopath. 96:186-189.
36. HOWELL, C.R.; PUCKHABER, L.S. 2005. A study of the characteristics of "P" and "Q" strains of Trichoderma virens to account for differences in biological control efficacy against cotton seedling diseases. Biol. Control. 33:217-222.
37. HOWELL, C.R. 2006. Understanding the mechanisms employed by Trichoderma virens to effect biological control of cotton diseases. Phytopath. 96(2):178-180.
38. HOYOS C., L.M.; CHAPARRO, P.; ABRAMSKY, M.; CHET, I.; ORDUZ, S. 2008. Evaluación de aislamientos de Trichoderma spp. contra Rhizoctonia solani y Sclerotium rolfsii bajo condiciones in vitro y de invernadero. Agron. Col. 26(3):451-458.
39. HOYOS C., L.M.; ORDUZ, S.; BISSETT, J. 2009. Growth stimulation in bean (Phaseolus vulgaris L.) by Trichoderma. Biol. Control. 51:409-416.
40. JETIYANON, K.; KLOEPPER, J.W. 2002. Mixtures of plant growth-promoting rhizobacteria for induction of systemic resistance against multiple plant diseases. Biol. Control. 29:34-42.
41. JI, P.; CAMPBELL, H.L.; KLOEPPER, J.W.; JONES, J.B.; SUSLOW, T.V.; WILSON, M. 2006. Integrated biological control of bacterial speck and spot of tomato under Weld conditions using foliar biological control agents and plant growth-promoting rhizobacteria. Biol. Control. 36:358-367.
42. KAPOOR, R.; SHARMA, D.; BHATNAGAR, A.K. 2008. Arbuscular mycorrhizae in micropropagation systems and their potential applications. Scientia Horticulturae. 116:227-239.
43. KARTHIKEYAN, V.; SANKARALINGAM, A.; NAKKEERAN, S. 2006a. Management of groundnut root rotwith biocontrol agents and organic amendments. Phytopathology and Plant Protection. 39(3):215-223.
44. KARTHIKEYAN, V.; SANKARALINGAM, A.; NAKKEERAN, S. 2006b. Biological control of groundnut stem rot caused by Sclerotium rolfsii (Sacc.). Phytopathology and Plant Protection. 39(3):239-246.
45. KARTHIKEYAN, M.; RADHIKA, K.; BHASKARAN, R.; MATHIYAZHAGAN, S.; SANDOSSKUMAR, R.; VELAZHAHAN, R.; ALICE, D. 2008. Biological control of onion leaf blight disease by bulb and foliar application of powder formulation of antagonist mixture. Phytopathology and Plant Protection. 41(6):407-417.
46. KAUR, R.; MACLEOD, J.; FOLEY, W.; NAYUDU, M. 2006. Gluconic acid: An antifungal agent produced by Pseudomonas species in biological control of take-all. Phytochem. 67:595-604.
47. LATHA, P.; ANAND, T.; RAGUPATHI, N.; PRAKASAM, V.; SAMIYAPPAN, R. 2009. Antimicrobial activity of plant extracts and induction of systemic resistance in tomato plants by mixtures of PGPR strains and Zimmu leaf extract against Alternaria solani. Biol. Control. 50:85- 93.
48. LEANDRO, L.F.S.; GUZMAN, T.; FERGUSON, L.M.; FERNANDEZ, G.E.; LOUWS, F.J. 2007. Population dynamics of Trichoderma in fumigated and compostamended soil and on strawberry roots. Applied Soil Ecology. 35:237-246.
49. LIOUSSANNE, L.; PERREAULT, F.; JOLICOEUR, M.; STARNAUD, M. 2010. The bacterial community of tomato rhizosphere is modified by inoculation with arbuscular mycorrhizal fungi but unaffected by soil enrichment with mycorrhizal root exudates or inoculation with Phytophthora nicotianae. Soil Biology & Biochemistry. 42:473-483.
50. LÓPEZ-MONDÉJAR, R.; ROS, M.; PASCUAL, J.A. 2011. Mycoparasitism-related genes expression of Trichoderma harzianum isolates to evaluate their efficacy as biological control agent. Biol. Control. 56(1):59-66.
51. LUGTENBERG, B.J.J.; DEKKERS, L.; BLOEMBERG, G.V. 2001. Molecular determinants of rhizosphere colonization by Pseudomonas. Ann. Rev. Phytopathol. 39:461-90.
52. MALUSA, E.; SAS-PASZT, L.; POPINSKA, W.; ZURAWICZ, E. 2007. The Effect of a Substrate Containing Arbuscular Mycorrhizal fungi and rhizosphere microorganisms (Trichoderma, Bacillus, Pseudomonas and Streptomyces) and foliar fertilization on growth response and rhizosphere pH of three strawberry cultivars. Internal J. Fruit Sci. 6(4):25-41.
53. MARSCHNER, P.; TIMONEN, S. 2005. Interactions between plant species and mycorrhizal colonization on the bacterial community composition in the rhizosphere. Applied Soil Ecology. 28:23-36.
54. MATIAS, S.R.; PAGANO, M.C.; MUZZI, F.C.; OLIVEIRA, C.A.; CARNEIRO, A.A.; HORTA, S.N.; SCOTTI, M.R. 2009. Effect of rhizobia, mycorrhizal fungi and phosphate-solubilizing microorganisms in the rhizosphere of native plants used to recover an iron ore area in Brazil. European J. Soil Biology. 45:259-266.
55. MELO, I.S.; FAULL, J.L.; GRAEME-COOK, K.A. 1997. Relationship between in vitro cellulase production of uv-induced mutants of Trichoderma harzianum and their bean rhizosphere competence. Mycol. Res. 101(11):1389-1392.
56. MOHANDAS, S.; MANJULA, R.; RAWAL, R.D.; LAKSHMIKANTHA, H.C.; CHAKRABORTY, S.; RAMACHANDRA, Y.L. 2010. Evaluation of arbuscular mycorrhiza and other biocontrol agents in managing Fusarium oxysporum f. sp. Cubense infection in banana cv. Neypoovan. Biocontrol Sci. Techn. 20(2):165-181.
57. MOMMAERTS, V.; PLATTEAU, G.; BOULET, J.; STERK, G.; SMAGGHE, G. 2008. Trichoderma-based biological control agents are compatible with the pollinator Bombus terrestris: A laboratory study. Biol. Control 46: 463-466.
58. NEUHAUSER, C.; FARGIONE, J.E. 2004. A mutualism– parasitism continuum model and its application to plant–mycorrhizae interactions. Ecological Modelling. 177:337-352.
59. OKUBARA, P.A.; CALL, D.R.; KWAK, Y.S.; SKINNER, D.Z. 2010. Induction of defense gene homologues in wheat roots during interactions with Pseudomonas fluorescens. Biol. Control. 55:118-125.
60. OLSON, H.A.; BENSON, D.M. 2007. Induced systemic resistance and the role of binucleate Rhizoctonia and Trichoderma hamatum 382 in biocontrol of Botrytis blight in geranium. Biol. Control. 42:233-241.
61. OYEKANMI, E.O.; COYNE, D.L.; FAGADE, O.E.; OSONUBI, O. 2007. Improving root-knot nematode management on two soybean genotypes through the application of BradyRhizobium japonicum, Trichoderma pseudokoningii and Glomus mosseae in full factorial combinations. Crop Prot. 26:1006-1012.
62. POZO, M.A.; AZCÓN-AGUILAR, C. 2007. Unraveling mycorrhiza-induced resistance. Plant Biology. 10:393- 398.
63. RADJACOMMARE, R.; VENKATESAN, S.; SAMIYAPPAN, R. 2010. Biological control of phytopathogenic fungi of vanilla through lytic action of Trichoderma species and Pseudomonas fluorescens. Phytopathology and Plant Protection. 43(1):1-17.
64. RAVNSKOV, S.; JENSEN, B.; KNUDSEN, I.M.B.; BØDKER, L.; JENSEN, D.F.; KARLINSKI, L.; LARSEN, J. 2006 Soil inoculation with the biocontrol agent Clonostachys rosea and the mycorrhizal fungus Glomus intraradices results in mutual inhibition, plant growth promotion and alteration of soil microbial communities. Soil Biology & Biochemistry. 38:3453- 3462.
65. ROSAS, S.B.; VANZINI, G.; CARLIER, E.; PASLUOSTA, C.; PASTOR, N.; ROVERA, M. 2009. Root colonization and growth promotion of wheat and maize by Pseudomonas aurantiaca SR1. Soil Biology & Biochemistry. 41:1802-1806.
66. RUANO R., D.; LÓPEZ H, C.J. 2009. Evaluation of Trichoderma spp. as biocontrol agents against avocado white root rot. Biol. Control. 51: 66-71.
67. SELOSSE, M.A.; BAUDOIN, E.; VANDENKOORNHUYSE, P. 2004. Symbiotic microorganisms, a key for ecological success and protection of plants. C. R. Biologies. 327:639-648.
68. SHARMA, M.P.; ADHOLEYA, A. 2004. Effect of arbuscular mycorrhizal fungi and phosphorus fertilization on the post vitro growth and yield of micropropagated strawberry grown in a sandy loam soil. Can. J. Bot. 82:322-328.
69. SIDDIQUI, I.A.; SHAUKAT, S.S. 2003. Suppression of root-knot disease by Pseudomonas fluorescens CHA0 in tomato: importance of bacterial secondary metabolite, 2,4-diacetylpholoroglucinol. Soil Biology & Biochemistry. 35:1615-1623.
70. SIDDIQUI, Z.A.; AKHTAR, M.S. 2008. Synergistic effects of antagonistic fungi and a plant growth promoting rhizobacterium, an arbuscular mycorrhizal fungus, or composted cow manure on populations of Meloidogyne incognita and growth of tomato. Biocontrol Sci. Techn. 18(3):279-290.
71. SPENCER, M.; RYU, C.M.; YANG, K.Y.; KIM, Y.C.; KLOEPPER, J.W.; ANDERSON, A.J. 2003. Induced defence in tobacco by Pseudomonas chlororaphis strain O6 involves at least the ethylene pathway. Physiological and Molecular Plant Pathology. 63:27-34.
72. STANLEY, J.; CHANDRASEKARAN, S.; PREETHA, G.; KUTTALAM, S. 2010. Physical and biological compatibility of diafenthiuron with micro/macro nutrients fungicides and biocontrol agents used in cardamom. Phytopathology and Plant Protection. 43(14):1396-1406.
73. STURZ, A.V.; CHRISTIE, B.R. 2003. Beneficial microbial allelopathies in the root zone: the management of soil quality and plant disease with rhizobacteria. Soil & Tillage Res. 72:107-123.
74. VARGA, S.; KYTÖVIITA, M.M. 2010. Interrelationships between mycorrhizal symbiosis, soil pH and plant sex modify the performance of Antennaria dioica. Acta Oecologica. 36:291-298.
75. VÁZQUEZ, M.M.; CÉSAR, S.; AZCÓN, R.; BAREA, J.M. 2000. Interactions between arbuscular mycorrhizal fungi and other microbial inoculants (Azospirillum, Pseudomonas, Trichoderma) and their effects on microbial population and enzyme activities in the rhizosphere of maize plants. Applied Soil Ecology. 15:261-272.
76. VERMA, M.; BRAR, S.K.; TYAGI, R.D.; SURAMPALLI, R.Y.; VALÉRO, J.R. 2007. Antagonistic fungi, Trichoderma spp.: Panoply of biological control. Biochemical Engineering J. 37:1-20.
77. VINALE, F.; SIVASITHAMPARAM, K.; GHISALBERTI, E.L.; MARRA, R.; BARBETTI, M.J.; LI, H.; WOO, S.L.; LORITO, M. 2008a. A novel role for Trichoderma secondary metabolites in the interactions with plants. Physiological and Molecular Plant Pathology. 72:80-86.
78. VINALE, F.; SIVASITHAMPARAM, K.; GHISALBERTI, E.L.; MARRA, R.; WOO, S.L.; LORITO, M. 2008b. Trichoderma–plant–pathogen interactions. Soil Biology & Biochemistry. 40:1-10.
79. WALTERS, D.R. 2009. Are plants in the field already induced? Implications for practical disease control. Crop Prot. 28:459-465.
80. WEHNER, J.; ANTUNES, P.M.; POWELL, J.; MAZUKATOW, J.; RILLIG, M.C. 2010. Plant pathogen protection by arbuscular mycorrhizas: A role for fungal diversity? Pedobiologia. 53:197-201.
81. WELC, M.; RAVNSKOV, S.; KIELISZEWSKA-ROKICKA, B.; LARSEN, J. 2010. Suppression of other soil microorganisms by mycelium of arbuscular mycorrhizal fungi in root-free soil. Soil Biology & Biochemistry. 42:1534-1540.
82. WRIGHT, B.; ROWSE, H.R.; WHIPPS, J.M. 2003. Application of Beneficial Microorganisms to Seeds during Drum Priming. Biocontrol Sci. Techn. 13(6):599- 614.
83. YASIR, M.; ASLAM, Z.; KIM, S.W.; LEE, S.W.; JEON, C.O.; CHUNG, Y.R. 2009. Bacterial community composition and chitinase gene diversityof vermicompost with antifungal activity. Bioresource Technology. 100:4396- 4403.
Recibido: Junio 16 de 2011; Aceptado: Octubre 22 de 2011

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.