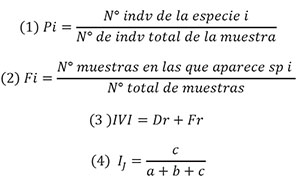
CIENCIAS AGRARIAS-Artículo Científico
CARACTERIZACIÓN DEL BANCO ACTIVO DE SEMILLAS EN CULTIVOS DE ZANAHORIA DEL MUNICIPIO DE VILLA PINZÓN (CUNDINAMARCA)
CHARACTERIZATION OF THE ACTIVE SEED BANK IN CARROT CROPS IN THE MUNICIPALLITY OF VILLA PINZÓN (CUNDINAMARCA)
Zulma Catherine Cardenal Rubio1, David Fernando Torres Hernández2, Mónica Yadira Dotor Robayo3, Ana Cruz Morillo Coronado4
1Ingeniero Agrónomo, M.Sc. Fisiología Vegetal. Universidad Pedagógica y Tecnológica de Colombia UPTC, Grupo Manejo Biológico de Cultivos (GMBC) UPTC, Tunja, Colombia, Diag 58 N° 3 A 21, Santa Ana, Tunja (Boyacá), e-mail: zulma.cardenal@uptc.edu.co.com
2Ingeniero Agrónomo. M.Sc. Fisiología Vegetal, Docente. Universidad de Ciencias Aplicadas y Ambientales U.D.C.A, Grupo de investigación de Ecofisiología Agrícola Tropical, Calle 173 A N° 20a – 32, interior 8 apto 327, Bogotá (Cundinamarca), e-mail: mollisol89@hotmail.com
3Ingeniero Agrónomo, M.Sc Fisiología Vegetal. cPh.D. Ciencias Agrarias Universidad Nacional de Colombia Sede Bogotá, e-mail: mydotorr@unal.edu.co
4 Ingeniero Agrónomo, Ph.D. Fitomejoramiento, Docente FACIAT. Universidad Pedagógica y Tecnológica de Colombia UPTC, Cra 8a N° 45a-33, apto 303, Los Cristales, Tunja (Boyacá), e-mail: ana.morillo@uptc.edu.co
Rev. U.D.C.A Act. & Div. Cient. 19(2): 297-306, Julio-Diciembre, 2016
RESUMEN
La caracterización de la comunidad de malezas asociadas a cultivos permite monitorear el efecto de las actividades humanas sobre los ecosistemas, además de ser base para el establecimiento de estrategias de manejo eficientes. Con el objetivo de caracterizar el banco activo de semillas de dos fincas dedicadas a la producción de zanahoria en el municipio de Villa Pinzón, se recolectaron muestras a tres profundidades; se llevaron al invernadero de la Uptc, donde se mantuvieron a capacidad de campo, para que germinaran las semillas presentes. Cada 15 días, se identificaron las especies emergentes, el número de especies presentes por matero y número de individuos por especie, con el fin de establecer parámetros como coeficiente de Jaccard e índices de diversidad, dominancia y de valor de importancia IVI. Se encontró un total de ocho especies pertenecientes a seis familias (Polygonaceae, Poaceae, Asteraceae, Leguminosae, Chenopodiaceae, Capparidaceae). Para las dos fincas, el índice de diversidad alcanzó un valor máximo de 1,28, mientras que para el de dominancia Simpson, los valores ascendieron a 1; la especie Polygonum segetum registró el IVI más alto, con valores entre 0,32-0,93, además de una abundancia relativa de 0,7 y 0,5, para las dos fincas. El valor para el coeficiente de Jaccard fue de 0,55, indicando que hay similitud en la comunidad de malezas en los primeros 30cm. Luego de 135 días, se observó un agotamiento de poblaciones emergentes. Se concluyó que P segetum es la especie más persistente en tiempo y en las profundidades evaluadas.
Palabras clave: Diversidad, dominancia, similitud, Polygonum segetum.
SUMMARY
The characterization of weed community associated to crops allows to monitor the effect of human activities on ecosystems, besides being the basis for the establishment of efficient management strategies. With the objective to characterize the active seed bank of two farms dedicated to carrot production in the municipality of Villa Pinzón, samples were taken at three depths (0-15; 15-30 y 30- 45cm), carried to the UPTC greenhouse where they were kept at moisture field capacity to germinate the seeds present; emerging species were identified every 15 days, also the number of species present by recipient and the number of individuals per species, were counted in order to apply parameters as the Jaccard coefficient, the diversity index, the dominance and the importance of value IVI value. A total of eight species belonging to six families were registered (Polygonaceae, Poaceae, Asteraceae, Leguminosae, Chenopodiaceae, Capparidaceae). For the two farms the diversity index reaches a maximum value of 1.28, while for the dominance Simpson the values amounted to 1. The species Polygonum segetum recorded the highest IVI values between 0.32 to 0.93, along with a relative abundance of 0.7 and 0.5 for the both properties. The value for the Jaccard coefficient, was 0.55 indicating that there is similarity in the weed community in the first 30cm. After 135 days a depletion of the emerging populations was observed. It was concluded that P segetum is the most persistent weed in time and in the depths evaluated.
Key words: Diversity, dominance, similarity, Polygonum segetum.
INTRODUCCIÓN
La zanahoria (Daucus carota L.) es una especie de zonas templadas, pero se cultiva en regiones tropicales y subtropicales, especialmente, en clima frio (Méndez & Richmond,2010); el cultivo, se ha extendido en casi todo el mundo (SIPSA, 2015), con una producción superior a los 14 millones de toneladas (Méndez & Richmond, 2010). Colombia es el cuarto país productor de Suramérica, con 300.000t, según la Encuesta Nacional Agropecuaria (ENA) y los departamentos de Cundinamarca, de Boyacá, de Nariño y de Antioquia aportan más del 98% de la producción total; en el 2013, se sembraron cerca de 5.000 hectáreas, de las cuales, el 53% se realizaron en Cundinamarca, seguido por los otros tres departamentos mencionados (SIPSA, 2015).
El rendimiento del cultivo disminuye por efecto de malezas asociadas, que interfieren con las actividades agrícolas y han sido definidas como plantas que presentan riesgos actuales o potenciales para sus intereses económicos; además, se reconocen por generar daños a los cultivos especies que cuentan con habilidades competitivas que garantizan su permanencia en los agroecosistemas (Zimdahl, 2007); dicha competencia en asociaciones cultivomaleza está dada por diversos factores, como agua, luz, nutrientes y espacio. En este contexto, la presión de selección influencia la aparición de algunas de las características que las hace más exitosas, entre éstas, la capacidad de reproducirse, colonizar, invadir e infestar nuevas áreas (Fujisaka et al. 2000); las malezas poseen métodos de dispersión primaria y secundaria, que permiten que las semillas tengan una distribución, tanto vertical como horizontal en el suelo. A ese conjunto de semillas que contribuye con el establecimiento de estas poblaciones en el agro-ecosistema, se le denomina banco de semillas de malezas (Murphy & Swanton, 2003; Nuñez et al. 2014).
Estos bancos son la primera fuente de regeneración y de mantenimiento de la vegetación en los agro-ecosistemas; se sabe que el establecimiento de las malezas está determinado por la cantidad de semillas viables en el suelo y se estima que se presentan hasta 1.000.000 semillas m2 con alto potencial de germinación (Mortimer, 2002). Los bancos de semillas de malezas en el suelo, se pueden clasificar como transitorios y persistentes. Los primeros, representados por semillas de poaceas, especies que por su ciclo de vida germinan en el mismo año en el que se producen y no persisten en el suelo por más de un año y, los segundos, compuestos por semillas de especies que ocupan un amplio rango de hábitats que persisten por más tiempo, dado que tienen algún tipo de latencia (Acosta & Agüero, 2001).
La distribución vertical de las semillas en el banco está dada por las características físicas del suelo, tamaño de semillas, por el tipo y frecuencia de labranza; en este sentido, Keblawy & Bhatt (2015) afirman que la densidad de semillas disminuye, pero su viabilidad es mayor a grandes profundidades. Desde el punto de vista de protección a los cultivos, los objetivos del manejo de malezas, según Zimdahl (2007), deben ir enfocados a disminuir el daño causado por la malezas y la densidad de estas poblaciones a niveles tolerables, e intentar que la composición de sus comunidades sean lo menos agresivas posibles; entonces, la comprensión de la biología y de la dinámica de estas plantas, constituye el primer paso para el establecimiento de un manejo integrado de malezas (Radosevich & Ghersa, 2007), más aún cuando su presencia en campos de cultivo es el reflejo de las prácticas culturales en sistemas agrícolas (Gámez et al 2014).
Los estudios de biodiversidad aportan parámetros para analizar una comunidad y son de utilidad para medir y monitorear el efecto de las actividades humanas sobre ecosistemas (Melo & Vargas, 2003). La biodiversidad, a nivel de especies vegetales, puede ser medida por la diversidad alfa, que aporta información acerca de la riqueza específica y la distribución de las mismas, dentro de una comunidad. Los indicadores de biodiversidad son base para la toma de decisiones de manejo, además de constituir un sistema de alerta temprana, que puede predecir el comportamiento de una comunidad en el tiempo (Moreno, 2001). Dentro de los índices más empleados para el análisis de agro-ecosistemas se encuentran: el índice de dominancia -Simpson-, índice de equidad -Shannon Wiener-, que evalúan qué tan homogénea o biodiversa es una comunidad; el de similitud -coeficiente de Jaccard-, que expresa el grado en el que dos muestras son semejantes por las especies presentes y el índice de valor de importancia (IVI), que permite asignar una categoría a cada especie, de acuerdo a su importancia relativa (Tauseef et al 2012).
Los estudios con relación al comportamiento de las poblaciones de malezas en el agroecosistema son importantes, pues son base para el establecimiento de programas de manejo eficiente; de igual forma, aportan información de las pérdidas en producción causadas por efecto de la competencia. En este sentido, Dotor Robayo & Cabezas Gutiérrez (2015) reportan que el cultivo de zanahoria libre de malezas puede alcanzar una producción por hectárea de 45,524t, mientras que cuando la planta compite por recursos, como agua con malezas, se evidencian pérdidas de hasta un 42,95%, razón por la cual, es apremiante continuar con investigaciones que den cuenta de cuáles son las especies que acompañan el cultivo, investigaciones que incluyan estudios de biodiversidad y que permitan medir y monitorear el efecto de las actividades humanas sobre el desarrollo y evolución de estas poblaciones en los agroecosistemas. En este contexto, el objetivo de este trabajo fue evaluar el banco de semillas, a tres profundidades, en dos fincas productoras de zanahoria, en el municipio de Villa Pinzón, Cundinamarca.
MATERIALES Y MÉTODOS
La investigación, se llevó a cabo en el municipio de Villa Pinzón, ubicado a 05° 13' 09'' de latitud Norte y 73° 36'00'' de longitud Oeste, en el altiplano Cundiboyacense, con altitud de 2715msnm, temperatura promedio de 13°C y humedad relativa del 75%. Para caracterizar el banco de semillas de suelos con antecedentes en producción de zanahoria, se seleccionaron dos fincas, con más de siete años en la producción de esta hortaliza de la vereda Casablanca, que presentaban características similares en el manejo del cultivo. Para la finca 1, las muestras colectadas se tomaron después de la siembra de zanahoria, mientras que para la finca 2, antes de esta actividad, con el fin de observar si existe variación entre las especies que aparecen luego del establecimiento del cultivo y antes de éste. Para cada una de las fincas, se colectaron 30 muestras de suelo a tres profundidades (0-15, 15-30 y de 30-45cm), diez por cada profundidad; el área muestreada fue de 5000m 2, siguiendo un trazado en forma de W; se utilizó un barreno muestreador para extraer 1kg de suelo, que fue transferido a bolsas de polietileno, debidamente marcadas y selladas, para su inmediato traslado al invernadero de la UPTC, localizada en el departamento de Boyacá, municipio de Tunja, ubicado a 5° 31' 59'' Norte, 73° 22' 1'' Oeste, a una altura sobre el nivel del mar de 2782, con una temperatura interior promedio de 20°C y humedad relativa de 60%.
Las muestras colectadas se homogenizaron, de acuerdo a la profundidad y a la finca a la que pertenecían; se utilizó en total 30 materos plásticos de 3L de capacidad, 5 materos por cada profundidad, para un total de 15 por cada finca; éstos fueron dispuestos aleatoriamente en el invernadero, a distancias de 20cm entre sí; durante todo el experimento, se mantuvieron a capacidad de campo, que es la cantidad máxima de agua que un suelo puede retener o almacenar, bajo condiciones de humedecimiento total, seguido de drenaje libre o gravitacional (Jaramillo, 2002), para su germinación.
La identificación taxonómica de las especies en estado de plántula, se llevó a cabo cada 15 días, mediante conteo sobre la superficie del sedimento de las muestras de suelo hasta que no hubo más emergencia de plántulas, de acuerdo con lo descrito por Ernst & Morici (2013).
Diseño experimental: Se utilizó un diseño en bloques completamente al azar, donde el factor de bloqueo fueron las dos fincas y de los tratamientos, las tres profundidades evaluadas (0-15cm, 15-30cm y de 30-45cm); se establecieron cinco réplicas por cada tratamiento. Se realizaron 9 conteos cada 15 días, donde se llevó registro de las siguientes variables respuesta: identificación de especies presentes, número de especies y número de individuos por especie. Para la identificación de especies presentes, se utilizaron –como guía-, a lo expuesto por Fuentes et al. (2006, 2011). El experimento duro 135 días, hasta que en los materos no germinaron más semillas.
Para establecer la diversidad, la dominancia de especies y la similitud de la diversidad entre lotes, se calcularon los índices de Shannon Wiener, el índice de Simpson, utilizando el programa Past 3 y la Abundancia relativa (1), Frecuencia (2), IVI (3) y coeficiente de Jaccard (4); se cuantificaron mediante las siguientes ecuaciones (Moreno, 2001):
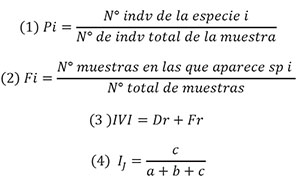
Los datos obtenidos para los índices de dominancia y de diversidad fueron analizados individualmente y sometidos a pruebas de normalidad y de homogeneidad de varianzas; posteriormente, se realizó un análisis de varianza (Anova) y la prueba de Diferencia Mínima Significativa (LSD) al 5%, empleando el programa estadístico R x64 3.2.3, para determinar diferencias significativas entre tratamientos.
RESULTADOS Y DISCUSIÓN
Determinación de especies presentes en el banco de semillas del suelo por finca: En el banco de semillas de las dos fincas, se registraron un total de 8 especies, pertenecientes a seis familias, de las cuales, las más numerosas fueron Polygonaceae y Poaceae, con dos especies cada una (Tabla1); se evidenció que entre fincas existen dos especies que no comparten Rumex acetosella L. y Chenopodium álbum, que se presentaron en la finca dos, pero no en la 1.
Dentro de las malezas más abundantes en cultivos de clima frío en Colombia, Bastidas & López (1972) reportan a Polygonum segetum, P nepalense, Rumex acetosella, Penni- setum clandestinum como las especies más frecuentes en sistemas productivos de hortalizas. Las especies de malezas que se reportan como más limitantes están dentro de las familias Poaceae, Fumariaceae, Chenopodiaceae, Polygonaceae, Amaranthaceae, Malvaceae, (Banda et al 2011); igualmente, Plaza & Pedraza (2007) indican que en sistemas productivos, en el departamento de Boyacá, las especies de malezas con mayor frecuencia en cultivos de zanahoria y en papa pertenecen a las familias Asteraceae, Polygonaceae y Poaceae. En esta investigación, se determinó que Polygonum segetum es la especie que presenta mayor frecuencia relativa en las dos fincas evaluadas, con valores de 0,74, para la finca 1 y con 0,54, para la 2.
Para este estudio, la composición florística hallada en el banco de semillas del suelo concuerda con la reportada en investigaciones anteriores, por lo que se puede afirmar que las especies encontradas hacen parte de la composición típica de malezas asociadas a suelos con antecedentes en sistemas de producción de papa y de zanahoria; de igual forma, se infiere que dichas comunidades de malezas persisten y están compuestas por las mismas especies. Dado que la composición florística de la comunidad está en función del clima, disponibilidad de nutrientes de agua, tipo de suelo, radiación solar y factores antrópicos (Poggio, 2012), se cree que el manejo cultural que el productor emplea en sus cultivos puede ser la causa se esa selección de especies acompañantes.
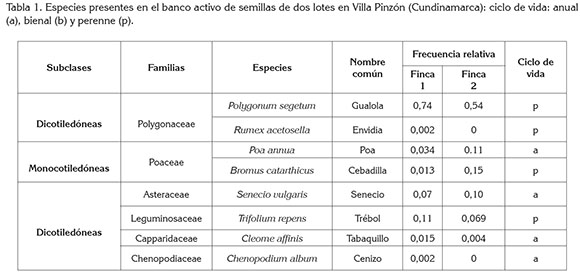
Diversidad y dominancia finca 1: Los índices de diversidad y de dominancia a las tres profundidades evaluadas no presentaron diferencias significativas (p≤0,05); sin embargo, para esta finca, se determinó que el índice de dominancia es mayor en la profundidad de 15-30cm. Este índice es un parámetro que toma en cuenta la representatividad de las especies con mayor presencia en la comunidad (Moreno, 2001) y, en términos prácticos, se puede relacionar con la presencia de una especie agresiva, competitiva, que colonizó e invadió espacios que antes ocupaban otras especies y que, además, es bien representada, con un gran número de individuos, dentro del agro-ecosistema.
Teniendo en cuenta el sistema de labranza usado en cultivos de zanahoria donde se utilizan aperos, como la rotovadora, que invierten los primeros 20cm del suelo, se puede decir que el suelo de los 15 a 30cm, donde se determinó el fenómeno de dominancia al ser invertido, pasara a ser los primeros 15cm de suelo, llevando consigo semillas de la especie agresiva que, bajo condiciones de humedad, de temperatura y de luz adecuadas, representaran un problema para el productor, puesto que competirán con el cultivo. En cuanto al comportamiento de esta variable en el tiempo, se observó que en las tres profundidades evaluadas, durante los primeros 45 días, el índice de dominancia fue mayor que durante los cohortes que van desde los 60 hasta 90 días, donde disminuye, para luego aumentar los últimos 45 días de muestreo (Tabla 2), exponiendo un comportamiento binomial negativo, que puede estar influenciado por factores bióticos, abióticos y antrópicos (Ortiz et al 2009).
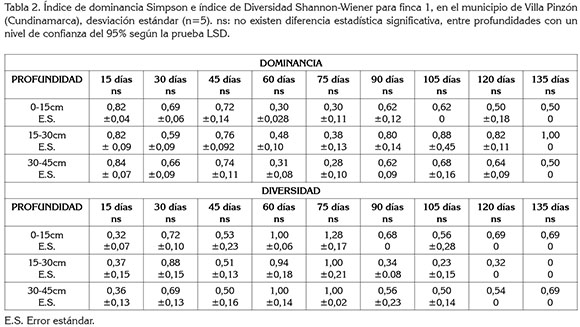
El modelo espacial de los bancos de semillas de suelo, generalmente, presenta una distribución binomial negativa (NBD), lo que significa, para este caso, que en algunos periodos se encontraran muestras representativas de la especie dominante, mientras que en otros, esta especie no, como consecuencia de las características biológicas y de la dinámica de esta especie en el tiempo; esto es un aspecto importante, pues los cultivos deben competir con las malezas por recursos; sin embargo, el momento y periodo en el que se da esta competencia determina el éxito de la especie (Zimdahl,2007). Estos resultados representan un sistema de alerta para el agricultor, pues en los primeros 45 días, donde existen valores más altos de dominancia, el control de malezas requiere de planes de manejo inmediato, dado que el manejo de malezas, en este periodo, es vital para que el cultivo tenga su máxima producción (Radosevich & Ghersa, 2007); igualmente, puede ser el reflejo de las actividades humanas sobre los agro-ecosistemas, que con la presión de selección, ha promovido la pérdida de diversidad y un aumento de la dominancia, a través de las labores culturales.
La menor diversidad a mayor profundidad (15-30 y 30-45cm) (Tabla 2), probablemente, se debe a que la distribución vertical de las semillas en el suelo está influenciada por la compactación del mismo, ya que sólo semillas muy pequeñas pueden ingresar en el perfil, puesto que la mayor parte se encuentran en la superficie, debido a las prácticas de laboreo (Ernst & Morici, 2013). Tradicionalmente, en la zona de Villa Pinzón, el sistema de producción de zanahoria utiliza la labranza secundaria, que incluye aperos, como la rotovadora, niveladoras, arados de disco y rastras, principales aperos, causantes de la resistencia a la penetración, que va de los 20 a 40cm del suelo, como resultado del pie de arado. Esta compactación esta correlacionada con el peso y la forma de trabajo del apero (Taboada & Álvarez, 2008), razón por la cual, en sistemas de producción de zanahoria presenta un alto grado de compactación a esta profundidad.
Cada agro-ecosistema tiene su propio potencial de diversidad, regulado por factores agroclimáticos, características geográficas de la zona, entre otros (Keblawy & Bhatt, 2015); sin embargo, uno de los factores que más influencian el grado de diversidad está relacionado con los objetivos y las características socioculturales de los agricultores, su conocimiento y la valoración de la biodiversidad (Sarandon & Flores, 2014), aspecto que limita su conservación, teniendo en cuenta que muchos agricultores, desconocen los procesos ecológicos que regulan el funcionamiento de un agroecosistema y la importancia que tiene en estos procesos (Stupino et al 2014). El objetivo principal de los sistemas de producción es la especialización de un cultivo y su mantenimiento, con fines económicos; el equilibrio ecológico, en cuanto a diversidad de especies, no es un aspecto significativo para el agricultor; como consecuencia de la eliminación de especies, con el fin de mantener cultivos libres de plantas potencialmente competidoras, se ha promovido un proceso de evolución y de adaptación de especies, que buscan su permanencia y su persistencia en ambientes disturbados, convirtiéndose en malezas con habilidades competitivas, que les garantizan éxito en los agro-ecosistemas.
Diversidad y dominancia finca 2: Los resultados de las variables dominancia y diversidad para la finca 2 (Tabla 3) presentaron un comportamiento similar al de la finca 1. El análisis estadístico tampoco presentó diferencias significativas entre tratamientos (p≤0,05); sin embargo, el índice de Simpson fue mayor en los primeros 45 días de muestreo; el índice de Shannon Wiener, en la profundidad de 30-45cm, desde el día 90 hasta los 120 días del muestreo, presentó valores de cero, lo que indica que la comunidad de malezas del banco activo es representada por una sola especie.
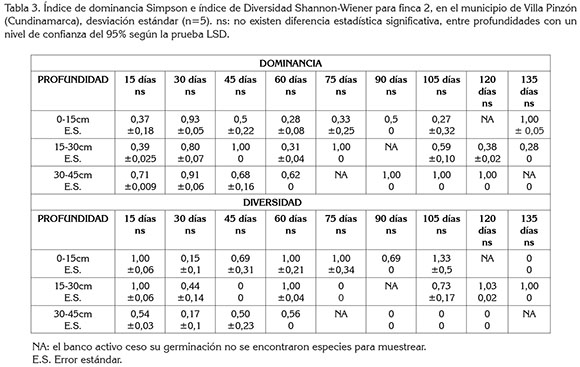
Los resultados sugieren que la dominancia de una de las especies presentes en la comunidad es inminente en los primeros 45 días, teniendo en cuenta que las muestras colectadas de esta finca, se realizaron antes de la siembra de zanahoria; en el evento del establecimiento del cultivo, tanto en los primeros 45 días como en los últimos 60 días del ciclo del cultivo, se presentara la especie dominante, corresponderá a una planta altamente competitiva, agresiva y de difícil manejo. Con relación a lo anterior, Zimdahl (2007) indica que la diversidad, dentro de los agroecosistemas, debe aumentar, precisamente, para evitar estos procesos de selección de especies agresivas.
Los valores más altos para el índice de dominancia, se obtuvieron en las profundidades de 15-30cm y 30-45cm (Tabla 3); por el tipo de labranza empleado y voltear el suelo mediante aperos, como la rotovadora, hace que el suelo de 15 a 30cm quede en la parte superficial del lote, trayendo también consigo las semillas de la especie dominante (Méndez & Richmond, 2010).
El índice Simpson muestra, en las tres profundidades, que en unos periodos aumenta y luego disminuye; este comportamiento puede ser explicado, porque en un sistema de producción hortícola la mecanización incluye prácticas periódicas de roturación completa de los primeros centímetros del suelo (Portela, 2008). A escala de comunidad, esta remoción periódica de la vegetación obliga a que el proceso de re-cambio en la composición de especies de malezas (sucesión) se mantenga en etapas tempranas (Radosevich & Ghersa, 2007). Las especies presentes a mediano plazo serán las mismas, aunque esta composición con el tiempo no sea estable, ya que ciertos cambios se pueden producir en el tiempo, como respuesta a modificaciones graduales en las condiciones del ambiente (empobrecimiento) o pérdida de la biodiversidad, por la aparición de especies de malezas con habilidad para intervenir en las primeras etapas de la sucesión (Portela, 2008).
De acuerdo con lo establecido por Tauseef et al (2012), la dominancia en una población es indicador de la pérdida de biodiversidad, lo que coincide con el comportamiento inversamente proporcional, mencionado por Moreno (2001) y ello se refleja en el aumento de dominancia, al mismo tiempo que disminuye la diversidad en las dos fincas (Tablas 2 y 3). Los resultados encontrados, en general, evidencian una pérdida de la diversidad y coinciden con lo reportado por Gámez et al (2014), quienes afirman que en suelos menos disturbados hay mayor probabilidad de encontrar comunidades más diversas, puesto que los sistemas de labranza afectan la dispersión secundaria de las malezas, a nivel horizontal y vertical.
La importancia de la diversidad de las comunidades de malezas radica en el mantenimiento de la complejidad trófica (Marshall et al 2003). Desde una perspectiva ecológica, Sans (2007) explica que una alternativa para el manejo de estas poblaciones, sin incurrir en la pérdida de especies, es el manejo ecológico. En este sentido, los cultivos de hortalizas deberían incluir baja intensidad de perturbaciones, control pre emergente de las malezas, así como rotaciones con otro tipo de cultivos, para evitar la selección de especies y pérdida de otras (Plaza, 2009).
Índice de valor de importancia (IVI): Plaza & Pedraza (2007) afirman que las la especies con mayor frecuencia en Cundinamarca y en Boyacá fue la dicotiledónea Polygonum nepalense, subclase a la que también pertenece P segetum, especie que presentó mayor frecuencia relativa dentro del banco (0,69) (Tabla 1); por su parte, Saldarriaga et al (2011), la reportan como infestante en cultivos de clima frio. En cuanto al índice de valor de importancia, IVI obtuvo los valores más altos en los dos lotes en todas las profundidades de muestreo (Tabla 4).
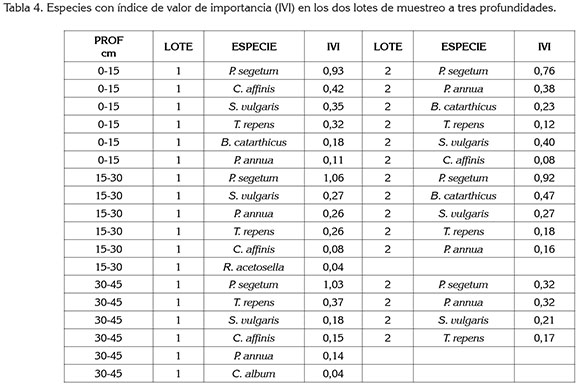
P segetum, probablemente, se ha mantenido en el tiempo por un proceso de adaptación, persistencia, producción de alto número de semillas por planta, latencia y prolongada viabilidad de las mismas (Gámez et al 2011). Es considerada como planta invasora en zonas de alta humedad; en Colombia, se reconoce como maleza de difícil control en cultivos hortícolas, por su alta competitividad y gran habilidad para propagarse, tanto sexual como vegetativamente; a menudo, crecen solas en una comunidad, gracias a su capacidad para prevalecer más que otras especies en tiempo y en espacio (Morales & Guzmán, 2010). Por su parte, Derita et al (2008) afirman que esta especie tiene gran variedad de metabolitos secundarios, como glucósidos, quinonas y terpenos presentes, tanto en tallo como en raíces, con efecto alelopático sobre otras especies, inhibiendo el desarrollo y el crecimiento de éstas. Se desarrolla bien a más de 2000msnm y considerando las condiciones climáticas de la zona donde se colectó el suelo, coinciden con sitios donde se reporta como altamente invasiva.
Coeficiente de Jaccard: El grado de recambio de especies (diversidad beta) tiene en cuenta diferencias, que se pueden evaluar con ayuda de índices (Moreno, 2001). Ese grado de recambio, se midió en las fincas, mostrando que de 0-15cm existe mayor similitud en las especies presentes, contrario a la profundidad de 30-45cm, donde no es mayor al 0,5 (Figura 1). En una región especifica existen factores que regulan la especiación o la extinción de la comunidad de malezas; de esta forma, se puede decir que la composición florística de la comunidad está en función del clima, disponibilidad de nutrientes de agua, tipo de suelo, radiación solar y factores antrópicos (Poggio, 2012). En este orden de ideas y como resultado del coeficiente de similitud entre lotes, el grado de recambio no es mayor en los primeros 30cm, dado que en los dos lotes comparten el mismo sistema de producción, el tipo de vocación y el tipo de labranza convencional.
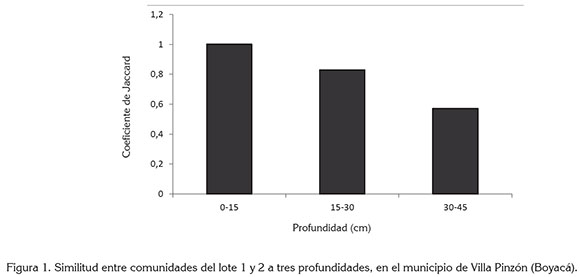
Ortiz et al (2009) encontró que la exclusión de especies de un área se puede presentar por factores ambientales desfavorables, presencia de especies competidoras, mecanismos ineficientes de dispersión de propágulos y propagación vegetativa.
Los resultados obtenidos sugieren que las labores culturales empleadas en estos sistemas de producción favorecen el proceso de selección de especies en los primeros 30cm y que esa selección no sólo conlleva a la extinción de otras, sino que, además, promueve la aparición de especies más competitivas, agresivas y mejor adaptadas, especies que dominan las comunidades y que representan daño económico para el productor, al interferir y competir por recursos con nuestros cultivos. La pérdida de biodiversidad va más allá de una alteración en el agro-ecosistema, pues constituye una problemática para el agricultor que, día a día, se enfrenta a malezas más resistentes a la aplicación de herbicidas, tolerantes, mejor adaptadas y con más oportunidades de sobrevivencia en una ambiente disturbado, entonces, todas aquellas prácticas agronómicas que se realizan en un cultivo deben ir encaminadas a proporcionar un ambiente más diverso, con mayores recursos de hábitat y de alimento, ambientes más estables, que favorecen los procesos de regulación del sistema y presentan menos problemas sanitarios.
Conflicto de intereses: El manuscrito fue preparado y revisado con la participación de todos los autores, quienes declaramos que no existe conflicto de intereses que ponga en riesgo la validez de los resultados presentado. Financiación: Dirección de Investigaciones DIN de la Universidad Pedagógica y Tecnológica de Colombia UPTC, mediante convocatoria 05 de 2015 ''apoyo económico a tesis de maestría'' código SGI: 1789.
BIBLIOGRAFÍA
1. ACOSTA, L.; AGÜERO, R. 2001. EL banco de propágulos de malezas en el agroecosistema: conocimiento actual y propuesta metodológica para su estudio. Agron. Mesoam. 12(2):141-151.
2. BANDA, L.; FUENTES, C.; CHAVES, B. 2011. Producción de semilla de cilantro (Coriandrum sativum L.) bajo la incidencia de malezas y Alternaria nees. Rev. Col. Cienc Hortíc. 5(2):279-294.
3. BASTIDAS, J.; LÓPEZ, G. 1972. Caracteres cuantitativos y reconocimientos de malezas en praderas artificiales de clima frio del altiplano de Pasto. Rev. Ciencias Agrícolas. 4(2):83-97.
4. DERITA, M.; GATTUSO, S.; ZACCHINO, S. 2008. Occurrence of polygodial in species of Polygonum genus belonging to Persicaria section. Biochem. Syst. & Ecol. 36:55-58.
5. DOTOR ROBAYO, M.; MARCO CABEZAS GUTIÉRREZ, M. 2015. Determinación de la habilidad competitiva entre Daucus carota L. y Senecio vulgaris L Rev. U.D.C.A Act. & Div. Cient. 18(1):81-89.
6. ERNST, R.D.; MORICI, E. 2013. Banco de semillas germinable de gramineas del Caldenal diferencias pre y post diseminación. Congreso de Pastizales. Rev. Facultad Agronomía (Argentina). 22(Serie supl. 2):39-44.
7. FUENTES, C.; FUQUENE, A.; PERDOMO, E.; PINTO, C. 2006. Plántulas de especies arvenses frecuentes en la zona centro de Colombia. Ed. Univerisidad Nacional de Colomia, Facultad de Agronomía. 250p.
8. FUENTES, C.; ERASO, E.; SEQUEDA, O.; PIEDRAHITA, W. 2011. Flora arvense del altiplano Cundiboyacense de Colombia. Ed. Universidad Nacional de Colombia, Facultad de Agronomía: Bayer CropScience. 350p.
9. FUJISAKA, S.; ESCOBAR, G.; VENEKLAAS, E. 2000. Weedy fields and forests: interactions between land use and the composition of plant communities in the Peruvian Amazon. Agric. Ecosyst. Environm. 78:175-186.
10. GÁMEZ, A.; GOUVEIA, M.; ALVAREZ, M.; PÉREZ, H. 2014. Flora arvense asociada a un agroecosistema tipo conuco en la comunidad de Santa Rosa de Ceiba Mocha en el estado Guárico. Bioagro. 26(3):177-182.
11. GÁMEZ, A.; HERNÁNDEZ, M.; DÍAZ, R.; VARGAS, J. 2011. Caracterización de la flora arvense asociada un cultivo de maíz bajo riego para producción de jojotos. Agr. Trop. (Colombia). 61(2):133-139.
12. JARAMILLO, D. 2002. Introducción a la ciencia del suelo. Ed. Universidad Nacional de Colombia, Facultad de Ciencias, Medellín. p.203-207.
13. KEBLAWY, A.; BHATT, A. 2015. Aerial seed bank affects germination in two small-seeded halophytes in Arab Gulf desert. J. Arid Enviroments, 117:10-17.
14. MARSHALL, E.; BROWN, V.; BOATMAN, N.; LUTMAN, P.; SQUIRE, G.; WARD, L. 2003. The role of weeds in supporting biological diversity within crop fields. Weed Res. 43:77-89.
15. MELO, O.; VARGAS, R. 2003. Evaluación ecológica y silvicultural de ecosistemas boscosos. Ed. Universidad del Tolima, CRQ, CARDER, CORPOCALDAS, CORTOLIMA. Ibagué. 235p.
16. MÉNDEZ, F.; RICHMOND, C. 2010. Rendimiento de 12 híbridos comerciales de zanahoria (Daucus carota L.) en el campo y en la planta de empaque. Agron. Mesoam. 21(1):167-176.
17. MORALES, A.; GUZMÁN, A. 2010. Compuestos fenólicos presentes en las hojas de la especie colombiana Polygonum segetum Kunth. Bol. Latinoam. Caribe Plantas Medicinales y Aromáticas. 9(4):287-291.
18. MORENO, C. 2001. Métodos para medir la biodiversidad. Ed. Centro de Investigaciones Biológicas, Universidad Autónoma del Estado de Hidalgo, México. 83p.
19. MORTIMER, A. 2002. Clasificación y ecología de las malezas. En: Labrada, R.; Caseley, J. (eds). Manejo de malezas para países en desarrollo. FAO. ROMA. EBook 45-49p.
20. MURPHY, S.; SWANTON, S. 2003. Weed ecology; In natural and agricultural systems. Ed CABI International. 312p.
21. NUÑEZ, F.R.; JUAN, V.F.; CHANTRE, G. 2014. Distribución vertical del banco de semillas de Euphorbia davidii subils, en lotes agrícolas de la zona centro de la provincia de Buenos Aires, Argentina. Planta Daninha, Viçosa-MG. 32(4):709-718.
22. ORTIZ, A.; LÓPEZ, L.; CÁCERES, M.; MORATINOS, H. 2009. Evaluación del banco de semilla de arroz maleza y voluntario en el suelo. Agr. Trop. 59(4): 423-432.
23. PLAZA, G. 2009. Caracterización de la comunidad de malezas en un sistema de producción de rosa bajo invernadero en la Sabana de Bogotá. Agr. Col.27(3):385-394.
24. PLAZA, G.; PEDRAZA, M. 2007. Reconocimiento y caracterización ecológica de la flora arvense asociada al cultivo de uchuva. Agr. Col. 25(2):306-313.
25. POGGIO, S. 2012. Cambios florísticos en comunidades de malezas: un marco conceptual basado en reglas de ensamblaje. Ecología Austral. (Argentina).22:150-158.
26. PORTELA, J. 2008. Control de malezas en cultivos hortícolas: ¿una cuestión de factores o de procesos? Hort. Argentina. 27(62):28-34.
27. RADOSEVICH, S.R.; GHERSA, C.M. 2007. Ecology of weeds and invasive plant; Relationship to agriculture and natural resource management. Interscience.474p.
28. SALDARRIAGA, A.; LONDOÑO, M.; CÓRDOBA, O. 2011. Problemas Fitosanitarios Asociados el Cultivo de Higuerilla en Colombia. Ed. CORPOICA. C. I. La Selva. Rionegro, Antioquia, Colombia. 54p.
29. SANS, F. 2007. La diversidad de los agroecosistemas. Ecosistemas. (España). 16(1):44-49.
30. SARANDON, S.J.; FLORES, C.C. (eds). 2014. Agroecología: bases teóricas para el diseño y manejo de agroecosistemas sustentables. 1a ed. Universidad Nacional de La Plata. E-book. 466p.
31. SISTEMA DE INFORMACIÓN DE PRECIOS AGROPECUARIOS -SIPSA-. 2015. Boletín mensual. Precios de insumos y factores de producción Agrícola. Disponible dese Internet en: http://www.dane.gov.co/files/investigaciones/agropecuario/sipsa/Bol_Insumos_may_2016.pdf (con acceso 15/05/2016).
32. STUPINO, S.; IERMANÓ, M.; GARGOLOFF, A.; BONICATTO, M. 2014. Biodiversidad en Agroecosistemas. pp. 131-134. En: Sarandon, S.J.; Flores, C. (eds) Agroecología: Bases teóricas para el diseño y manejo de agroecosistemas sustentables. 1a ed. Universidad Nacional de La Plata. E-book. p.131-134
33. TABOADA, M.; ÁLVAREZ C. 2008. Fertilidad Física de los Suelos. 2a ed. Buenos Aires. Universidad de Buenos Aires. 272p.
34. TAUSEEF, M.; IHSAN, F.; NAZIR, W.; FAROOQ, J. 2012. Weed flora and importance value index (IVI) of the weeds in cotton crop fields in the region of Khanewal, Pakistan. Weed Science. 18(3):319-330.
35. ZIMDAHL, R.L. 2007. Weed Reproduction and Dispersal. Fundamentals of Weed Science. Chapter 5. WeedReproduction and Dispersal. 3 a ed. Ed Elsevier. p.80-100.
Recibido: Febrero 3 de 2016 Aceptado: Junio 22 de 2016

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.