CIENCIAS AGROPECUARIAS - Artículo Científico
EFECTO DE LA TEMPERATURA Y RADIACIÓN EN LA PRODUCCIÓN DE GLUCÓSIDOS DE ESTEVIOL EN Stevia rebaudiana EN EL CARIBE HÚMEDO COLOMBIANO
TEMPERATURE AND RADIATION EFFECT ON STEVIOL GLYCOSIDES PRODUCTION IN Stevia rebaudiana IN THE COLOMBIAN HUMID CARIBBEAN REGION
Alfredo Jarma Orozco1, Carlos Cardona Ayala2, Claudio Fernández Herrera3
1 I.A. Ph.D., Docente Tiempo Completo, Facultad de Ciencias Agrícolas, Universidad de Córdoba (Montería - Colombia). Correo-e: ajarma@correo.unicordoba.edu.co
2 I.A. M.Sc. Docente Tiempo Completo, Facultad de Ciencias Agrícolas, Universidad de Córdoba
3I.A. M.Sc. Docente Tiempo Completo, Facultad de Ciencias Agrícolas Universidad de Córdoba, claudiofernandezherrera@gmail.com
Rev. U.D.C.A Act. & Div. Cient. 15(2): 339 - 347, 2012
RESUMEN
Estevia es una planta herbácea semi-perenne, nativa de Paraguay, que ha demostrado su versatilidad de adaptación a diversos ambientes en el mundo. Esta planta, se caracteriza por producir glucósidos de esteviol (diterpenos), que pueden ser hasta 300 veces más dulces que la sacarosa. Estos compuestos son sintetizados en la misma ruta de las giberelinas, por lo que factores como la luz y la temperatura, que afectan la síntesis de la hormona, también deberían tener un efecto importante sobre la síntesis de los glucósidos. La investigación, se realizó en el departamento de Montería, Córdoba, durante tres épocas de siembra, entre 2006 y 2007, con el propósito de determinar el efecto de la radiación fotosintéticamente activa (RFA) y las temperaturas máximas y mínimas, sobre la concentración de glucósidos, de los genotipos Morita 1 y Morita 2. Se usó un arreglo factorial de 3 (épocas) x 2 (genotipos), con 12 repeticiones, bajo un diseño experimental completo al azar. De manera general, se observó que las respuestas de los genotipos variaron en función de la oferta ambiental de cada época de siembra; los efectos de la RFA y las temperaturas mostraron una correlación positiva (p≤0,05), con la síntesis de glucósidos para M1, en tanto que para M2, esto solamente fue evidente para la RFA. Aunque se observó un incremento de los glucósidos totales, no sucedió para rebaudiósido A.
Palabras clave: Estevia, rebaudiósido A, glucósidos, RFA, ecofisiología.
SUMMARY
Stevia, a semi-perennial herbaceous plant, native of Paraguay, has demonstrated its versatility to adapt in different environments in the world. This plant is characterized by the synthesis of steviol (diterpene) glycosides that can be, up to 300 times, sweeter than sucrose. These substances are synthesized in the same pathway as gibberellins, so factors such as light and temperature that normally affect hormone synthesis, also may have a significant effect on steviol glycoside synthesis. The research was carried out in Monteria-Cordoba, for three seasons between 2006 and 2007 to determine the effect of photosynthetic active radiation (PAR) and maximum and minimum temperatures, on the concentration of glycosides of Morita 1 and Morita 2 genotypes. A factorial arrangement of 3 (seasons) x 2 (genotypes) was used, with 12 repetitions in a complete randomized experimental design. In general terms, the genotypes responses varied according to planting season, the effects of PAR and the temperatures indicated a positive correlation (p ≤ 0.05) between them and synthesis of glycosides for Morita 1, while for Morita 2 it was only obvious to the PAR. Although there was an increase in total glycosides, this was not found for rebaudioside A.
Key words: Stevia, rebaudioside A, glycoside, PAR, ecophysiology.
INTRODUCCIÓN
La Estevia, Stevia rebaudiana Bert., es una especie originaria de Paraguay, conocida por los amerindios guaraníes, desde tiempos ancestrales, como ka'a he'e (Alonzo-Torres, 2007). En sus hojas posee moléculas denominadas glucósidos de esteviol (GE), con poder edulcorante de hasta 300 veces más potente que la sacarosa (0,4% en volumen) y cuyo contenido puede variar entre un 4 y 20%, dependiendo del genotipo y de las condiciones ambientales y de cultivo (Geuns, 2003; Brandle & Telmer, 2007; Gardana et al. 2010). Tanto las hojas como los extractos, se han utilizado por muchos años en Suramérica, en Asia, en Japón, en China y en diferentes Estados de EEUU. En Brasil, en Korea y en Japón, el edulcorante refinado es oficialmente catalogado como bajo en calorías (Mizutani & Tanaka, 2002; Kim et al. 2002); su uso se ha incrementado dramáticamente en la primera década del siglo, debido a la conciencia que ha despertado el efecto de la sacarosa en la salud, en aspectos como caries dental, obesidad y diabetes, entre otros (Chatsudthipong & Muanprasat, 2009).
La información científica indica que los mayores GE de la hoja son esteviósido (St: 5-10% del peso seco de la hoja), rebaudiósido A (RebA: 2-4%), rebaudiósido C (1-2%) y dulcósido A (0,4-0,7%). De éstos, St (300 veces más potente que la sacarosa) y RebA (250-400 veces) son los que mayormente dominan el mercado de los GE (Chatsudthipong & Muanprasat, 2009; Hearn & Subedi, 2006). Uno de los criterios importantes para determinar la calidad de la hoja es la relación RebA/St, la cual, generalmente, está alrededor de 0,4 (De Oliveira et al. 2007). En la medida en que esta relación sea igual o mayor de 1, se obtiene un producto de mejor calidad (mayor potencial edulcorante y menor sabor amargo), ya que RebA es más dulce y no tiene sabor amargo (Dacome et al. 2005; Carakostas et al. 2008).
Estevia, se ha cultivado con éxito en una gran variedad de localidades geográficas de todo el mundo (Siddique et al. 2010; Brandle et al. 2000; Ramesh et al. 2006); aunque se encuentran informes de cultivos en condiciones extremas, como en el invierno de San Petersburgo, estevia se adapta mejor a ambientes que están entre los 35 y 45° de latitud, a cada lado del Ecuador (Rank & Midmore, 2002). En Suramérica existen diversos reportes de la producción exitosa en países con diferencias ambientales, como Paraguay, Brasil, Argentina, Colombia, Perú y Ecuador (Jarma, 2008; Landázuri & Tigrero, 2009).
En su hábitat natural, en el nororiente paraguayo (21- 22° S), se encuentra de manera silvestre, entre 200 y 700m.s.n.m., temperatura media anual de 22,5oC, con temperaturas que oscilan entre 17 y 26°C y 1600mm/año de precipitación (Soejarto, 2002). Autores, como Ceunen et al. (2012), afirman que cuando se establece como cultivo, los requerimientos climáticos de longitud del día y temperatura, pueden variar significativamente entre regiones y cultivares.
Según Brandle (2004), la floración en estevia es fotodependiente y es mayor al reducirse la duración del día; sin embargo, el autor indica que las respuestas de la floración y del contenido de esteviósidos a la longitud del día, parecen ser variables, ya que algunos genotipos se comportan como plantas obligadas de día corto y otros parecen ser insensibles al fotoperiodo. En términos generales, se consideran plantas de día corto, aquellas que florecen cuando la duración del día es menor de un período crítico que, habitualmente, se establece de 11 horas (Warner, 2007), aunque este valor puede variar al depender de diversos factores, como la edad de la planta, la temperatura y otros (Baloch et al. 2009).
Geeta & Midmore (2010) indican que estevia es una planta de día corto al notar un incremento de la floración en días con luz menor de 12 h; por su parte, Brandle & Rosa (1992) reportaron que una alta relación hoja/tallo fue una función del genotipo cuando se sometieron a días largos. Ramesh et al. (2006) afirmaron que el crecimiento vegetativo, el área foliar, el peso seco de hojas y el rendimiento de glucósidos variaron de acuerdo a la duración del día y que estos parámetros fueron mayores en días largos al compararlos con días cortos, principalmente, la concentración de esteviósidos, que aumentó en un 50%. Algunos de los pocos trabajos de investigación realizados en el tema han reportado que el crecimiento vegetativo de estevia se reduce cuando las temperaturas están por debajo de 20°C y cuando la longitud del día es menor a 12 horas (Lemus-Mondaca et al. 2012; Yermakov & Kochetov, 1996). Los mismos autores reportaron que al aumentar la longitud del día a 16 horas y la intensidad de la misma, se incrementan el crecimiento vegetativo y los niveles de esteviósidos.
La temperatura influye sobre la disponibilidad de nutrientes del suelo, la germinación, el crecimiento de los nuevos brotes, la fotosíntesis, la respiración y muchos otros procesos metabólicos en la planta. Los primeros trabajos en estevia, adelantados por Sumida (1980), indican que el rango óptimo de temperaturas de esta planta es de 15-30°C y puede soportar temperaturas críticas de 0-2°C; aunque Miyazaki et al. (1978) demostraron que el límite absoluto era -3°C. El efecto de las temperaturas y la producción de los glucósidos en estevia es una polémica mundial. En 1983, Mizukami et al. postularon que la relación entre las temperaturas diurnas y nocturnas era un factor determinante en la producción del esteviósido y determinaron que la variación 25/20°C (día/noche), indujo las mayores tasas de crecimiento y de producción de esta molécula; sin embargo, 15 años más tarde, Nepovim et al. (1998), en un trabajo adelantado en la República Checa, donde se determinó el efecto de las condiciones de cultivo sobre el contenido de esteviósidos, reportaron que la temperatura no fue un parámetro determinante para la producción de los glucósidos de esteviol. Posteriormente, Parsons (2003) concluyó que la temperatura sí tenía un efecto sobre la producción de esteviósidos, de manera directa o a través de la variación día/noche. Reportes de rangos de temperatura, donde estevia expresa su máximo crecimiento, son variables. Barathi (2003) reveló que para un crecimiento favorable, las temperaturas máximas diarias no deben exceder 40°C y en la noche no deben estar por debajo de los 10°C, en tanto que Richard (2004) señaló que el rango de temperaturas donde estevia mejor crece es de -6 a 44°C. Rank & Midmore (2002), en un reporte de la posibilidad de la introducción de estevia en Australia, indicaron que el crecimiento vegetativo se reducía cuando las temperaturas estaban por debajo de 20°C.
En este trabajo, se evaluó la hipótesis que la variación de los factores luz y temperatura, en el Caribe Húmedo colombiano, afectan la calidad de la hoja de dos genotipos de estevia. Para ello, se planteó como objetivo principal, determinar el efecto de la RFA y de las temperaturas máximas y mínimas registradas en tres épocas de siembra, sobre la cantidad de glucósidos totales (GT), la concentración de RebA y la relación RebA/OG en los genotipos de estevia M1 y M2.
MATERIALES Y MÉTODOS
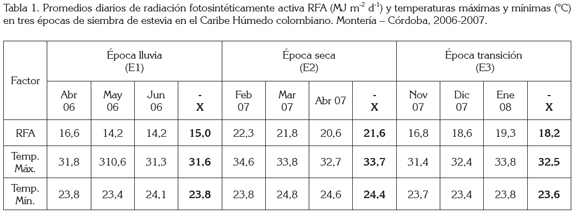
Localización y material experimental: Se condujeron experimentos en tres épocas: abril 2 a junio 13 de 2006, considerada como época de lluvias (E1); febrero 20 a abril 17 de 2007, como época seca (E2), y noviembre 20 a enero 30 de 2007, como época de transición entre lluvia y seca (E3). Los trabajos, se adelantaron en la Universidad de Córdoba (Montería-Colombia), ubicada a una altura de 13 m.s.n.m., 8°52' N y 76° 48' W. La zona de vida se denomina bosque seco tropical (bs-T), según la clasificación de Holdridge (1967), aunque en el país se denomina Caribe Húmedo colombiano; esta zona registra precipitación promedio anual de 1200 mm, temperatura media del aire de 28°C, humedad relativa de 84% y brillo solar anual de 2108,2 horas (Palencia et al. 2006). En cada época, se usó un diseño completamente al azar, con arreglo factorial de 3 (épocas) x 2 (genotipos) y 12 repeticiones; el brillo solar fue convertido a RFA, mediante la metodología de Angström (1924) y las temperaturas se registraron con termómetro de máximas y mínimas, marca B.B.I. Mod. 3100. Estas variables indicaron que, en términos generales, las épocas E2 y E3 presentan los mayores niveles de RFA, Tmax y Tmin (Tabla 1).

Contenido de glucósidos: El contenido de glucósidos totales GT y de RebA, se midió en porcentaje de peso seco de la hoja, por el método de cromatografía líquida de alta eficacia, utilizando en la fase móvil una mezcla de acetonitrilo y agua (80:20), con una columna Kromasil 100-5HN2 (Método isocrático) y un patrón Reb A, de un 90% de pureza. Estos análisis fueron realizados por el Laboratorio de Control de Calidad de la empresa Prodalysa Ltda. (Chile). Sólo se consideró la presencia de RebA en función de los glucósidos totales (GT), por ser el de mayor importancia económica (Liu et al. 2010). La diferencia entre GT y RebA, se asumió como contenido de otros glucósidos OG, para efectos de establecer la relación RebA/OG.
En términos generales, durante el desarrollo de la investigación no se presentaron efectos significativos de factores ajenos a la misma; el riego, se aplicó con el criterio de mantener capacidad de campo.
Para analizar los resultados, se hizo un ANAVA, donde se consideró el efecto de los factores individuales época y genotipo y su interacción, los cuales, se descompusieron con tablas de medias de doble entrada, realizando las comparaciones, a través del test protegido de DMS, a un nivel del 5% de probabilidad; posteriormente, se corrieron análisis de correlación por genotipo entre las principales variables, dependientes e independientes. Para el ANAVA, el análisis de las interacciones y de las correlaciones, se utilizó el software estadístico Statistical Análisis System (SAS) versión 9.1.
RESULTADOS Y DISCUSIÓN
Los resultados indicaron que para todas las variables dependientes se presentó interacción de la época por el genotipo, denotando las respuestas diferenciales que presenta la calidad de la hoja de los materiales genéticos (plasticidad), al variar la oferta de luz y de temperatura. Por su parte, los coeficientes de variación de los GT (13,3%), RebA (5,9%) y relación RebA/OG (18,1%), indicaron una aceptable precisión de los datos experimentales, para condiciones de campo (Pimentel-Gomes, 1985).
El análisis de las interacciones, se realizó desde la óptica del genotipo, para facilitar la comprensión de las mismas (Tabla 2). En M1, los GT aumentaron en alrededor de 4g por cada 100 g de hoja seca, cuando se cultivó en E3, respecto a las otras épocas, pero no sucedió con el contenido de RebA y la relación RebA/OG. Para estas dos variables, fue la E2 quien mostró los mejores valores respecto a E1 y E3 (respectivamente, 8 y 15% más de contenido de RebA y 4 y 6 veces más alta la relación RebA/OG).
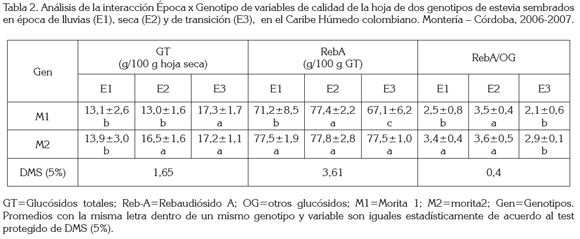
Por su parte en M2, los GT se redujeron en más de 2g/100g de hoja seca, en la época de lluvia respecto a la seca y de transición, pero a diferencia de M1, los niveles de RebA no presentaron diferencias significativas entre las épocas de siembra, indicando más estabilidad de este parámetro respecto a M1.
Glucósidos totales: Los resultados consignados en la tabla 3 indican que los GT de M1 tienden a variar en el mismo sentido de la RFA y las Tmax y Tmin, o sea, que un incremento en los valores de estas tres variables ambientales estaría asociado también a un incremento de los GT; sin embargo, es importante mencionar que aumentos extremos de este factor podrían causar una disminución en los GT al reducirse la biomasa total por planta (Jarma et al. 2006); esto podría explicar los resultados de los GT en M1 sometida a altos niveles de radiación (E2, 21 MJ m-2 d-1), respecto a la época de transición (E3, 18 MJ m-2 d-1), donde se aumentaron los GT.
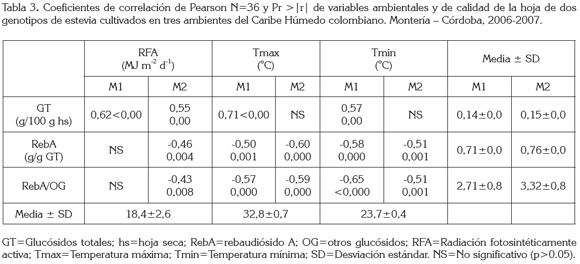
Para M2, el coeficiente de correlación positivo también indica que los GT y la RFA varían en el mismo sentido, es decir, que valores altos de GT corresponden a valores altos de RFA y viceversa; sin embargo y a diferencia de M1, para M2 al parecer los GT y las temperaturas (máximas y mínimas), no están asociadas significativamente, lo que sugeriría que la luz sería más importante que las temperaturas en la síntesis de glucósidos de esteviol, en este genotipo.
Los aumentos de GT a una oferta intermedia de RFA para M1 en E3 y alta e intermedia para M2 en E2 y E3 (Tabla 2), indican una respuesta positiva de la especie a la luz, aunque de manera diferencial entre genotipos. Este comportamiento podría corroborar lo reportado por Jarma, en 2008, respecto a las tasas de crecimiento y de concentración de edulcorantes que ha registrado a su favor M2, al cultivarse en diversidad de condiciones y de ambientes, principalmente, luz. Resultados similares han sido reportados por Lemus-Mondaca et al. (2012), quienes informaron de un aumento en la síntesis de GT, al aumentar la oferta de luz.
Al considerar que los glucósidos de esteviol son moléculas sintetizadas en la cadena de alargamiento terpénica y con base en lo reportado por Guenther et al. (1994), en el sentido que la luz tiene un efecto directo y positivo sobre la síntesis del isopentenil pirofosfato IPP, una molécula de cinco carbonos que es denominada regularmente como el isopreno activo, dada su importancia como precursor en el alargamiento de dicha cadena, es lógico deducir que la luz afecte también positivamente la síntesis de los glucósidos de esteviol (Guevara-García et al. 2005), aunque esto se haría de manera diferencial entre genotipos, tal como se reporta en este trabajo. Respecto a la temperatura, aún se desconoce gran parte de cómo la planta traduce estos estímulos en señales particulares; lo cierto es que las altas temperaturas inducen cambios y adaptaciones, a través de un regulador transcripcional (bHLH) denominado, frecuentemente, como factor interactuante del fitocromo 4 (PIF4), el cual, está regulado por el genotipo e integra múltiples estímulos ambientales, durante el desarrollo de la planta (Koini et al. 2009).
Probablemente, la actividad del PIF4 en estevia indicaría que este regulador respondería, mayormente, a los estímulos de temperatura en M1 respecto a M2. Lo anterior podría contribuir a la discusión mundial sobre el efecto indiferente (Nepovim et al. 1998) o positivo (Parsons, 2003) de las temperaturas en la concentración de glucósidos, ya que este trabajo sugeriría que esta respuesta puede ser diferencial, de acuerdo al genotipo.
Por otra parte, es importante considerar que, aunque el rol fisiológico y la acumulación de altas cantidades de glucósidos no han sido aún bien elucidados, en la ruta de síntesis de los glucósidos de diterpeno, la hidroxilación del ácido entkaurenoico (ent-KA) a esteviol, requiere NADPH y oxígeno molecular (Kim et al. 1996), reacción que es catalizada por una flavoproteina ent-KA 13-hidroxilasa; esto es importante, ya que en las reacciones lumínicas del proceso fotosintético, se provee NAPH y O2, por lo que se esperaría mayor oferta de los mismos, cuando las tasas de fotosíntesis son adecuadas en ambientes de apropiada oferta lumínica, como las épocas 2 y 3, de esta investigación. Adicionalmente, la síntesis del IPP es una consecuencia directa de las tasas de fotosíntesis al proveer el primer producto de este proceso, gliceraldehído 3-fosfato (3GAP), que dará origen al acetil coenzima A (ACoA) o se unirá a piruvato, formando el isopreno activo; con base en ello, no sorprende, por tanto, que exista correlación positiva entre la oferta de RFA y la síntesis de GT, tanto en M1 como en M2; caso diferente sucedería con la temperatura que al aumentar, probablemente, induciría tasas diferenciales de fotosíntesis/respiración en los dos genotipos, confirmando las desigualdades de adaptación (Jarma, 2008) y trayendo, igualmente, como consecuencia respuestas diferenciales en la concentración de GT.
Las respuestas a los estímulos de luz y de temperatura proporcionan a las plantas la capacidad de reconocer cambios ambientales y traducirlos en diversos aspectos, como el crecimiento y la síntesis de moléculas, entre muchas otras respuestas. Probablemente, la compleja integración de estas señales, a través de rutas compartidas o de reguladores hormonales transcripcionales dependientes en gran parte del genotipo (Franklin, 2009), sean hipótesis más contundentes, para explicar los resultados diferenciales de M1 y M2, en vez de una respuesta simple y aislada a uno de cada uno de estos dos factores.
Por lo anterior, los hallazgos del presente trabajo, denotan la importancia de considerar la oferta de luz, cuando se decide sembrar estevia en el Caribe Húmedo colombiano, pero además, comprueban que es necesario también reflexionar acerca del efecto de las temperaturas máximas y mínimas que, al aumentar a niveles prudentes, favorecerían la síntesis de GT en M1 y tendrían, a su vez, un efecto directo sobre la inducción de la floración en ambos genotipos, que es, precisamente, la época donde más se concentran los glucósidos en la vacuola (Fukuda et al. 2009; Balasubramanian et al. 2006; Chatsudthipong & Muanprasat, 2009).
Rebaudiósido A y relación rebaudiósido A/OG: La Tabla 3 muestra que, en términos generales, los contenidos de RebA y la relación RebA/OG varían en sentido contrario de la RFA y las temperaturas, de tal manera que valores altos de las tres variables ambientales inducirían valores bajos de RebA y de RebA/OG. Lo anterior sugiere que, el aumento de los GT, discutidos en el acápite anterior y las mermas de RebA, observados en este, se da como consecuencia de un aumento significativo de OG (p≤0.05), pero no de RebA, cuando se aumentan los niveles de RFA y las temperaturas. Situación particular presentaría M1 que aumentaría la concentración de RebA y St en la misma proporción, al incrementarse los niveles de radiación (Tabla 2).
Los principales glucósidos de esteviol, se sintetizan en la medida que se dan glucosilaciones sucesivas en la molécula de esteviol (Wang, 2009); su orden de síntesis son esteviol, esteviolmonósido, esteviolbiósido o rubusósido, esteviósido, rebaudiósido B y rebaudiósido A, este último, vía esteviósido o rebaudiósido B (Jones et al. 2003; Lim et al. 2003; Meßner et al. 2003). Las enzimas que catalizan estas glucosilaciones, se denominan UDP-glucosiltransferasas (UGT), UGT74G1, UGT76G1 y UGT85C2 y los genes involucrados en su síntesis son una pequeña nueva sub-familia. Según Richman et al. (2005), la importancia de lo anterior radica en que cada una de estas enzimas cataliza una reacción de glucosilación diferente, de acuerdo al grupo que reciba la molécula del azúcar activo; así, la transferencia de la glucosa a un grupo hidroxilo es catalizada por UGT85C2 en el paso de esteviol a esteviolmonósido; a un grupo carboxilo es catalizada por UGT74G1 en el paso de esteviolbiósido a esteviósido y a otro azúcar es catalizada por UGT76G1, en el paso de esteviósido a rebaudiósido A.
No existen referentes bibliográficos que determinen el efecto de las variables ambientales sobre la síntesis diferencial de los principales glucósidos en Stevia rebaudiana; por lo tanto, al considerar que las enzimas involucradas en la formación de estas moléculas no fue evaluada en el presente trabajo, los resultados de esta investigación sugerirían que los estímulos recibidos con altos niveles de RFA en M2 y de temperaturas en ambos genotipos, probablemente, intervinieron diferencialmente en la actividad enzimática de las UGT, favoreciendo la ruta de la síntesis de OG respecto a la de RebA. Lo anterior, se podría sustentar por los reportes de Reyes & Martínez (2001), quienes indicaron que las diferencias en cuanto al tipo de respuesta, demuestran la plasticidad genotípica de los individuos en ambientes heterogéneos, ajustando su morfología y su fisiología y que las bases genéticas de esta plasticidad, pueden ser complejas al interactuar diferentes tipos de genes.
Agradecimientos: Los autores expresan sus agradecimientos a los doctores John Alarcón y Andrés Llanos, del Laboratorio de Control de Calidad, de la empresa Prodalysa Ltda., en Chile y en Colombia, respectivamente, por su colaboración decidida en el análisis de las muestras de contenido de glucósidos totales. Conflictos de intereses: El manuscrito fue preparado y revisado con la participación de todos los autores, quienes declaramos que no existe ningún conflicto de intereses que ponga en riesgo la validez de los resultados presentados. Financiación: Este estudio fue financiado por la Universidad de Córdoba.
BIBLIOGRAFÍA
1. ALONZO-TORRES, M. 2007. Uso del Kaa Hee en la horticultura. En: Producción de hortalizas todo el año. Mod. IV. Producción de Kaa Hee. Provincia de Formosa. Argentina 13p.
2. ANGSTRÖM, A. 1924. Solar and terrestrial radiation. Q.J. Royal Meteorol. Soc. 50:121-126.
3. BALASUBRAMANIAN, S.; SURESHKUMAR, S.; LEMPE, J.; WEIGEL, D. 2006. Potent induction of Arabidopsis thaliana flowering by elevated growth temperature. PLoS Genetics. 2(7):e106:0980-0989.
4. BALOCH, J.; KHAN, M.; ZUBAIR, M.; MUNIR, M. 2009. Effects of different photoperiods on flowering time of facultative long day ornamental annuals. Int. J. Agric. Biol. 11:251-256.
5. BARATHI, N. 2003. Stevia - The calorie free natural sweetener. Natural Product Radiance. 2:120-122.
6. BRANDLE, J.E.; ROSA, N. 1992. Heritability for yield, leaf: stem ratio and stevioside content estimated from a landrace cultivar of Stevia rebaudiana. Can. J. Plant Sci. 72:1263-1266.
7. BRANDLE, J.E.; TELMER, P.G. 2007. Steviol glycoside biosynthesis. Phytochem. 68:1855-1863.
8. BRANDLE, J. 2004. FAQ - Stevia, Nature's Natural Low Calorie Sweetener. Disponible desde Internet en: Agriculture and Agri-Food Canada. http://res2.agr.ca/London/faq/stevia_e.htm (con acceso 17/11/06).
9. BRANDLE, J.E.; STARRATT, A.N.; GIJZEN, M. 2000. Stevia rebaudiana: its biological, chemical and agricultural properties. Disponible desde Internet en:http://res2.agr.ca/london/pmrc/faq/stevia_rev.html (con acceso 02/06/2000).
10. CARAKOSTAS, M.C., CURRY, L.L.; BOILEAU, A.C.; BRUSICK, D.J. 2008. Overview: The history, technical function and safety of rebaudioside A, a naturally occurring steviol glycoside, for use in food and beverages. Food Chem. Tox. 46:S1-S10.
11. CEUNEN, S.; WERBROUCKB, S.; GEUNS, J. 2012. Stimulation of steviol glycoside accumulation in Stevia rebaudiana by red LED light. J. Plant Physiol. 169:749-752.
12. CHATSUDTHIPONG, V.; MUANPRASAT, C. 2009. Stevioside and related compounds: Therapeutic benefits beyond sweetness. Pharmacol. Therapeut. 121:41-54.
13. DACOME, A.; DA SILVA, C.; DA COSTA, C.; FONTANA, J.; ADELMANN, J.; DA COSTA, S. 2005. Sweet diterpenic glycosides balance of a new cultivar of Stevia rebaudiana (Bert.) Bertoni: Isolation and quantitative distribution by chromatographic, spectroscopic, and electrophoretic methods. Process Biochem. 40:3587-3594.
14. DE OLIVEIRA, B.H.; PACKER, J.F.; CHIMELLI, M.; DE JESÚS, D.A. 2007. Enzymatic modification of stevioside by cell-free extract of Gibberella fujikuroi. J. Biotechn. 131:92-99.
15. FRANKLIN, K.A. 2009. Light and temperature signal crosstalk in plant development. Curr. Opinion Plant Biol. 12:63-68.
16. FUKUDA, M.; MATSUO, S.; KIKUCHI, K.; MITSUHASHI, W.; TOYOMASU, T.; HONDA, I. 2009. The endogenous level of GA1 is upregulated by high temperature during stem elongation in lettuce through LsGA3ox1 expression. J. Plant Physiol. 166:2077-2084.
17. GARDANA, C.; SCAGLIANTI, M.; SIMONETTI, P. 2010. Evaluation of steviol and its glycosides in Stevia rebaudiana leaves and commercial sweetener by ultra high performance liquid chromatography-mass spectrometry. J. Chromatogr A. 1217:1463-1470.
18. GEETA, G.; MIDMORE, D. 2010. Influence of soil water, pH and photoperiod on the growth of stevia (Stevia rebaudiana). Disponible desde Internet en: http://www.cqu.edu.au/_data/assets/pdf_file/0012/50403/2010_CPWS_Annual_Report_FINAL.pdf (con acceso 10/07/2012).
19. GEUNS, J.M. 2003. Stevioside. Phytochem. 64: 913-921.
20. GUENTHER, A.; ZIMMERMAN, P.; WILDERMUTH, M. 1994. Natural volatile organic compound emission rate estimates for U.S. woodland landscapes. Atmosph. Environm. 28(6):1197-1210.
21. GUEVARA-GARCÍA, A.; SAN ROMÁN, C.; ARROYO, A.; CORTES, M.; DE LA LUZ GUTIÉRREZ- NAVA, M.; LEÓN, P. 2005. Characterization of the arabidopsis clb6 mutant illustrates the importance of posttranscriptional regulation of the methyl-D- erythritol 4-phosphate pathway. Plant Cell. 17(2):628- 643.
22. HEARN, L.K.; SUBEDI, P.P. 2006. Determining levels of steviol glycosides in the leaves of Stevia rebaudiana by near infrared reflectance spectroscopy. J. Food Compos. Anal. 22:165-168.
23. HOLDRIDGE, L.R. 1967. Life Zone Ecology. Tropical Science Center. San José, Costa Rica. Traducción del inglés por Humberto Jiménez Saa: Ecología Basada en Zonas de Vida, 1ª. ed. 1982. San José, Costa Rica. IICA. 149p.
24. JARMA, A.; RENGIFO, T.; ARAMENDIZ, H. 2006. Aspectos fisiológicos de estevia (Stevia rebaudiana Bertoni) en el Caribe Colombiano. II. Efecto de la radiación incidente sobre los índices de crecimiento. Agr. Col. 24(1):38-47.
25. JARMA, A. 2008. Estudios de adaptación y manejo integrado de estevia (Stevia rebaudiana Bert.): nueva alternativa agroindustrial del Caribe colombiano. Una revisión. Rev. Col. Sc. Hort. 2(1):109-120.
26. JONES, P.; MESSNER, B.; NAKAJIMA, J.I.; SCHÄFFNER, A.R.; SAITO, K. 2003. UGT73C6 and UGT78D1, glycosyltransferases involved in flavanol glycoside biosynthesis in Arabidopsis thaliana. J. Biol. Chem. 45: 43910-43918.
27. KIM, K.; SAWA, Y.; SHIBATA, H. 1996. Hydroxylation of ent-Kaurenoic acid to steviol in Stevia rebaudiana Bertoni - Purification and partial characterization of the enzyme. Arch. Biochem. Biophys. 332(2):223- 230.
28. KIM, J.; CHOI, Y.H.; CHOI, Y. 2002. Use of stevioside and cultivation of Stevia rebaudiana in Korea. En: Kinghorn, A.D. (Ed.). Stevia, the Genus Stevia. Medicinal and Aromatic Plants-Industrial Profiles, Vol. 19. Taylor y Francis, Londres y NY. p.196-202.
29. KOINI, M.A.; ALVEY, L.; ALLEN, T.; TILLEY, C.A.; HARBERD, N.P.; WHITELAM, G.C.; FRANKLIN, K.A. 2009. High temperature-mediated adaptations in plant architecture require the bHLH transcription factor PIF4. Curr. Biol. 19:408-413.
30. LANDÁZURI, P.A.; TIGRERO, J.O. 2009. Generalidades. En: Landázuri, P.A.; Tigrero, J.O. (Eds.). Stevia rebaudiana Bertoni, una planta medicinal. Bol. Téc. Ed. Especial. ESPE. Sangolquí, Ecuador. 38p.
31. LEMUS-MONDACA, R.; VEGA-GÁLVEZ, A.; ZURA- BRAVO, L.; AH-HEN, K. 2012. Stevia rebaudiana Bertoni, source of a high-potency natural sweetener: A comprehensive review on the biochemical, nutritional and functional aspects. Food Chem. 132:1121-1132.
32. LIM, E.K.; HIGGINS, G.S.; LI, Y.; BOWLES, D.J. 2003. Regioselectivity of glucosylation of caffeic acid by a UDP-glucose:glucosyltransferase is maintained in planta. Biochem. J. 373:987-992.
33. LIU, J.; JIN-WEI, L.; JIAN, T. 2010. Ultrasonically assisted extraction of total carbohydrates from Stevia rebaudiana Bertoni and identification of extracts. Food Bioprod Process. 88(2-3):215-221.
34. MEßNER, B.; THULKE, O.; SCHÄFFNER, A.R. 2003. Arabidopsis glucosyltransferases with activities toward both endogenous and xenobiotic substrates. Planta. 217:138-146.
35. MIYAZAKI, Y.; WATANABE, H.; WATANABE, T. 1978. The cultivation of Stevia rebaudiana. III. Yield and stevioside content of 2 year old plants. Eisei shikensho hokoku. 96:86-89.
36. MIZUTANI, K.; TANAKA, O. 2002. Use of Stevia rebaudiana sweeteners in Japan. En: Kinghorn, A.D. (Ed.), Stevia, the Genus Stevia. Medicinal and Aromatic Plants-Industrial Profiles, Vol. 19. Taylor y Francis, Londres y NY, p.178-195.
37. MIZUKAMI, H.; SHIBA, K.; OHASHI, H. 1983. Effect of temperature on growth and Stevioside formation of Stevia rebaudiana. Shoyakugaku Zasshi. 37:175- 179.
38. NEPOVIM, A.; DRAHOSOVA, H.; VALICEK, P.; VANEK, T. 1998. The effect of cultivation conditions on the content of stevioside in Stevia rebaudiana Bertoni plants cultivated in the Czech Republic. Pharmaceut. Pharmacol. Lett. 8:19-21.
39. PALENCIA, G.; MERCADO, T.; COMBATT, E. 2006. Estudio Agro-meteorológico del Departamento de Córdoba. Gráficas del Caribe Ed. Facultad de Ciencias Agrícolas, Universidad de Córdoba. Montería - Córdoba. 126p.
40. PARSONS, P. 2003. Stevia-too good to be approved. Organic NZ. 62:26.
41. PIMENTEL-GOMES, F. 1985. Curso de estatística experimental. 8ª ed. Nobel. Sao Paulo - Brasil. 450p.
42. RANK, A.; MIDMORE, D. 2002. A new rural industry - Stevia - to replace imported chemical sweeteners. Rural Industries Research and Development Corporation (RIRDC), Kingston, Australia. 26p.
43. RAMESH, K.; SINGH, V.; MEGEJI, N.W. 2006. Cultivation of stevia [Stevia rebaudiana (bert.) Bertoni]: A comprehensive review. En: Advances in Agronomy. Academic Press. San Diego, California - USA Vol. 89. 360p.
44. REYES, J.M.; MARTÍNEZ, D. 2001. La plasticidad de las plantas. Elementos: Cie. Cult. 8(41):39-43.
45. RICHARD, D. 2004. "Stevia rebaudiana: Nature's Sweet Secret,'' Blue Heron Press. Bloomingdale, Il USA. p.1-80.
46. RICHMAN, A.; SWANSON, A.; HUMPHREY, T.; CHAPMAN, R.; MCGARVEY, B.; POCS, R.; BRANDLE, J. 2005. Functional genomics uncovers three glucosyltransferases involved in the synthesis of the major sweet glucosides of Stevia rebaudiana. Plant J. 41:56-67.
47. SIDDIQUE, A.B.; AMZAD HOSSAIN, M.; MIZANUR RAHMAN, S.M. 2010. Chemical composition of the essential oils of Stevia rebaudiana Bertoni leaves. Asian J. Trad. Med. 5(2):56-61.
48. SOEJARTO, D. 2002. Botany of Stevia and Stevia rebaudiana. En: Kinghorn, A.D. (Ed.), Stevia, the Genus Stevia. Medicinal and Aromatic Plants- Industrial Profiles, Vol. 19. Taylor y Francis, Londres y NY, p.18-39.
49. SUMIDA, T. 1980. Studies on Stevia rebaudiana Bertoni as a new possible crop for sweetening resources in Japan. Kenkyu hokoku. J. Central Agr. Exp. Sta. Nogyo Shikenjo. 31:1-71.
50. WANG, X. 2009. Structure, mechanism and engineering of plant natural product glycosyltransferases. FEBS Letters. 583:3303-3309.
51. WARNER, R. 2007. Grouping crops can save you money. Disponible desde Internet en: http://www.flor.hrt.msu.edu/assets/PdfAttachments/Groupingcropscansaveyoumoney.pdf (con acceso 10/07/12).
52. YERMAKOV, Y.I.; KOCHETOV, A.A. 1996. Specificities of the growth and development of stevia. Russ. Agr. Sci. 1:9-11.
Recibido: Julio 3 de 2012 Aceptado: Septiembre 29 de 2012

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.