CIENCIAS AGROPECUARIAS - Artículo Científico
SUSCEPTIBILIDAD DE Heliothis virescens (LEPIDOPTERA: NOCTUIDAE) A LA PROTEÍNA Cry1Ac INCORPORADA A DIETAS MERÍDICAS
SUSCEPTIBILITY OF Heliothis virescens (LEPIDOPTERA: NOCTUIDAE) TO Cry1Ac PROTEIN INCORPORATED TO MERIDIC DIETS
Laura Romero1, Helber Arévalo2, William Duarte3, Rodolfo Mejía4
1 I.A. Ingeniería Agronómica, U.D.C.A, lauraromeror@hotmail.com
2 I.A., c.M.Sc. Docente-investigador, Programa Ingeniería Agronómica, U.D.C.A, Calle 222 No. 55-37, Bogotá, D.C., harevalo@udca.edu.co
3 I.A., M.Sc. Docente-investigador, Facultad Ingeniería Agronómica U.D.C.A, wduarte@udca.edu.co
4 I.A., M.Sc. Docente-investigador, Facultad Ingeniería Agronómica U.D.C.A, rmejia@udca.edu.co
Rev. U.D.C.A Act. & Div. Cient. 15(2): 381 - 389, 2012
RESUMEN
Como alternativa de manejo a diversas plagas, se desarrollaron plantas modificadas que expresan proteínas letales contra insectos, a las cuales, pueden desarrollan resistencia las plagas, por la constante exposición a la proteína. Con el fin de monitorear los cambios en la susceptibilidad a la proteína Cry1Ac y determinar el efecto que ejerce la composición de la dieta merídica sobre la susceptibilidad de Heliothis virescens, se adelantaron bioensayos en el laboratorio de Biotecnología Agrícola de la U.D.C.A, con poblaciones colectadas en Desmodium sp., en el municipio El Espinal, Tolima. A las dietas ICRISAT, Greene y Shorey & Hale, se les incorporaron concentraciones seriadas de Cry1Ac, que oscilaban entre 0,01 y 100 ppm. Los bioensayos contaban con seis tratamientos, seis repeticiones y cada unidad experimental estaba representada por un vaso plástico con dieta, donde se colocaron una o cinco larvas neonatas. Con la mortalidad evaluada a los siete días, se determinó la concentración letal (CL50). Se comprobó que la composición de la dieta influye en la respuesta de susceptibilidad. La CL50 obtenida para H. virescens, en el 2011 (0,956ppm), indica que esta plaga perdió susceptibilidad a la Cry1Ac, expresada por el Bollgard®; sin embargo, esta variedad de algodonero todavía ejerce control sobre H. virescens. También se observó que la mortalidad obtenida con cinco larvas por unidad experimental estaba influenciada por el canibalismo y no por el consumo de Cry1Ac, sugiriendo que para los próximos ensayos se utilice, para eliminar el efecto que tiene el canibalismo sobre la mortalidad, solamente una larva por recipiente.
Palabras clave: Bellotero del algodonero, Bacillus thuringiensis, tolerancia, bioensayos.
SUMMARY
As an alternative for pest management, plants were developed to express lethal proteins against target insects, which may develop resistance due to their constant exposure to these proteins. To monitor changes in susceptibility to Cry1Ac protein and determine the effect exerted by the diet composition on the susceptibility of Heliothis virescens, bioassays were carried out in the U.D.C.A's laboratory of Agricultural Biotechnology with populations collected on Desmodium sp., at Espinal, Tolima. The diets employed were ICRISAT, Greene and Shorey & Hale, incorporating serial concentrations of Cry1Ac, ranging from 0.01 to 100 ppm. Bioassays consisted of six treatments and six replicates; each experimental unit was represented by a plastic cup with diet, in which one or five neonate larvae were placed. With the mortality assessed at day seven the lethal concentration (LC50) was calculated. The diet composition influenced the susceptibility response. The LC50 obtained for Heliothis in 2011 (0.956 ppm) indicates that this insect lost susceptibility to Cry1Ac expressed by Bollgard®; however, this plant variety still has control over the species. Results also showed that the mortality obtained with five larvae per experimental unit was influenced by cannibalism and not by the consumption of Cry1Ac, indicating that only one larva per container should be used to eliminate the effect of cannibalism on mortality.
Key words: Tobacco budworm, Bacillus thuringiensis, tolerance, bioassays.
INTRODUCCIÓN
Heliothis virescens (F.) (Lepidoptera: Noctuidae), conocido comúnmente como el bellotero del algodonero, es una especie polífaga que, además del algodonero, puede atacar cultivos de tabaco, de soya, de tomate y de girasol (Capinera, 2004), entre otros. En el algodonero, la hembra deposita los huevos de forma individual en las hojas y yemas terminales; esta actividad, se lleva a cabo tan pronto se empiezan a formar las estructuras reproductivas de la planta (García, 1976; Hallman, 1978). El daño es producido por las larvas, especialmente, a partir del tercer instar (Bonacic et al. 2010), las cuales, atacan el tejido foliar inicialmente y, luego, descienden en búsqueda de órganos fructíferos y, al llegar a los botones florales, los perfora y le consume parcial o totalmente. Las estructuras afectadas abren sus brácteas y caen al suelo; si el insecto ataca las cápsulas, éstas no se desprenden, pero sufren pudriciones y son improductivas (Alcaraz, 1962; García, 1976). Este tipo de ataque genera reducciones en la calidad y en el rendimiento del algodón, por la pérdida de estructuras reproductivas o el manchado de la fibra.
Como alternativa de manejo de este y otros insectos plaga, en 1987, se desarrolló la primera planta modificada genéticamente, donde por medio de ingeniería genética, se le confirió resistencia a determinados insectos (Agro-Bio, 2012). En 1996, se dieron las primeras siembras comerciales de algodón Bt en Australia y en Estados Unidos (Perlak et al. 2001). En Colombia, las primeras siembras comerciales de una variedad de algodón Bt, se hicieron en el 2003, con la variedad Bollgard®, la cual, presenta resistencia a plagas, como H. virescens, Helicoverpa zea, Trichoplusia ni, entre otros (Cerón, 2004).
Zenner de Polanía & Borrero (1992) demostraron que en Colombia H. virescens había adquirido resistencia a diversos ingredientes activos de insecticidas, por la presión de selección ejercida por su constante uso, fenómeno que también se puede presentar con los insectos expuestos a variedades de algodonero Bt, pues la constante exposición a una molécula puede generar cambios en la frecuencia de alelos susceptibles (Tabashnik et al. 2009), dando como respuesta una pérdida progresiva de susceptibilidad. Adicional a lo anterior, se ha reportado que algunas especies de lepidópteros han expresado resistencia a las toxinas del B. thuringiensis, cuando la toxina de esta bacteria ha sido aplicada como un bioplaguicida; tal es el caso de Plutella xyllostela (Shelton et al. 1993) y Trichoplusia ni (Janmaat & Myers, 2003).
De otra parte, existen factores que influyen en el desarrollo de resistencia, ya que reducen la expresión de las proteínas dentro de la planta; dentro de esos factores, se encuentran las altas temperaturas (Chen et al. 2005), el anegamiento (Dong & Li, 2007), la etapa de desarrollo de la planta (Akhurst et al. 2003; Blanco et al. 2008), la baja cantidad de nitrógeno disponible para la planta (Bruns & Abel, 2003), el déficit de agua (Dong & Li, 2007), entre otros. A nivel de laboratorio también existen otros factores, como temperatura y humedad relativa (Álvarez et al. 1991), el tiempo de exposición de los individuos a la proteína (Blanco et al. 2005), la composición del alimento suministrado a los insectos (Blanco et al. 2009), entre los principales, que pueden afectar negativamente los resultados, alterando la interpretación de pérdida o ganancia de susceptibilidad.
Por esta razón, esta investigación evaluó, bajo condiciones de laboratorio, el efecto que tiene la composición de las dietas merídicas sobre la susceptibilidad de Heliothis virescens, procedente de plantas de Desmodium sp. de la zona de El Espinal (Tolima, Colombia), a la proteína Cry1Ac del B. thuringiensis y de paso monitorear los cambios en la susceptibilidad que haya experimentado H. virescens, como consecuencia del establecimiento de algodonero genéticamente modificado.
MATERIALES Y MÉTODOS
Larvas de H. virescens fueron colectadas en plantas de Desmodium sp., en el municipio de El Espinal (Tolima), situado a 4° 09' N y 74° 53' W, a 431 msnm, de bordes de lotes sembrados con algodonero transgénico y convencional, para luego ser criadas en dieta ICRISAT (Tabla 1). Los ensayos, se llevaron a cabo en el laboratorio de Biotecnología Agrícola de la Universidad de Ciencias Aplicadas y Ambientales U.D.C.A, situado a 2600 msnm, con condiciones de temperatura, humedad y fotoperiodo controladas temperatura 25±5°C, humedad relativa de 70±10% y un fotoperiodo de 0:24.
Cuando las larvas colectadas en campo se transformaron en pupas fueron puestas en un recipiente de plástico de 50 mL de capacidad, con tapa de cierre a presión (Envapac Ltda., Bogotá). Cuando los adultos emergían eran separados por sexos y ubicados por parejas en una cámara de apareamiento y oviposición, con el fin de garantizar la postura de huevos fecundados. Las cámaras de apareamiento y de ovoposición consistían en frascos de vidrio, con capacidad de 3,5L. Estos frascos estaban cubiertos con tul de color blanco y con tiras de papel crepé, que colgaban del borde del frasco, para observar con mayor facilidad las posturas. Los adultos fueron alimentados diariamente con una mota de algodón saturada con una solución acuosa con el 10%, de azúcar y el 5%, de miel.
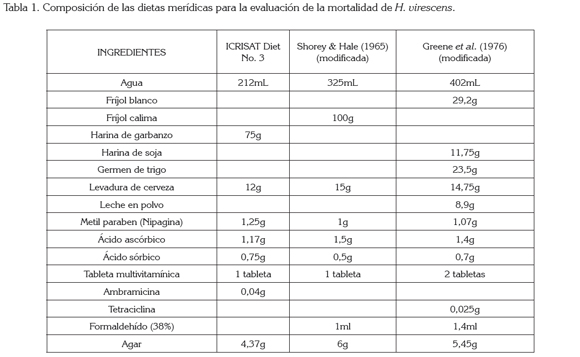
Para los bioensayos, se tomaron las posturas de la segunda generación de laboratorio (F2). A las dietas, se le incorporaron concentraciones logarítmicas del Cry1Ac del gene del Bt, obtenida del insecticida MVP II® (Cry1Ac encapsulado, por Pseudomonas sp., proporcionado por Dow AgroSciences). Las dietas merídicas a utilizar fueron: ICRISAT diet 3 a base de harina garbanzo, preparada de acuerdo a la fórmula proporcionada por el doctor H. Sharma, del Instituto Internacional de Investigación en Cultivos para las Zonas Tropicales Semiáridas (ICRISAT) Patancheru, Andhra Pradesh, India (Arévalo & Zenner, 2009); Shorey & Hale (1965), hecha a base de harina de frijol, modificada por Bowling (1967) y preparada según Villacorta & Cobo (1978) y la dieta Greene et al. (1976), a base de harina de soya y de frijol blanco, modificada por Parra (2001) (García et al. 2006). La composición de estas dietas aparece descrita en la tabla 1. Las dosis evaluadas oscilaron entre 0,01 y 100μg de proteína / mL de dieta.

Para el primer semestre de 2010, se montó un bioensayo con cinco tratamientos, un testigo absoluto y seis repeticiones, donde cada unidad experimental estaba representada por un vaso plástico de 50mL, con tapa inyectada (Envapac Ltda., Bogotá), el cual, contenía aproximadamente 4g de la dieta correspondiente y, en el cual, se colocaron cinco larvas neonatas. Para el segundo semestre de 2010, el bioensayo montado también contaba con cinco tratamientos, un testigo absoluto y treinta repeticiones, en el que cada unidad experimental consistía en un recipiente semejante al usado en el primer bioensayo, pero en donde solamente fue puesta una larva neonata. Para el 2011, se llevó a cabo un bioensayo, donde se determinó la susceptibilidad de larvas del bellotero, comparando el uso de una o de cinco larvas por unidad experimental, utilizando la dieta ICRISAT, seis tratamientos y 30 repeticiones para los ensayos de cinco y una larva por unidad experimental, respectivamente.
La mortalidad en todos los bioensayos, se evaluó a los siete días, tal como sugiere Martínez (2004). Los datos, se sometieron a análisis Probit (SAS Institute Inc. versión 9.2 (32) Español), para determinar la concentración letal media (CL50). Además, de forma individual, se continuó la cría de las larvas sobrevivientes en cada uno de los tratamientos y repeticiones de los bioensayos del 2010, con el fin de obtener datos de peso de pupas, cuando este estado era alcanzado por las larvas de cada tratamiento. También se determinó la duración de estados. Se realizó un análisis de varianza con el complemento de Excel (MegaStat), para determinar si existían diferencias para la mortalidad entre las tres dietas con cada concentración de proteína y, posteriormente, una prueba de diferencias mínima significativa de Fisher (LSD).
Para confrontar los resultados obtenidos por el grupo de Fitosanidad de la U.D.C.A con poblaciones provenientes del mismo lugar en años anteriores, se procedió a correr los datos con el mismo código Probit (Yu, 2008), al que fueron sometidos los datos obtenidos en este experimento, con el fin de observar los cambios en la susceptibilidad de esta plaga a la proteína Cry1Ac, a través del tiempo.
RESULTADOS Y DISCUSIÓN
Influencia de la dieta: Blanco et al. (2009) mencionan que la composición de la dieta influye en la susceptibilidad de una colonia, lo que se puede corroborar al observar la Tabla 2, en la que se encuentran las concentraciones letales medias, en cada una de las dietas; la Shorey & Hale es aquella que menor concentración necesita para causar mortalidad del 50% de la población. Para el caso del bioensayo del semestre A, la dieta que mayor concentración requirió para obtener la CL50 fue la Greene (5,36μg de proteína / mL de dieta) y para el caso del semestre B fue la dieta ICRISAT (0,41μg de proteína/mL de dieta). Estos resultados concuerdan con los encontrados por Arévalo et al. (2011), donde los individuos mantenidos en la dieta Shorey & Hale exhibieron una mayor susceptibilidad a la proteína Cry, que los individuos alimentados con la dieta Greene e ICRISAT.
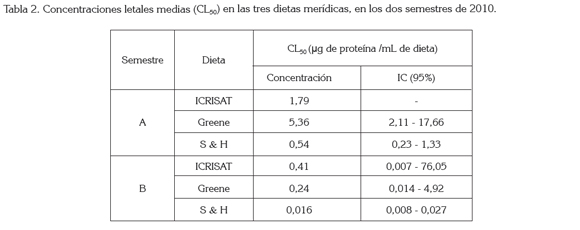
Las diferentes CL50 obtenidas en cada una de las dietas muestran que el tipo de alimento influye en la respuesta de susceptibilidad, lo que Blanco et al. (2009) atribuyen a una alteración en la expresión de enzimas digestivas, por parte de algunos componentes del alimento. Esto puede explicar el valor obtenido en la CL50 de los individuos mantenidos con la dieta ICRISAT, pues al existir una alteración en la expresión de dichas enzimas la activación de la toxina se da de forma más lenta, elevando valor en la CL50.
Blanco et al. (2009) sugieren que la susceptibilidad expresada por una colonia es directamente proporcional a la cantidad de alimento consumido; lo contrario se observó en los insectos que se alimentaron con la dieta Shorey & Hale (Tabla 2), ya que fue esta la que tuvo un menor consumo aparente y la que menor concentración letal media arrojó. Esto se puede atribuir, posiblemente, a la baja calidad nutricional de la dieta, ya que al no aportar los nutrientes necesarios, hace las larvas más susceptibles a la acción de la toxina.
En la figura 1, se observaron diferencias significativas para el semestre A, en la concentración de 100μg de proteína / mL de dieta (P>f 0,04); para el resto de las concentraciones, no se observó diferencia estadística. En las concentraciones 0,1; 1 y 10μg del semestre B, se detectaron diferencias altamente significativas, donde la probabilidad fue de 1,41 * 10-08; 0,0002 y 0,0035, respectivamente.
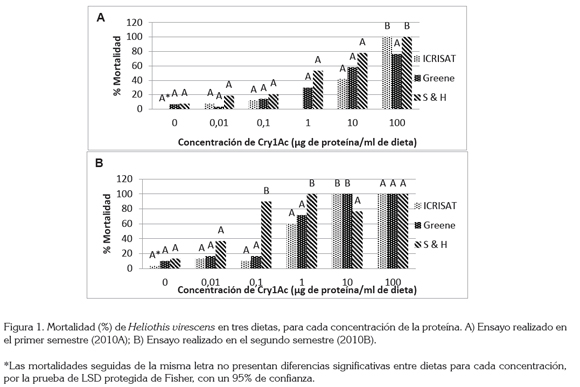
Como se observa en la figura 1, la dieta ICRISAT es la que menor mortalidad genera a Heliothis, mientras que la dieta Shorey & Hale es la que causa la mayor mortalidad, independientemente del semestre. Lo anterior apoya la idea que la dieta Shorey & Hale no aporta los nutrientes necesarios para el normal desarrollo del bellotero.
Influencia de la toxina: Para determinar la influencia que tiene la proteína en el desarrollo del insecto, las larvas sobrevivientes de los bioensayos fueron alimentadas con la dieta correspondiente sin proteína. Las dietas ICRISAT y Greene permitieron que las larvas pasaran a pupa, a diferencia de los individuos alimentados con la dieta Shorey & Hale, donde ninguna de las larvas pudo formar la crisálida, en ninguna de las concentraciones.
La duración del estado larval, se incrementó conforme aumentaba la concentración de la proteína (Figura 2). Las larvas alimentadas con la dieta ICRISAT necesitaron 28,75; 35; 33,1 y 48,2 días para transformarse a pupas en las cuatro primeras concentraciones de Cry1Ac, respectivamente, mientras que con la dieta Greene necesitaron 35,4; 45,5 y 37 días, en las tres primeras concentraciones, respectivamente, lo que concuerda a lo encontrado por Arévalo & Zenner de Polanía (2010); además, esa dieta permitió a algunas larvas sobrevivir a la exposición de la proteína hasta 1μg de proteína / mL de dieta, mientras que las larvas alimentadas con Greene solamente sobrevivieron hasta la concentración de 0,1μg.
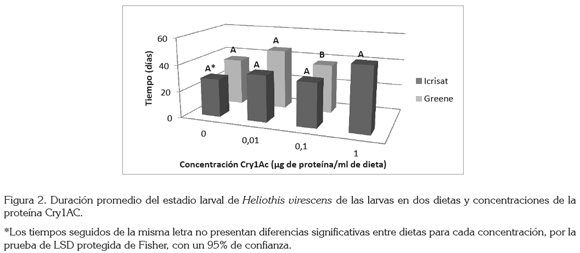
Como se observa en la figura 2, en la concentración 0,1 se presentaron diferencias (P>f 0,0072), siendo la dieta Greene la que menos posibilitó la formación de pupas en esa concentración. A diferencia de las concentraciones de 0 y 0,01 donde no se mostraron diferencias estadísticas entre las dos dietas. Estos resultados concuerdan con los hallados por Arévalo & Zenner de Polanía (2010), donde la dieta ICRISAT fue en la que las larvas requirieron un menor tiempo para la formación de la pupa.
Otra variable que permite determinar la influencia que tiene la dieta sobre el desarrollo del insecto es el peso de las pupas. Arévalo & Zenner de Polanía (2010) encontraron que los pesos que se obtuvieron con la dieta Greene eran menores que los obtenidos con la dieta ICRISAT, lo cual, se confirma en la figura 3, en donde la dieta ICRISAT es la que presenta los mayores pesos, con 217; 199; 209 y 172mg en cada una de las concentraciones, respectivamente, mientras que en la dieta Greene, se obtuvieron pesos de 206mg (0ppm de Cry1Ac), 147mg (0,01 ppm de Cry1Ac), y 206mg (0,1 ppm de Cry1Ac). También, se puede observar que existen diferencias significativas entre los pesos en las dietas Greene e ICRISAT en las concentraciones de 0,01 (P>f 8,99 * 10-06) y 0,1μg (P>f 3,06 * 10-06).
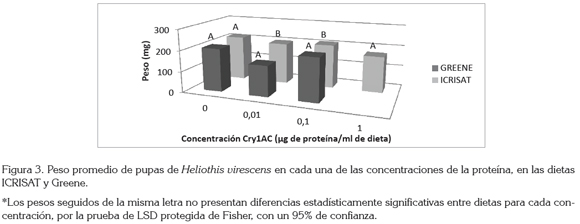
El peso de las pupas es un indicador de la calidad nutricional de una dieta (Bustillo, 1979), pues con un mayor peso de las mismas existe una mayor posibilidad de supervivencia, lo que nuevamente sugiere que la dieta Shorey & Hale no cumple con los requerimientos nutricionales de esta especie, ya que ni siquiera se logró la obtención de pupas en ninguno de los tratamientos.
Al permitir el desarrollo de las larvas que sobrevivieron al bioensayo, se observó que la presión de selección ejercida sobre la colonia H. virescens no permitió que ningún individuo completara su ciclo de vida, independientemente del tipo de alimento sobre el cual fue criado, lo que se ajusta a lo indicado por Gahan et al. (2010), donde se menciona que una alta concentración es letal para los insectos, pero una concentración baja altera el crecimiento de las larvas.
Cambios en la susceptibilidad: Al observar que existen diferentes formas, programas y versiones para obtener la concentración letal media, los datos obtenidos en este experimento, al igual que los datos logrados en los bioensayos realizados por el grupo de Fitosanidad de la U.D.C.A, con poblaciones del mismo lugar, en años anteriores, fueron sometidos al mismo algoritmo de programación para el programa del SAS, con el fin de poderlos comparar y observar los cambios en la susceptibilidad del bellotero.
En la figura 4, se observa una fluctuación en la susceptibilidad del insecto plaga, que disminuye entre el 2006 y el 2008, con CL50 de 0,008 y 4,73ppm, respectivamente y que aumenta para el 2010 y el 2011, con 1,79 y 0,47ppm, respectivamente. La fluctuación en la susceptibilidad de H. virescens puede estar influenciada por la procedencia de los insectos, ya que la colonia colectada en 2008 era procedente de un lote de algodonero, genéticamente modificado, indicando que los individuos habían estado bajo presión de selección, haciéndolos menos susceptibles a la acción de la toxina, a diferencia de la colonia colectada para determinar la CL50, de 2010 y 2011, que provenía de plantas de Desmodium sp., que crecían en el borde de un lote sembrado con algodonero convencional, en donde la baja o ausente presión de selección pudo haber incrementado la susceptibilidad de esta plaga al Cry1Ac.
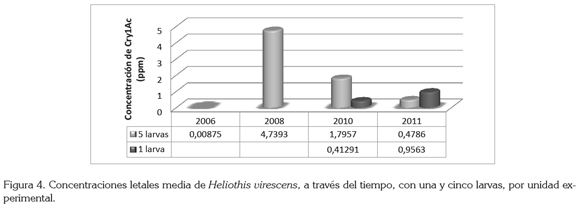
Efecto unidad experimental: Un factor que puede estar influenciando la fluctuación en la susceptibilidad (figura 4) es el número de larvas utilizadas por unidad experimental, pues se observó que la cantidad de insectos al final del ensayo era inferior al número de insectos puestos inicialmente, correspondiendo, posiblemente, al comportamiento de canibalismo que exhibe esta especie (Capinera, 2004). Este comportamiento, se observó con mayor frecuencia a medida que la concentración de la proteína aumentaba, pues las larvas tienden a evitar el alimento en donde existe una concentración de la proteína Cry (Gore et al. 2005), lo que las induce a consumir alimento con poca concentración de la proteína, llevándolas, eventualmente, a alimentarse de las otras larvas.
Como se muestra en la figura 4, la CL50 para el bioensayo, en donde se utilizaron cinco larvas por recipiente, se redujo 4,33 veces de 2010 al 2011, a diferencia de la CL50, en la que se utilizó una larva por recipiente, que aumentó 1,99 veces, para el mismo período.
Estos resultados pueden estar influenciados por el canibalismo, puesto que la mortalidad se puede leer como consecuencia del aparente consumo de proteína y no a causa de dicho comportamiento. Así que los resultados obtenidos con el ensayo, donde se utilizó una larva, se puedan atribuir al consumo de la proteína Cry, razón por la cual, al momento de establecer un bioensayo, se debe tener en cuenta el comportamiento que presenta esta especie en la naturaleza, donde se observa que la hembra suele depositar los huevos individualmente y de forma aislada (Hallman, 1978; García, 1976).
De los resultados obtenidos en esta investigación, se concluye que, independientemente de la concentración letal media obtenida en ambos bioensayos en el último año, se observó que la susceptibilidad de H. virescens se mantiene dentro del rango que el algodonero expresa de la proteína (1,67 a 4,42 ppm), reportado por Zenner de Polanía et al. (2008). Estas concentraciones permanecen por encima de la concentración máxima necesaria para controlar, por lo menos, la mitad de la población (1,95 ppm).
Álvarez et al. (1991) mencionan que la dinámica de las poblaciones de H. virescens no presentan ciclos definidos de infestación, por lo que, en cualquier momento, puede existir una alta densidad de esta plaga, razón por la cual, es importante seguir monitoreando la respuesta de susceptibilidad de esta especie a las proteínas Cry, con el fin de evitar la pérdida de esta herramienta en el manejo de plagas.
Los resultados confirmaron que la composición de las dietas merídicas utilizadas en bioensayos tienen influencia en la respuesta de susceptibilidad del bellotero, puesto que la dieta Shorey & Hale fue en la que se presentó una mayor susceptibilidad. Además, esta dieta no permitió completar el ciclo de vida de ninguno de los individuos. Del mismo modo, se observó que en la dieta ICRISAT se obtuvo un menor tiempo del estado larval, independiente de la concentración de la proteína, en comparación con las otras dos dietas; también fue la dieta en la que se presentaron los mayores pesos de pupas.
Además, se concluyó que la concentración letal media obtenida para Heliothis virescens, en el 2011 (0,956ppm), indica que el insecto ha perdido susceptibilidad a la proteína Cry1Ac expresada por el algodón Bollgard® I; sin embargo, este aun ejerce control sobre las larvas de esta especie, ya que el rango de expresión de la proteína es de 1,67 a 4,42 ppm de Cry1Ac.
Para el caso de H. virescens, que pone los huevos de forma individual, se sugiere que los bioensayos estén representados con una larva por unidad experimental, para aproximarse a lo que sucede en la naturaleza y, de esta manera, eliminar el efecto que tiene el canibalismo sobre los resultados de mortalidad.
Finalmente, es importante describir detalladamente los procedimientos y las herramientas utilizadas en un ensayo, con el fin de permitir a otros investigadores la reproducción del mismo y, de esta forma, evitar sacar conclusiones equivocadas sobre lo que realmente puede estar sucediendo, tanto en el experimento como en campo.
Agradecimientos: A la Universidad de Ciencias Aplicadas y Ambientales U.D.C.A, por el apoyo financiero a la presente investigación. Conflicto de intereses: El artículo fue preparado y revisado con la participación de todos los autores, quienes declaramos que no existe ningún conflicto de intereses que ponga en riesgo la validez de los resultados presentados.
BIBLIOGRAFÍA
1. AGRO-BIO. 2012. Una historia de logros importantes para la agricultura. Disponible desde Internet en: http://www.agrobio.org/fend/index.php?op=YXA9I2JXbDQmaW09I016UT0= (con acceso el 26/05/12).
2. AKHURST, R.J.; JAMES, W.; BIRD, L.J.; BEARD, C. 2003. Resistance to the Cry1Ac -endotoxin of Bacillus thuringiensis in the cotton bollworm Helicoverpa armigera (Lepidoptera: Noctuidae). J. Econ. Entomol. 96(4):1290-1299.
3. ALCARAZ, H. 1962. Instituto de Fomento Algodonero: Principales plagas del algodón en Colombia. Bol. Téc. 2:32-35.
4. ÁLVAREZ R., A.; SÁNCHEZ G., G.; ZENNER DE POLANÍA, I. 1991. Influencia de las condiciones ambientales en las poblaciones de Heliothis spp. (Lepidoptera: Noctuidae) en el algodonero. Rev. ICA. 26:197- 211.
5. ARÉVALO, H.A.; ZENNER DE POLANÍA, I. 2009. Evaluación de dietas merídicas para la cría en laboratorio de Spodoptera frugiperda (J.E. Smith) (Lepidoptera: Noctuidae). Rev. U.D.C.A Act. & Div. Cient. 12(1):79 -90.
6. ARÉVALO, H.A., ZENNER DE POLANÍA, I. 2010. Evaluation of meridic diets suitable for efficient rearing of Heliothis virescens (F.) (Lepidoptera: Noctuidae). Rev. U.D.C.A Act. & Div. Cient. 13(2):163-173.
7. ARÉVALO, H.A.; ZENNER DE POLANÍA, I.; ROMERO, L. 2011. Efecto de dietas merídicas en la toxicidad de la proteína cristalina (Cry) del Bacillus thuringiensis sobre tres plagas del algodonero (Lepidoptera: Noctuidae). Rev. U.D.C.A Act. & Div. Cient. 14(1):39-48.
8. BLANCO, C.A.; ALI, I.; LUTTRELL, R.; SIVASUPRAMANIAM, S.; MARTÍNEZ C., J. 2005. Susceptibility of four Heliothis virescens and Helicoverpa zea reference colonies to a homogeneous Cry1Ac incorporated insect diet: implications for an area wide monitoring program. Belt Cotton Conferences. National Cotton Council of America. New Orleans, Louisiana. p.1226-1233.
9. BLANCO, C.A.; STORER, N.P.; ABEL, C.A.; JACKSON, R.; LEONARD, R.; LÓPEZ, J.D.; PAYNE, G.; SIEGFRIED, B.D.; SPENCER, T.; TERÁN V., A.P. 2008. Baseline susceptibility of tobacco budworm (Lepidoptera: Noctuidae) to Cry1F toxin from Bacillus thuringiensis. J. Econ. Ent. 101(1):168-173.
10. BLANCO, C.A.; GOULD, F.; VEGA A., P.; JURAT, F.; JUAN, L.; PERERA, O.P.; CRAIG, A. 2009. Response of Heliothis virescens (Lepidoptera: Noctuidae) strains to Bacillus thuringiensis Cry1Ac incorporated into different insect artificial diets. J. Econ. Entom. 102(4):1599-1606.
11. BONACIC, I.; FOGAR, M.; GUEVARA, G.; SIMONELLA, M. 2010. Algodón. Manual de campo. INTA EEA Sáenz Peña. Argentina. p.23-24. Disponible desde Internet en: http://rian.inta.gov.ar/agronomia/Manual_Algodon.pdf(con acceso el 01/12/10).
12. BOWLING, C.C. 1967. Rearing of two lepidopterous pests of rice on a common artificial diet. Ann. Ent. Soc. Am. 60(6):1215-1216.
13. BRUNS, H.A.; ABEL, C.A. 2003. Nitrogen fertility effects on Bt d-endotoxin and nitrogen concentrations of maize during early growth. Agronomy J. 95:207- 211.
14. BUSTILLO, A.E. 1979. La nutrición en insectos. Sociedad Colombiana de Entomología. Medellín. Boletín de Divulgación. Número 2. 43p.
15. CAPINERA, J.L. 2004. Tobacco budworm, Heliothis virescens (Fabricius) (Insecta: Lepidoptera: Noctuidae). University of Florida. IFAS Extension. 7p.
16. CERÓN, J. 2004. Productos Comerciales: Nativos y Recombinantes. En. Bravo, A.; Cerón, J. (eds) Bacillus thuringiensis en el control biológico. Ed. Buena Semilla. (Colombia). p.123-147.
17. CHEN, D.; YE, G.; YANG, C.; CHEN, Y.; WU, Y. 2005. The effect of high temperature on the insecticidal properties of Bt cotton. Environm. Experiment. Bot. 53:333-342.
18. DONG, H.Z.; LI, W.J. 2007. Variability of endotoxin expression in Bt transgenic cotton. J. Agr. Crop Sci. 193:21-29.
19. GAHAN, L.J.; PAUCHET, Y.; VOGEL, H.; HECKEL, D.G. 2010. An ABC transporter mutation is correlated with insect resistance to Bacillus thuringiensis Cry1Ac toxin. PloS Genet. 6(12):1-11.
20. GARCÍA R., F. 1976. El Complejo Heliothis, sus huéspedes y sus hábitos. Rev. Col. Entomol. 2(3):75-94.
21. GARCÍA, M.S.; BUSATO, G.R.; GIOLO, F.P.; MANZONI, C; BERNARDI, O.C.; ZART, M.; NUNES, A.M. 2006. Tabela de vida de fertilidade de Helicoverpa zea (Boddie, 1850) (Lepidoptera: Noctuidae) em duas dietas artificiais. Rev. Bras. Agrocienc. (Pelotas). 12(1):51-55.
22. GORE, J.; ADAMCZYK, J.J.; BLANCO, A. 2005. Selective feeding of tobacco budworm and bollworm (Lepidoptera: Noctuidae) on meridic diet with different concentrations of Bacillus thuringiensis proteins. J. Econ. Entomol. 98(1):88-94.
23. GREENE, G.L.; LEPLA, N.C.; DICKERSON, W.A. 1976. Velvetbean caterpillar: a rearing procedure and artificial medium. J. Econ. Entomol. 69(4):487-488.
24. HALLMAN, G. 1978. Claves taxonómicas para las especies de Heliothis (Lepidoptera: Noctuidae) en Colombia. Rev. Col. Entomol. 4(3-4):61-69.
25. JANMAAT, A.F.; MYERS, J. 2003. Rapid evolution and the cost of resistance to Bacillus thuringiensis in greenhouse populations of cabbage loopers, Trichoplusia ni. Proc. R. Soc. Lond. B Biol. Sci. 270:2263-2270.
26. MARTÍNEZ, J.W. 2004. Evaluación de la toxicidad de Bacillus thuringiensis. En. Bravo, A.; Cerón, J. (eds). Bacillus thuringiensis en el control biológico. Ed. Buena Semilla. (Colombia). p.207-232.
27. PARRA, J.R. 2001. Técnicas de criação de insetos para programas de controle biológico. Piracicaba: ESALQ. 134p.
28. PERLAK, F.J.; OPPENHUIZEN, M.; GUSTAFSON, K.; VOTH, R.; SIVASUPRAMANIAM, S.; HEERING, D.; CAREY, B.; IHRIG, R.A.; ROBERTS, J.K. 2001. Development and commercial use of Bollgard® cotton in the USA - early promises versus today's reality. The Plant J. 27(6):489-501.
29. SHELTON, A.M.; ROBERSON, J.L.; TANG, J.D.; PEREZ, C.; EIGENBRODE, S.D.; PRIESLER, H.K; WILSEY, W.T.; COOLEY, R.J. 1993. Resistance of diamondback moth (Lepidoptera: Plutellidae) to Bacillus thuringiensis subspecies in the field. J. Econ. Entomol. 86:697-705
30. SHOREY, H.H.; HALE, R.L. 1965. Mass-Rearing of the larvae of nine Noctuid species on simple artificial medium. J. Econ. Entomol. 58(3):522-524.
31. TABASHNIK, B.E.; VAN RENSBURG, J.B.J.; CARRIÈRE, Y. 2009. Field - evolved insect resistance to Bt crops: Definition, theory and data. J. Econ. Entomol. 102(6):2011-2025.
32. VILLACORTA, A.; COBO DE MARTÍNEZ, L.S. 1978. Efecto del modo de preparación de la dieta sobre el crecimiento y desarrollo de Spodoptera frugiperda. ICA (Colombia). p.96-103.
33. YU, S.J. 2008. The toxicology and biochemistry of insecticides. CRC Press. New York. p.93-102.
34. ZENNER DE POLANÍA, I.; BORRERO F., F. 1992. Panorama nacional de susceptibilidad del algodonero a insecticidas. Agr. Trop. (Colombia). 29(2):83-95.
35. ZENNER DE POLANÍA, I.; ÁLVAREZ, A.; ARÉVALO, H.; MEJÍA, R.; BAYONA, M. 2008. Susceptibilidad de cuatro noctuidos plaga (Lepidoptera) al gene Cry 1Ac del Bacillus thuringiensis incorporado al algodonero. Rev. Col. Entomol. 34(1):41-50.
Recibido: Agosto 30 de 2012 Aceptado: Octubre 25 de 2012

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.