CIENCIAS AGROPECUARIAS-Artículo Científico
EFECTO DEL FOTOPERIODO Y DEL ALIMENTO SOBRE LA PRODUCTIVIDAD DE DOS CLADÓCEROS NATIVOS (Moina sp. y Diaphanosoma sp.) DE LA ORINOQUIA COLOMBIANA
EFFECT OF THE PHOTOPERIOD AND FOOD ON PRODUCTIVITY OF TWO NATIVE CLADOCERANS(Moina sp. and Diaphanosoma sp.) OF THE COLOMBIAN ORINOQUIA
Marcela Muñoz1, Víctor Mauricio Medina2, Pablo Emilio Cruz-Casallas3
1 Bióloga Marina, e-mail: marce8407@gmail.com
2Médico Veterinario Zootecnista, M.Sc. en Ciencias Animales e-mail: mauriciomedina77@gmail.com
3Médico Veterinario Zootecnista, M.Sc. en Ciencias en Producción Animal, Ph.D. en Medi- cina Veterinaria, área Reproducción Animal, pecruzcasallas@unillanos.edu.co Grupo de Investigación sobre Reproducción y Toxicología de Organismos Acuáticos - GRITOX, Instituto de Acuicultura - Universidad de los Llanos, km 12 vía Puerto López, Villavicencio, Meta - Colombia.
Rev. U.D.C.A Act. & Div. Cient. 16(1): 167 - 174, 2013
RESUMEN
Los cladóceros, se consideran una opción para la larvicultura de peces, debido a su tamaño pequeño, rápido desarrollo, alta tasa de multiplicación, facilidad de cultivo, alto conte- nido de enzimas digestivas y facilidad de manipular su valor nutricional; sin embargo, no existen tecnologías para su cultivo masivo, que permitan reducir costos, por concepto de alimento en la producción de larvas. El objetivo del presente trabajo fue evaluar el efecto del fotoperiodo y tipo de alimento sobre el crecimiento de Moina sp. y Diaphanosoma sp., cultivados en recipientes de 3L, a una densidad de 10 ind.L-1. Se evaluaron tres periodos de luz: 0, 12 y 24 h y tres tipo de alimento: suspensión de algas (Chlorella vulgaris - 1 x 105cel.mL-1); suspensión de levaduras (Saccharomyces cerevisiae - 1 x 105cel.mL-1) y mezcla (50:50) de las dos. La densidad de la población, se determinó cada tres días, a partir de una muestra de 500mL, utilizando la cámara Bogorov y estereoscopio (50X). Se calculó la tasa específica de crecimiento (k), rendimiento (r), tiempo de duplicación (TD), densidad máxima y densidad final del cultivo. Moina sp. mostró los mejores resultados, cuando se cultivó con fotoperiodo de 12 horas de luz y se alimentó con la mezcla de microalga y levadura, mientras que Diaphanosoma sp. creció con 0 y 12 horas de luz, independientemente del tipo de alimento utilizado; no obstante, la mayor tasa de crecimiento se observó con la mezcla de microalga y levadura.
Palabras clave: Chlorella vulgaris, crecimiento, fotoperiodo, Saccharomyces cerevisiae.
SUMMARY
Cladocerans have become an option for fishfarmers due to their small size, rapid development, high multiplication rate, ease of cultivation, high content of digestive enzymes and easy handling of their nutritional value. However, no technologies for mass cultivation to reduce food costs in larvae production are available. The objective of the present study was to evaluate the effect of photoperiod and food type on growth of Moina sp. y Diaphanosoma sp. cultivated in flasks of 3L at a density of 10 ind.L-1. Three periods of light were evaluated: 0, 12 and 24h and three types of food: algae suspension (Chlorella vulgaris - 1 x 105cel.mL-1), yeast suspension (Saccharomyces cerevisiae - 1 x 105cel. mL-1) and the mixture (50:50) of both. Population density was determined every three days, from a sample of 500mL using Bogorov chamber and stereoscope (50X). Specific growth rate (k), yield (r), time of duplication (TD), maximum density and final density of the culture were calculated. Moina sp. showed the best results, when cultured under a photoperiod of 12 hours light and fed with the microalgae and yeast mixture, whereas Diaphanosoma sp. grew with a photoperiod of 0 and 12 hours light, regardless of the type of food used, although the highest growth rate was attained with the microalgae and yeast mixture.
Key words: Chlorella vulgaris, growth, photoperiod,Saccharomyces cerevisiae.
INTRODUCCIÓN
En piscicultura, el suministro de alimento que satisfaga las necesidades nutricionales en las fases de larvicultura y alevinaje es primordial para garantizar la sobrevivencia de los organismos y mejorar la producción (Torrentera-Blanco & Tacon, 1989). El uso de alimento vivo, fitoplancton y zooplancton, para el levante de larvas y de alevinos de peces, se ha convertido, en las últimas décadas, en una opción para los piscicultores, por constituir una adecuada fuente de nutrientes, con alto contenido de proteína, de carbohidratos y de ácidos grasos y poseer enzimas necesarias para el desarrollo y el crecimiento de las larvas, como proteinasas, peptidasa, amilasas, lipasas y celulasas (Sipaúba-Tavares & Rocha, 2003); sin embargo, la piscicultura ha tenido que enfrentar los altos costos que genera el uso de alimento vivo, principalmente, por los cistos de Artemia salina importados, que son los más utilizados para esta práctica (Velu & Munuswamy, 2003), debido a que no existen tecnologías de cultivo que permitan obtener masivamente poblaciones de especies nativas y, de esta forma, poder reducir los costos de su producción (Prieto et al. 2006).
Entre el zooplancton, los cladóceros han adquirido gran popularidad, debido a su tamaño pequeño, rápido desarrollo, alta tasa de multiplicación, facilidad de cultivo, alto contenido de enzimas digestivas y facilidad de manipular su valor nutricional (Dodson & Frey, 2001; Prieto, 2001); sin embargo, aún faltan estudios sobre la biología de diferentes especies de cladóceros con potencial, para ser utilizados como alimento vivo. Según Sipaúba-Tavares & Rocha (2003), con relación al plancton de agua dulce es preciso llevar a cabo estudios sobre su comportamiento reproductivo y las condiciones ambientales, para establecer sistemas eficientes de producción, a gran escala.
En el cultivo de los cladóceros y del zooplancton, en general, existen diversos factores que influyen sobre la reproducción y el desarrollo, afectando su producción; dentro de estos factores, se encuentran la calidad y la cantidad de alimento suministrado, el fotoperiodo, la temperatura y los agentes contaminantes, entre otros (Rodríguez-Estrada et al. 2003; Prieto & Atencio, 2008). Entre estos factores, el fotoperiodo es una variable que ha sido muy poco estudiada, aunque tiene gran importancia, debido a que la luz juega un papel importante en la síntesis de carotenoides de los huevos y es necesaria para la madurez sexual de los organismos (Torrentera-Blanco & Tacon, 1989); además, los ciclos diarios de luz y de oscuridad tienen una fuerte influencia sobre el comportamiento de los cladóceros, pues puede afectar directa o indirectamente patrones de locomoción, de alimentación, de reproducción y de muda (Starkweather, 1976).
Entre los trabajos realizados recientemente, se encuentra el de Martínez-Jerónimo (2012), quien estudió los efectos de dos temperaturas (20 y 25°C) y de dos fotoperiodos (12:12 and 16:8, luz:oscuridad) sobre el crecimiento de Daphnia magna y observó que la mejor tasa de crecimiento (0,182) ocurre cuando los organismos se cultivan a 25°C, con fotoperiodo de 12 h de luz y 12 de oscuridad.
También en D. magna, se estudiaron las estrategias reproductivas bajo la influencia de diferentes condiciones de alimentación, de fotoperiodo y de presencia de solventes y se encontró, como resultado, que un fotoperiodo corto altera la proporción de sexos en la población, al aumentar la producción de machos (Zhang & Baer, 2000). Korpelainen (1986) evaluó el efecto de la temperatura y del fotoperiodo sobre los parámetros de vida de D. magna, y observó que el fotoperiodo tiene influencia significativa sobre la sobrevivencia y la producción de machos.
Con relación al alimento, se han llevado a cabo varias investigaciones en cladóceros, enfocadas a la búsqueda de un alimento que permita su crecimiento satisfactorio y una adecuada composición bioquímica. La principal fuente de alimento de estos organismos son microalgas; sin embargo, por ser filtradores no selectivos, se pueden alimentar de diferentes sustancias, como levaduras, que se han convertido en una opción en la producción de zooplancton, al mostrar buenos resultados en su crecimiento (Santos et al. 2006; Prieto & Atencio, 2008; Ocampo et al. 2010). Prieto et al. (2006) llevaron a cabo un estudio en Moina sp. alimentándola con Ankistrodesmus sp. y Ankistrodesmus sp. más Saccharomyces cerevisiae y encontraron mejores resultados en el crecimiento del cladócero cuando lo alimentaron con la mezcla de microalga y de levadura.
Peña-Aguado et al. (2005), igualmente, evaluaron el crecimiento de Ceriodaphnia dubia y Moina macropopa, alimentados con Chlorella vulgaris, Scenedesmus acutus y S. cerevisiae en diferentes combinaciones, y obtuvieron los mejores resultados, cuando fueron alimentados con la mezcla de las dos microalgas. También en Moina macropopa, Jiménez et al. (2003) estudiaron el efecto de diferentes fuentes de alimento, como Scenedesmus abundans, S. cerevisiae y alimento para protozoeas de camarones marinos Z-plus; ellos hallaron la mayor densidad con este último alimento.
El objetivo del presente estudio fue evaluar el efecto del fotoperiodo y del tipo de alimento sobre el crecimiento de dos especies de cladóceros nativos de la Orinoquia colombiana.
MATERIALES Y MÉTODOS
La investigación, se llevó a cabo en el Laboratorio de Aguas y Alimento Vivo del Instituto de Acuicultura de la Universidad de los Llanos (IALL), localizado a 12km de Villavicencio, capital del departamento del Meta. El laboratorio, se encuentra ubicado a una altura de 418 msnm, con temperatura promedio de 25°C, precipitación pluvial anual de 4050 mm y humedad relativa del 75%.
Como material biológico, se utilizaron cladóceros del género Moina y Diaphanosoma, capturados de los estanques de la estación piscícola del Instituto de Acuicultura (IALL) de la Universidad de los Llanos (UNILLANOS) y luego llevados al laboratorio y sometidos a un periodo de aclimatación de un mes, al cabo, del cual, se inició la realización de los experimentos.
Se realizaron dos experimentos: en el primero, se evaluaron variables productivas bajo el efecto de diferentes fuentes de fotoperiodo y, en el segundo, bajo el efecto de diferentes fuentes de alimento. En ambos, los ejemplares se aislaron aleatoriamente y se alojaron a una densidad de siembra de 10 ind.L-1, en frascos de vidrio de 3L de capacidad con agua madurada, que se preparó dejando agua corriente en tanques con oxígeno durante una semana y se mantuvieron con aireación constante.
En el experimento 1, los organismos fueron alimentados con una suspensión algal de Ch. vulgaris, a una concentración de 1 x 105cel/mL. y fueron sometidos a tres regímenes diferentes de fotoperiodos, bajo una misma intensidad lumínica, proporcionada con lámparas fluorescentes comerciales de 75 watts (Phillips, Holanda), así: T1=0h de luz; T2=12h de luz y T3=24h de luz, de tal forma que se pudiera evaluar el crecimiento, bajo un régimen de luz permanente, de ausencia total de luz y con presencia y ausencia de luz en proporción 50:50. El encendido y el apagado de las lámparas, se controló con temporizadores digitales programables (Electric Line, USA). En el experimento 2, se utilizó el fotoperiodo más eficiente para cada especie, de acuerdo con los resultados encontrados en el experimento 1 y los organismos fueron sometidos a tres diferentes fuentes de alimento, así: T1=Suspensión de algas (C. vulgaris), a una concentración de 1 x 105cel.mL-1; T2=Suspensión de levaduras (S. cerevisiae), a una concentración de 1 x 105cel.mL-1 y T3=Mezcla de C. vulgaris y S. cerevisiae, en una proporción 50:50, para ambos casos, bajo las mismas concentraciones anteriores. La densidad del alimento, se determinó mediante recuento celular en cámara de Neubauer (Boeco Bright-line, Alemania), bajo un microscopio óptico (400X - Nikon E200, Japón).
En ambos experimentos, se midieron los parámetros fisicoquímicos iniciales del agua, con un pHmetro (Hanna, Italia), para temperatura (Experimento 1: 24,9°C, Experimento 2: 25,5°C) y pH (Experimento 1: 6,5 Experimento 2: 5,8), una sonda multiparamétrica (YSI Professional Plus, USA), para conductividad (3,51 μS/cm, en Experimento 1 y 2) y un Kit para amonio (0,00 mg/L, en Experimento 1 y 2) (Hach, USA). Durante los ensayos, se midió cada tres días temperatura y pH.
En todos los tratamientos, se realizaron el mismo número de replicas (6), las cuales, fueron asignadas aleatoriamente a las unidades experimentales de cada tratamiento. Para el conteo de organismos, se utilizó una muestra de 500 mL y se efectuó el recuento en una cámara Bogorov (Aquatic EcoSystems INC, USA), bajo estereoscopio (50X - Nikon SMZ80, Japón), cada tres días, durante 21 días de cultivo. Una vez a la semana, se llevó a cabo recambio de agua del 80%.
Como variables para evaluar el crecimiento poblacional, en cada tratamiento, se determinó: tasa específica de crecimiento k=(LnNt1-LnNt0)/t, rendimiento r=(Nt1-Nt0)/t, tiempo de duplicación TD=Ln2/k, densidad máxima (mayor número de individuos durante todo el periodo de cultivo), densidad final del cultivo (individuos.mL-1); en los casos anteriores, Nt1=número final de individuos expresados en mL, Nt0=número inicial de individuos expresados en mL y t=tiempo en días (Prieto et al. 2006).
Para el análisis estadístico, se empleó un diseño de clasificación experimental, donde los tratamientos se asignaron aleatoriamente. Los datos obtenidos fueron procesados, a través de estadística descriptiva y expresados como media ± error estándar de la media. Posteriormente, los datos fueron sometidos a pruebas de homogeneidad de varianza (Bartlett) y de normalidad (Kolmogorov-Smirnov). Debido a que los datos no cumplieron con los supuestos para los análisis de varianza, aún después de ser transformados, se procedió a analizar los datos, mediante estadística no paramétrica (Díaz-Cadavid, 1999). Por lo tanto, se realizó una prueba de Kruskall-Wallis, con el fin de determinar las diferencias entre los tratamientos y una prueba de Duncan, cuando se encontraron diferencias significativas. El análisis estadístico, se llevó a cabo mediante el programa GraphPad Prism versión 5.00, con un nivel de significancia de p<0.05.
RESULTADOS Y DISCUSIÓN
En el experimento 1, se encontraron diferencias significativas en Moina sp. (p<0,05), entre T2 (12h de luz) y T1 (0h de luz) y T3 (24h de luz). En los dos últimos tratamientos, se observó una disminución en la densidad de la población, la cual, llegó hasta 0,6 ± 0,6 Ind.L-1, en ambos casos, mientras que en T2, la densidad máxima y final de cultivo fue de 349,2 ±75,0 Ind.L-1. En Diaphanosoma sp., por su parte, se encontraron diferencias significativas (p<0,05), entre T1 y T3. La densidad máxima y final para T1 y T2 fue de 262,0 ± 122,1 y 151,4 ± 101,9 Ind.L-1, respectivamente. En T3, la densidad final de cultivo fue de 0,0 ± 0,0 Ind.L-1.
El ciclo circadiano es un factor fundamental en el desarrollo de los cladóceros, el cual, ha sido poco estudiado y es muy escasa la información que se encuentra publicada con relación a los efectos del fotoperiodo sobre el comportamiento de estos organismos, bajo condiciones de cultivo. Uno de los primeros trabajos realizados en el área fue el de Starkweather (1976), quien reportó que periodos continuos de luz o de oscuridad pueden afectar el comportamiento de los cladóceros al influir directa o indirectamente sobre los patrones de locomoción, de alimentación, de reproducción y de muda. Este hecho se ve reflejado en los resultados observados en el presente estudio, principalmente con Moina sp., que no mostró crecimiento alguno cuando se cultivó bajo fotoperiodos de 0 o de 24 horas de luz, al igual que en Diaphanosoma sp., que tampoco creció bajo un régimen de luz continua.
En ambos casos, el incremento en la concentración de la microalga que crece más rápido al estar mayor tiempo expuesta a la luz (Sipaúba-Tavares & Rocha, 2003), pudo haber afectado, directamente, la sobrevivencia de estos organismos, al obstruir su aparato filtrador y deteriorar la calidad del agua (Ovie & Ovie, 2008). El aumento en la concentración de la microalga durante el ensayo, se pudo observar fácilmente por la coloración verde oscura que tomaron los tratamientos, bajo el fotoperiodo de luz continua. En estudios anteriores, se ha encontrado que densidades superiores a 1,5 x 106 cel.mL-1 de Scenedesmus acuminatus inhiben el crecimiento de Moina micrura (Ovie & Egborge, 2002) y de D. excisum (Ovie & Ovie, 2008).
Con relación a la observación de que Diaphanosoma sp. haya crecido bajo la ausencia de luz, se puede explicar como un fenómeno de adaptación de la especie, que también se ha observado en el ambiente natural; Liu & Hu (2001) encontraron en un estudio realizado en China, una especie de Diaphanosoma que tendía a permanecer durante el día en las capas profundas de la columna de agua, posiblemente, para evitar la predación por peces u otros organismos invertebrados.
A pesar que en este caso los organismos no estaban expuestos a predadores, la cepa utilizada en los experimentos provenía de estanques de piscicultura, donde son susceptibles a la predación, lo que, posiblemente, haya provocado su adaptación a sobrevivir, bajo condiciones de baja luminosidad. Por este motivo, es necesario llevar a cabo estudios en el ambiente natural sobre la biología de los organismos que se quieren cultivar, para conocer cuáles son sus hábitos bajo estas condiciones, con el fin de simularlas en el laboratorio y obtener mejores resultados en su producción.
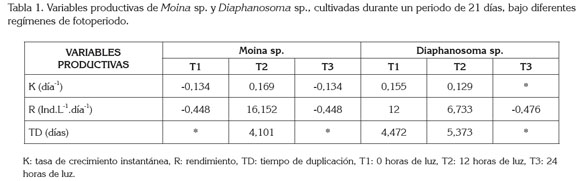
Las variables productivas de Moina sp. y Diaphanosoma sp., bajo diferentes regímenes de fotoperiodo, se pueden observar en la tabla 1. En Moina sp., el tratamiento que mostró mejores resultados fue el T2 (12h de luz), mientras que los valores de tasa específica y rendimiento obtenidos con T1 (0h de luz) y T3 (24h de luz) fueron negativos. No se reportaron valores de tiempo de duplicación para T1 (0h de luz) y T3 (24h de luz), debido a que no hubo crecimiento de la población.

En Diaphanosoma sp. no fue posible obtener la tasa específica de crecimiento de T3 (24h de luz), debido a que la densidad final en este tratamiento fue de 0; lo mismo ocurrió con el tiempo de duplicación, el cual, se calcula a partir de la tasa específica de crecimiento. Aunque no se encontraron diferencias significativas en el crecimiento de Diaphanosoma sp., entre el T1 (0h de luz) y el T2 (12h de luz), en el T1 (0h de luz), se obtuvo una mayor tasa de crecimiento, un mayor rendimiento y una menor tasa de duplicación en relación al T2.
Al comparar las mejores tasas de crecimiento obtenidas en el presente ensayo, en Moina sp., con 12 horas de luz (0,169) y en Diaphanosoma sp., con 0 horas de luz (0,155), estas estuvieron por debajo de las observadas por Martínez-Jerónimo (2012) en D. magna, quien también obtuvo la mejor tasa de crecimiento (0,182), cuando cultivó este cladócero con un fotoperiodo de 12 horas de luz.
Los valores promedios de pH y de temperatura para cada tratamiento en el cultivo de Moina sp. y Diaphanosoma sp., en el experimento 1, no mostraron diferencias significativas (p<0,05). En el cultivo de Moina sp., los valores de pH en los diferentes tratamientos se encontraron entre 4,4 y 6,1 y en el de Diaphanosoma sp., entre 4,6 y 6,2. La temperatura, por su parte, osciló entre 27,3°C y 28,6°C, en los tratamientos del cultivo de Moina sp. y, entre 27,1 y 28,7°C, en los tratamientos del cultivo de Diaphanosoma sp.
A diferencia del fotoperiodo, la alimentación es un factor que ha sido muy estudiado en los cladóceros, debido a que estos organismos son filtradores no selectivos (Santos et al. 2006; Prieto & Atencio, 2008; Ocampo et al. 2010), característica que permite alimentarlos con diversos productos, con el fin de mejorar su producción.
En el experimento 2, se utilizó un fotoperiodo de 12 horas de luz, para el cultivo de Moina sp. y, de 0 horas de luz, para el de Diaphanosoma sp., los cuales, corresponden a aquellos en los que se observaron los mejores valores de las variables productivas evaluadas en el experimento 1. A pesar de no observarse diferencias significativas entre el fotoperiodo de 0 h de luz y el de 12 h de luz en Diaphanosoma sp., se advirtió una tendencia a presentar mayor tasa de crecimiento y de rendimiento, con el primer régimen de fotoperiodo.
En Moina sp., se observó mortalidad del 100%, en el T1 (C. vulgaris) y la densidad poblacional fue diferente (P<0,05), entre T1 (C. vulgaris), comparada con T2 (S. cerevisiae) y T3 (C. vulgaris y S. cerevisiae). La densidad máxima y final alcanzada en T2 (S. cerevisiae) y T3 fue de 63,3 ± 15,3 y 344,0 ± 197,0 Ind.L-1, respectivamente.
En Diaphanosoma sp. no se observaron diferencias significativas (P>0,05) en las densidades, entre los diferentes tratamientos. La densidad máxima y final en T1 (C. vulgaris) y T2 (S. cerevisiae) fue de 54,3 ± 25,0 y 91,7 ± 23,8 Ind.L-1, respectivamente, mientras que en T3 (C. vulgaris y S. cerevisiae), la máxima densidad se alcanzó en el día 18, con 251,7 ± 80,2 Ind.L-1, para luego disminuir hacia el final del experimento (233,0 ± 73,6 Ind.L-1).
Las variables productivas de Moina sp. y Diaphanosoma sp., bajo los tres diferentes tipos de alimento, se observan en la tabla 2. En T1 (C. vulgaris) de Moina sp., no fue posible obtener la tasa de crecimiento específica ni el tiempo de duplicación, debido a que su densidad final fue 0. A pesar de no encontrarse diferencias significativas entre T2 (S. cerevisiae) y T3 C. vulgaris y S. cerevisiae), se observó una tendencia a presentar mayor tasa de crecimiento, mayor rendimiento y menor tiempo de duplicación en T3 (C. vulgaris y S. cerevisiae), comparado con T2 (S. cerevisiae). En Diaphanosomasp., a pesar de no existir diferencias significativas en las densidades entre tratamientos, se observó una tendencia a presentar mayor tasa de crecimiento específica, mayor rendimiento y menor tiempo de duplicación con T3 (C. vulgaris y S. cerevisiae), seguida de T2 y T1.
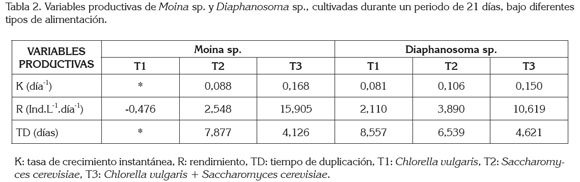
Trabajos realizados anteriormente por otros investigadores, coinciden en que una dieta basada solamente en levadura es pobre nutricionalmente para el desarrollo de los cladóceros y que estos organismos pueden ser útiles como suplemento nutricional, mas no como única fuente de alimento (Peña- Aguado et al. 2005).
Prieto et al. (2006), por ejemplo, encontraron mejores resultados en Moina sp., con una dieta basada en una mezcla de Ankistrodesmus sp. y S. cerevisiae que alimentándolo solamente con microalga; ellos registraron, con el primer tipo de alimento, una tasa de crecimiento de 0,325, un rendimiento de 1100 ind.L-1.d-1 y un tiempo de duplicación de 1,94 días, mientras que alimentados con microalga, la tasa de crecimiento fue de 0,267, el rendimiento de 500 ind.L-1.d-1 y el tiempo de duplicación de 2,6 días.
Estos resultados estuvieron por encima a los hallados en el presente trabajo, en el que la mayor tasa de crecimiento en Moina sp. fue de 0,168 y en Diaphanosoma sp. de 0,150. Jiménez et al. (2003), por su parte, observaron crecimiento en Moina sp., de 5571,42±1037,56 ind.L-1, alimentada sólo con levadura; sin embargo, su crecimiento fue menor que cuando se alimentó únicamente con microalga (7936,50±953,27 ind.L-1). En este caso, las densidades halladas por estos investigadores fueron muy superiores a las encontradas en el presente estudio, debido a que la densidad inicial de cultivo empleadas por ellos fue mayor (1000 ind.L-1).
Otro estudio realizado con levaduras es el de Ocampo et al. (2010), quienes usaron una densidad inicial de 25 ind.L-1, para cultivar D. magna, alimentándola con levadura enriquecida con ácidos grasos y obtuvieron una máxima densidad de 826 ind.L-1, una tasa de crecimiento de 0,258 y un tiempo de duplicación de 2,69 días.
Sin embargo, también se han realizado trabajos con diferentes fuentes de alimento, en los que se ha encontrado buenos resultados, como el llevado a cabo por Prieto (2001), quien evaluó dos especies de microalgas (Ankistrodesmus sp. y Chlorella sp.) por separado y en mezcla y observó mejores resultados con la mezcla de las microalgas, debido a que tenían un tamaño diferente, lo que disminuía la competencia entre neonatos y adultos. Es probable que lo mismo haya sucedido en el presente ensayo, pues a pesar de haber poca diferencia en el tamaño de la célula, entre la microalga (8μm) y la levadura (5μm), esto pudo haber permitido la disponibilidad de partículas de diferentes tamaños para neonatos y adultos, lo cual, Prieto et al. (2006) también concluyeron al alimentar a Moina sp., con una mezcla de Ankistrodesmus sp. y S. cervisiae.
En general, los resultados obtenidos en este trabajo estuvieron por debajo de los observados por otros investigadores; las máximas densidades halladas no superaron los 344,0 ind.L-1, en Moina sp. y los 251,7 ind.L-1, en Diaphanosoma sp., cuando se alimentaron con la mezcla, mientras que Romero et al. (2010) obtuvieron densidades máximas en Moina sp., alimentada con Chlorella sp., de 9000 ind.L-1, y en el trabajo de Sarma et al. (2003) encontraron en Moina macropopa, una densidad de 18000 ind.L-1 y, en Daphnia pulex, de 3000 ind.L-1, alimentadas con Ch. vulgaris.
No obstante, las investigaciones anteriores emplearon densidades iniciales de cultivo superiores a los 200 ind.L-1, muy superior a la dispuesta en el presente trabajo (10 ind.L-1.), lo que corrobora lo que se ha encontrado en otros estudios, en los que se ha observado que bajas densidades generan una falla en la iniciación del cultivo en masa de M. mongólica y que la mínima densidad requerida para iniciar un cultivo de esta especie es de 150 ind.L-1 (Wang et al. 2009), por lo que es muy probable que las bajas densidades y tasa de crecimiento, se deban a que la densidad de siembra fue muy baja para una adecuada iniciación del cultivo; sin embargo, las tasas de crecimiento del presente estudio fueron similares a las halladas en M. macopopa, en el trabajo realizado por Nandini et al. (2004), quienes obtuvieron una tasa de 0,19, cuando la cultivaron en aguas residuales y de 0,15, cuando la cultivaron sólo en microalga (Ch. vulgaris).
Los valores promedios de pH y de temperatura para cada tratamiento en el cultivo de Moina sp. y Diaphanosoma sp., en el experimento 2, no mostraron diferencias significativas (P<0,05). En el cultivo de Moina sp., los valores de pH en los diferentes tratamientos, se encontraron entre 4,2 y 5,7 y en el de Diaphanosoma sp., entre 5,4 y 5,7. La temperatura, por su parte, osciló ente 27,4°C y 27,6°C, en los tratamientos del cultivo de Moina sp. y, entre 26,5 y 26,8°C, en los tratamientos del cultivo de Diaphanosoma sp.
A pesar que en el primer ensayo las dos especies de cladóceros mostraron crecimiento alimentadas sólo con microalga y que otros estudios, como el de Rodríguez-Estrada et al. (2003) reportan buen crecimiento en M. micrura, alimentada con Scenedesmus incrassatulus (k=0,75) y con Ankistrodesmus falcatus (k=0,6), en el segundo experimento del presente ensayo no se observó crecimiento alguno de Moina sp., alimentada con la microalga.
Esto se puede explicar por los efectos del pH en el cultivo de Moina sp., en este tratamiento, los cuales, estuvieron un poco por debajo a los niveles que se manejaron en el primer ensayo y esta pequeña diferencia, aunque no significativa estadísticamente, biológicamente sí pudo tener influencia sobre la sobrevivencia de los organismos. Según Rottmann et al. (2003), los valores de pH óptimos para el buen desarrollo de Moina son entre 7 y 8, de lo contrario, el incremento de las formas no ionizadas de amonio, que son altamente tóxicas, pueden inhibir la producción del zooplancton.
A pesar que los cladóceros pudieron crecer en tratamientos que presentaron un pH por debajo de 6,2, las tasas de crecimiento fueron inferiores a las reportadas por otros autores en diferentes especies de cladóceros. Lo anterior, posiblemente, por la acidez del medio en el que se encontraban, que pudo generar una situación de estrés y, al reducirse un el pH, se pudo afectar, severamente, la sobrevivencia de los organismos en el tratamiento de microalga, sumado al efecto adverso que genera el exceso de alimento.
Es por esta razón, que se hace indispensable profundizar en estudios sobre las diferentes variables ambientales que pueden tener efecto sobre el desarrollo de las especies de cladóceros que se quieren cultivar, para de esta forma poder tener mayor control sobre su producción.
En conclusión, Moina sp. crece mejor cultivada con un fotoperiodo de 12 horas de luz y alimentada con una mezcla de microalga y levadura, mientras que Diaphanosoma sp. crece igualmente con un fotoperiodo de 0 o de 12 horas de luz y presenta igual crecimiento con las diferentes fuentes de alimento; sin embargo, existe una tendencia a presentar mayor crecimiento con un fotoperiodo de 0 horas de luz, alimentada con la mezcla de microalga y levadura.
También es necesario realizar nuevos estudios, donde se involucren otras variables ambientales, que pueden afectar el crecimiento de las especies nativas de la Orinoquia, para de esta forma poder tener un control más preciso sobre el cultivo de estos organismos e implementar su producción a gran escala.
Agradecimientos: Los autores agradecen a la Profesional en Acuicultura Angélica María Otero Paternina, por su colaboración en los montajes del ensayo y al estudiante de Ingeniería Pecuaria Wilson Cáceres, por su apoyo en la parte experimental, durante todo el ensayo. Financiación: El presente trabajo fue realizado en el marco del convenio 190 de 2010, suscrito entre el Departamento Administrativo de Ciencia, Tecnología e Innovación Francisco José de Caldas (COLCIENCIAS) y la Universidad de los Llanos. Conflictos de intereses: El manuscrito fue preparado y revisado con la participación de todos los autores, quienes declaramos que no existe ningún conflicto de interés que ponga en riesgo la validez de los resultados presentados.
BIBLIOGRAFÍA
1. DÍAZ-CADAVID, A. 1999. Diseño estadístico de experimentos. Editorial Universidad de Antioquia (Colombia). 347p.
2. DODSON, S.I.; FREY, D.G. 2001. Cladocera and other Brachiopoda. In: Thorp, J.H.; Covich, A.P. (eds.) Ecology and classification of North American freshwater invertebrates. 2nd ed. Acad. Press (USA). p.849-913.
3. JIMÉNEZ, D.; ROSAS, J.; VELÁSQUEZ, A.; MILLÁN, J.; CABRERA, T. 2003. Crecimiento poblacional y algunos aspectos biológicos del cladocero Moina macrocopa (Straus, 1820) (Branchiopoda, Anomopoda), alimentado con tres dietas en tres salinidades diferentes. CIENCIA (Venezuela). 11(1):22-30.
4. KORPELAINEN, H. 1986. The effects of temperature and photoperiod on life history parameters of Daphnia magna (Crustacea: Cladocera). Freshwater Biol. (Inglaterra). 16(5):615-620.
5. LIU, Z.; HU, Y. 2001. Vertical Distribution of the Dominant Planktonic Crustaceans in a Mesotrophic Reservoir, Xujiahe Reservoir (Central China). Limnologica (Alemania). 31:171-178.
6. MARTÍNEZ-JERÓNIMO, F. 2012. Description of the individual growth of Daphnia magna (Crustacea: Cladocera) through the von Bertalanffy growth equation. Effect of photoperiod and temperature. Limnology (Japón). 13:1-7.
7. NANDINI, S.; AGUILERA-LARA, D.; SARMA, S.S.S.; RAMÍREZ-GARCÍA, P. 2004. The ability of selected cladoceran species to utilize domestic wastewaters in Mexico City. J. Environm. Managem. (USA). 71:59-65.
8. OCAMPO, L.E.; BOTERO, M.C.; RESTREPO, L.F. 2010. Evaluación del crecimiento de un cultivo de Daphnia magna alimentado con Saccharomyces cereviseae y un enriquecimiento con avena soya. Rev. Col. Cienc. Pec. 23:78-85.
9. OVIE, S.I.; OVIE, S.O. 2008. Population Growth of the Freshwater Cladoceran, Diaphanosoma excisum, Fed Different Densities of the Alga, Scenedesmus acuminatus. The Israeli J. Aquacult. Bamidgeh 60(2):107-112.
10. OVIE, S.I.; EGBORGE, A.B.M. 2002. The effect of different algal densities of Scenedesmus acuminatus on the population growth of Moina micrura Kurz (Crustacea: Anomopoda, Moinidae). Hydrobiologia (Bélgica). 477:41-45.
11. PEÑA-AGUADO, F.; NANDINI, S.; SARMA, S.S.S. 2005. Differences in population growth of rotifers and cladocerans raised on algal diets supplemented with yeast. Limnologica. 35:298-303.
12. PRIETO, M.; ATENCIO, V. 2008. Zooplancton en la larvicultura de peces neotropicales. Rev. MVZ Córdoba (Colombia). 13(2):1415-1425.
13. PRIETO, M.; DE LA CRUZ, L.; MORALES, M. 2006. Cultivo experimental del cladócero Moina sp. alimentado con Ankistrodesmus sp. y Saccharomyces cerevisiae. Rev. MVZ Córdoba. 11(1):705-714.
14. PRIETO, M. 2001. Aspectos reproductivos del cladócero Moinodaphnia sp. en condiciones de laboratorio. Rev. MVZ Córdoba. 6(2):102-110.
15. RODRÍGUEZ-ESTRADA, J.; VILLASEÑOR-CÓRDOBA, R.; MARTÍNEZ-JERÓNIMO, F. 2003. Efecto de la temperatura y tipo de alimento en el cultivo de Moina micrura (Kurz, 1874) (Anomopoda: Moinidae) en condiciones de laboratorio. Hidrobiológica. (México). 13(3):239-246.
16. ROMERO, T.J.; MANSO, B.; LÓPEZ, R.; MARTÍNEZ, F.; MORENO, M. 2010. Producción de Moina sp. alimentada con Chlorella spp. cultivada con riles orgánicos de la industria pesquera cubana. REDVET (España). 11(12): 1-20.
17. ROTTMANN, R.W.; SCOTT-GRAVES, J.; CRAIG-WAT- SON; YANONG R.P.E. 2003. Culture Techniques of Moina : The Ideal Daphnia for Feeding Freshwater Fish Fry. Circular 1054, Department of Fisheries and Aquatic Sciences, Florida Cooperative Extension Service, Institute of Food and Agricultural Sciences, University of Florida. 7p.
18. SANTOS, M.A.P.F.; MELÃO, M.G.G.; LOMBARDI, A.T. 2006. Life history characteristics and production of Ceriodaphnia silvestrii Daday (Crustacea, Cladocera) under different experimental conditions. Acta Limnol. Bras. 18(2):199-212.
19. SARMA, S.S.S.; MANGAS-RAMIREZ, E.; NANDINI, S. 2003. Effect of ammonia toxicity on the competition among three species of cladocerans (Crustacea:Cladocera). Ecotoxicol. Environm. Safety (USA). 55:227-235.
20. SIPAÚBA-TAVARES, L.H.; ROCHA, O. 2003. Produção de PlÂncton (FitoplÂncton e ZooplÂncton) para alimentação de Organismos Aquáticos. RiMa editora (Brasil). 106p.
21. STARKWEATHER, P.L. 1976. Influences of light regime on postembryonic development in two strains of Daphnia pulex. Limnol. Oceanography (USA). 21(6):830-837.
22. TORRENTERA-BLANCO, L.; TACON, A.G.J. 1989. La producción de alimento vivo y su importancia en acuicultura. AQUILA- Apoyo a las Actividades Regionales de Acuicultura para América Latina y el Caribe. Project Reports No. 12. 90p.
23. VELU, C.S.; MUNUSWAMY, N. 2003. Nutritional evaluation of decapsulated cysts of fairy shrimp (Streptocephalus dichotomus) for ornamental fish larval rearing. Aquacult. Res. (Inglaterra). 34:967-974.
24. WANG, Y.; XIE, N.; WANG, W. 2009. Effects of algal concentration and initial density on the population growth of Diaphanosoma celebensis Stingelin (Crustacea, Cladocera). Chinese J. Oceanol. Limnol. 27(3):480-486.
25. ZHANG, L.; BAER, K.N. 2000. The influence of feeding, photoperiod and selected solvents on the reproductive strategies of the water flea, Daphnia magna. Environm. Poll. (USA). 110:425-430.
Recibido: Mayo 18 de 2012 Aceptado: Enero 29 de 2013

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.