
CIENCIAS EXACTAS Y NATURALES-Artículo Científico
DENSIDAD, COMPOSICIÓN DE GRUPO Y DISTRIBUCIÓN VERTICAL DE PRIMATES SIMPÁTRICOS EN UN BOSQUE DE GALERÍA FRAGMENTADO, COLOSÓ, SUCRE - COLOMBIA
DENSITY, GROUP COMPOSITION AND VERTICAL DISTRIBUTION OF SYMPATRIC PRIMATES IN A GALLERY FOREST FRAGMENT, COLOSÓ, SUCRE - COLOMBIA
Jaime De La Ossa V1, Silvia Galván-Guevara2, Alirio Fajardo-Patiño3
1Lic. Biología, Dr. Ciencias, Universidad de Sucre, Facultad de Ciencias Agropecuarias, Grupo de Investigación en Biodiversidad Tropical, Colombia: Carrera 28 N° 5-267, Puerta Roja, Sede Principal, Sincelejo, Sucre, Colombia jaimedelaossa@yahoo.com
2Bióloga, M.Sc. Fundación George Dahl, Colombia.
3Biólogo, M.Sc Sistemática, Fundación George Dahl, Colombia
Rev. U.D.C.A Act. & Div. Cient. 16(1): 185 - 192, 2013
RESUMEN
El presente trabajo determina la distribución vertical entre tres especies de primates simpátricos que habitan una porción fragmentada del arroyo Colosó, departamento de Sucre, Colombia. Dicha formación es un remanente de bosque seco tropical, que se estructura como una formación característicamente freatofita y que, debido a las fuertes presiones de deforestación existentes en la zona, se convierte en un importante refugio para la fauna silvestre local. Alouatta seniculus seniculus es la especie de mayor sedentarismo y utiliza los estratos superiores de la vegetación, mientras que Cebus capucinus capucinus y Saguinus oedipus forrajean en diferentes estratos del bosque, sin diferencia entre ellos (p<0,05). La distancias mínimas mantenidas durante los encuentros varían según la especie: entre A. s. seniculus con C. c. capucinus es de 10 a 18m, mientras que con S. oedipus es de 3 y 11m. Por su parte C. c. capucinus con S. oedipus mantienen una distancia entre 30 y 58m. El tamaño del grupo determinado para A. s. seniculus fue de siete individuos, de 4,5 individuos para S. oedipus y de seis individuos para C.c. capucinus. La densidad total calculada fue de: 0,30 ind/ha, 0,19 ind/ha y de 0,13 ind/ha, respectivamente, para las tres especies.
Palabras clave: Densidad, composición de grupo, primates simpátricos, Colosó, Colombia.
SUMMARY
The present work determined the vertical distribution among three species of sympatric primates that inhabit fragment portions of the Colosó stream, department of Sucre, Colombia. This formation is a remainder of a tropical dry forest that is structured like a characteristically freatofitic formation and that, due to the strong existent deforestation pressure in the area, becomes an important refuge for the local wildlife. Alouatta seniculus seniculus is the more sedentary species and uses the high vegetation strata, while Cebus capucinus capucinus and Saguinus oedipus forage in all strata of the forest without difference among them (p <0.05). The minimum distances maintained during the encounters vary according to the species: among A. s. seniculus with C. c. capucinus is from 10 to 18m, while with S. oedipus it is of 3 and 11m. On the other hand C. c. capucinus with S. oedipus maintains a distance between 30 and 58m. The size of the group determinated for A. s. seniculus was seven individuals, 4.5 individuals for S. oedipus and six individuals for C. c. capucinus. The calculated total density was of: 0.30 ind/ha, 0.19 ind/ha and of 0.13 ind/ha, respectively, for the three species.
Key words: Density, group composition, sympatric primates, Colosó, Colombia.
INTRODUCCIÓN
Se define simpatría como concordancia geográfica en la presencia de individuos, poblaciones o especies distintas (Soler at al. 2001). En los primates neotropicales, diversos trabajos registran la existencia de simpatría (Pozo, 2009). Varias especies de primates pueden vivir en simpatría diferenciando el uso de hábitat, recursos alimentarios, estrato arbóreo y técnicas de forrajeo (Siemers, 2000; Stevenson et al. 2000; Vilela, 2007).
Se tienen registros de simpatría en poblaciones de los géneros: Ateles, Alouatta y Cebus (Buckley, 1983), Callithrix, Cebus y Alouatta (Queiroz, 1991). Entre diferentes especies de un mismo género: Alouatta seniculus y A. caraya (Wallace et al. 1998), Cebus apella y C. olivaceus (Youlatos, 1998), Saguinus fuscicollis y S. mystax (Heymann et al. 2002), S. fuscicollis y S. tripartitus (Heymann et al. 2000); entre diferentes especies del mismo infraorden: Ateles paniscus y A. seniculus (Simmen, 1992), Callimico goeldii, S. fuscicollis y S. labiatus (Fleage, 1999). En el caso del Alouatta seniculus, de forma específica y debido a su amplia distribución geográfica, se reconoce la existencia de simpatría con otras especies de primates, que incluyen a miembros de los géneros Callithrix, Saguinus, Saimiri, Aotus, Callicebus, Pithecia, Cacajao, Cebus, Lagothrix y Ateles (Peres, 1997).
El presente artículo documenta la simpatría existente entre grupos de Alouatta seniculus seniculus, Cebus capucinus capucinus y Saguinus oedipus en un fragmento de bosque freatofíto del arroyo Colosó, en los Montes de María, departamento de Sucre, Colombia.
MATERIALES Y MÉTODOS
Área de estudio: Parte media del arroyo Colosó, departamento de Sucre, Colombia (9°27'31''N -75°21'38''O y 9°28'26''N - 75°20'56''O), con una altura mínima de 95 m.s.n.m y máxima de 116 m.s.n.m. Se cubrió un área total de 46,58ha.
El área de estudio, se caracteriza por ser una formación típica de bosque seco tropical, que estructura bosques de galería fragmentados, con altura media de 19m (máx. 26m) y rodeados por zonas ampliamente taladas, con fines agrícolas, se les cataloga como higrotropofíticos (Cuervo et al. 1986), con dominancia de Anacardium excelsum (caracolí), a orilla del arroyo y codominancia en los bordes de Sterculia apetala (camajón), Brownea sp. (arizal) y Albizzia sp. (guacamayo), con dominancia de Bactris minor (corozo), en estrato subordinado y medio. En total, se obtuvo una cobertura del 70%, mediante densiómetro esférico.
Técnicas de muestreo: Entre junio y agosto de 2010, se adelantó una prospección primatológica, mediante la realización de un transecto lineal (2.740m de longitud y 17m de ancho mínimo promedio a cada lado), con 15 repeticiones, una por día (Schaik, 1992); se obtuvo información poblacional y registro sobre uso de los estratos del bosque y distancia inter-específica de los individuos avistados, con referencia a los tres taxones de primates hallados. Durante 10 días continuos, entre la 06:00 y las 17:00 horas, se establecieron dos puntos fijos de avistamiento (Marsden, 1999), ubicados a 1/3 del inicio y a 1/3 del final del transecto, los cuales, eran trabajados de forma alterna; se hicieron observaciones de los distintos grupos de las especies de primates registradas, para verificar la información poblacional obtenida en los transectos lineales.
Análisis de información: Previa verificación de la normalidad de los datos para uso del estrato y distancia inter-específica, se aplicó ANOVA y para discriminar entre las medias, se usó el procedimiento de diferencia mínima significativa (LSD) de Fisher (Zar, 1996).
RESULTADOS Y DISCUSIÓN
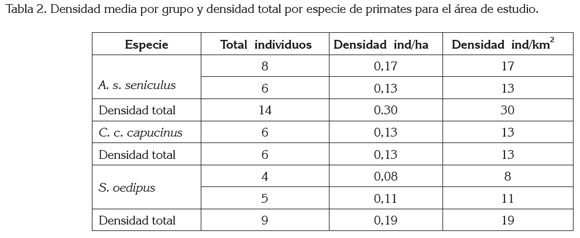
El estudio permitió registrar la presencia de tres taxones de primates A. s. seniculus, C. c. capucinus y S. oedipus. Los grupos detectados por taxón y la composición de grupo, se presentan en la tabla 1; los cálculos de densidad media por grupo y densidad total por especie en la tabla 2.

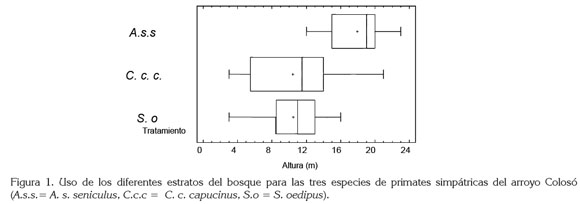
El estrato arbóreo utilizado por cada una de las tres especies de primates simpátricas en este trabajo es el siguiente: A. s. seniculus, ocupa 17,9m (12-23); C. c. capucinus, 10m (3-21) y S. oedipus, 10,4m (3-16). Al comparar estadísticamente los datos obtenidos mediante ANOVA, se determinó que existe diferencia significativa entre grupos (F=21.3248, gl=2, p<0,05), discriminándose la diferencia para A. s. seniculus, como ocupante preferencial del dosel superior del bosque; C. c. capucinus y S. oedipus pueden estar presentes en todos los estratos, preferencialmente, se ubican en los estratos bajo y medio, sin diferencia significativa entre ellos (p>0,05) (Figura 1).
La distancia inter-específica mantenida entre grupos muestra diferencia significativa al aplicar ANOVA (F=466.503, gl=2, p<0,005). Las distancias entre grupos durante los encuentros varían según la especie: para A. s. seniculus con C. c. capucinus, de 10 a 18m; A. s. seniculus con S. oedipus, de 3 a 11m y entre C. c. capucinus y S. oedipus, mantienen de 30 a 58m. Discriminadamente, existe diferencia significativa (p<0,005) entre C. c. capucinus y S. oedipus (Figura 2).

Tomando como base de cálculo los pesos por categoría (Napier & Napier, 1967), se muestra en la tabla 2 el aporte de biomasa,formada por los primates detectados en la zona de estudio.
En lo referente a tamaño de grupo para A. s. seniculus, se obtuvo una media de 7,5 ind/grupo, valor que se encuentra dentro de lo establecido para la especie, concordante con los hallazgos para fragmentos aislados (Arroyo-Rodríguez & Dias, 2010) y similar al rango de 5,1-7,0 ind/grupo hallado para la misma zona (Ochoa et al. 2011). Para Colombia, en bosque Andino, se tiene registro promedio de 6 ind/grupo, con un recorrido de 3 a 9 individuos, lo cual, también se ajusta a lo registrado en este trabajo (Morales-Jiménez, 2002).
En general y de forma coincidente, se sabe que el tamaño del grupo puede variar entre 5 y 9,6 ind/grupo y que está definido por la oferta de hábitat (De La Ossa & Fajardo, 1996; Ochoa et al. 2011).
Para C. c. capucinus, con un sólo grupo detectado, el tamaño de la especie está por debajo del valor mínimo del registrado para el grupo, que se ubica entre 7 y 36 ind/grupo (media de 17,2) (Fedigan & Jack, 2001), lo que se podría interpretar como reducción poblacional por efecto limitante de hábitat, causado por la fragmentación.
Por su parte S. oedipus presenta una densidad mayor que la de C. c. capucinus, y menor que la de A. s. seniculus, lo cual, no se ajusta a lo hallado en este trabajo, debido a que el estudio referenciado, aunque se realizó en la misma zona, existe una diferencia en tiempo de 35 años, lo que muestra un deterioro poblacional atribuible, entre otros factores, a fragmentación de ecosistemas boscosos. Tomando la información más reciente, se tiene que el tamaño del grupo es de 4,34 individuos (Savage et al. 2010), valor que se ajusta a los 4,5 ind/grupo, reportados en este estudio, siendo similar al valor mínimo establecido por Neyman (1977), de 3 a 13 ind/grupo. Lo que permite evidenciar el decremento de la densidad poblacional, debido a fragmentación y reducción de conectividad entre los parches remanentes (Arroyo- Rodríguez & Mandujano, 2009; Arroyo-Rodríguez & Dias, 2010).
La fragmentación de hábitat es una de las principales amenazas para los primates y se estima que los efectos negativos de la fragmentación afectan su biología y su ecología, siendo factor de deterioro poblacional nocivo y extinción local (Arroyo-Rodríguez & Mandujano, 2009); el mantenimiento de la estructura y función de sus ecosistemas se ve seriamente afectado por la fragmentación, impactando negativamente alimentación, tamaño y estructura poblacional, entre otros aspectos ecológicos importantes (Stoner et al. 2007).
La composición de grupo muestra para A. seniculus un valor que se asemeja a lo hallado por Kimura (1992), quien registra una relación de sexos de 1,5 machos por hembras. Igualmente, concuerda con lo establecido para un grupo típico, que posee un promedio de dos o tres hembras adultas, uno o dos machos adultos, un juvenil y un infantil, con un promedio de 7,3 a 5,3 ind/grupo (Braza et al. 1981).
En cuanto a la composición etaria, los valores se acercan al 73,3% de individuos adultos, establecido por Morales- Jiménez (2002), pero difieren en la proporción por estos mismos autores, establecida de 1:1 macho: hembra. Aunque existe una pronunciada tendencia por un único macho adulto que se presenta como la cabeza de grupo, los grupos tienen generalmente dos adultos machos y el promedio de adultos machos; en poblaciones estudiadas en Venezuela, se determinó 1,65 machos/grupo (Eisenberg, 1989), valor que guarda correspondencia con lo que en este trabajo fue hallado.
La composición del grupo para C. capucinus difiere de los valores más actualizados reportados por Fedigan & Jack (2001), quienes hallaron una proporción entre sexos de: machos adultos (17-25%), hembras adultas (27-34%), juveniles (27-41%) e infantiles (10-18%). Es notoria la ausencia de infantiles en el grupo detectado y una relativa alta proporción de adultos; igualmente, llama la atención, el nulo índice de hembras con cría, lo que refuerza el planteamiento de los efectos nocivos del aislamiento para esta especie, en el área de estudio y sus consecuencias en la reproducción.
S. oedipus, según Savage et al. ( 2010), presenta en promedio una composición de grupo de 88,3 % adultos, 8,3% juveniles y 3,4% infantes. Lo que representa una relación maduros: inmaduros de 7,5:1 (Savage et al. 2010), que se ajusta a los valores obtenidos para adultos en este trabajo, pero que muestra un desbalance respecto de los individuos inmaduros, representados totalmente por juveniles, con ausencia absoluta de infantiles, tal como sucede con el grupo de C. c. capucinus, antes analizado.
Es notorio, al comparar, que tanto la composición de grupo como la estructura etaria para A. seniculus, no han sufrido cambios promedios entre los fragmentos estudiados y bosques mejor conservados de hace varias décadas (Braza et al. 1981; Eisenberg, 1989; Kimura, 1992). No se puede decir lo mismo para C. capucinus (Fedigan & Jack, 2001) y aunque la situación de S. oedipus es menos grave que la de C capucinus, sí se muestra una deterioro de la estructura poblacional al comparar los datos de Savage et al. ( 2010) con los de Neyman (1977).
La densidad hallada para A. seniculus es comparativamente baja; no obstante, se ubica en el nivel mínimo del rango establecido por Stevenson (1991), que es de 10 a 118 ind/ km2. Concordante para la misma zona en su nivel menor, según lo establecido por Ochoa et al. (2011), que oscila entre 17,4 y 116 ind/km2. Las diferencias en tal sentido pueden ser atribuidas a limitaciones de hábitat y comportamiento en la conformación de grupos y ocupación territorial (Braza et al. 1981; Fajardo-Patiño & De La Ossa, 1994; De La Ossa & Fajardo, 1996; Chapman & Balcomb, 1998; Gómez-Posada et al. 2007; Arroyo-Rodríguez & Mandujano, 2009; Arroyo- Rodríguez & Dias, 2010).
Las variaciones en los datos de densidad para A. seniculus son amplias y pueden ser de 34-55 ind/km2, llegando a 150 ind/km2(Chapman & Balcomb, 1998), lo que se podría relacionar con la capacidad de adaptación de la especie a los cambios de hábitat, lo que contrasta negativamente al observar que, tanto para C. c. capucinus la densidad registrada es significativamente muy baja, de acuerdo con los datos disponibles para el área, como para S. oedipus (Fajardo-Patiño & De La Ossa, 1994).
Se debe tener en cuenta que la densidad es una variable dependiente de la disponibilidad y de la distribución de recursos, como alimento, agua y lugares seguros para el descanso (Stevenson & Quiñones, 1993), por lo tanto, es un indicador de calidad de hábitat. En este caso, la densidad de A. seniculus se mantiene comparativamente en su nivel mínimo, mientras que para las otras dos especies simpátricas de primates se reduce ostensiblemente, lo que indica que la constante fragmentación de hábitat está afectando seriamente las poblaciones de primates existentes en el área de estudio, lo cual, es concordante con lo indicado por Arroyo-Rodríguez & Dias (2010).
En general, el uso del estrato superior para A. s. seniculus está documentado (Urbani, 2003). El uso de todos los estratos con preferencial utilización del dosel arbóreo es notorio para la especie (Izawa, 1993). Concordando con Urbani (2003), la ausencia de potenciales depredadores aéreos, por ejemplo, águilas harpías (Harpia harpyja) y la posible presencia de potenciales depredadores terrestres, como la boa común (Boa constrictor), jaguarundi (Herpailurus yaguarondi), tigrillo (Leopardus wiedii), ocelotes (Leopardus pardalis) y tayras (Eira barbara) podría influenciar el uso preferencial del estrato superior del bosque, en los monos aulladores.
Los trabajos de Cuarón (1997) indican que han observado ataques a aulladores por parte de B. constrictor, Panthera onca y L. pardalis. Otra explicación podría estar dada por la carencia de potenciales primates competidores, en este nivel del bosque que, en otras localidades, normalmente utilizan la parte superior del dosel, tales como los monos araña (Ateles geoffrogyi) (Urbani, 2003), que no se registra en el área de estudio, desde hace varias décadas.
El uso de los distintos estratos del bosque por C. capucinus está relacionado con comportamientos de forrajeo, ya que desde el piso hasta la parte alta de la canopia buscan sus presas (Rose et al. 2003). Por su parte, S. oedipus observado en todos los estratos, preferencialmente, se mueve en el nivel medio del arbolado, que ofrece mayor protección, en comparación con el piso y el dosel superior del bosque.
La distancia inter-específica mantenida entre A. seniculus y S. oedipus es cerrada; pueden cercanamente compartir lugares de alimentación y de reposo, incluso vías de desplazamiento, sin que entre ellos existan despliegues o comportamientos agonísticos o de separación; la interferencia entre las dos especies es nula, concordando con Cuervo et al. (1986) y Barbosa (1988).
En cuanto a A. seniculus con C. capucinus existen registros de interacciones nulas y de interacciones agonísticas, lo que se atribuye a la disponibilidad de recursos alimenticios, espacio y flexibilidad de la dieta (Rose et al. 2003); no obstante, C. capucinus puede mantener relaciones inter- específicas e inter-específicas neutrales con otras especies de vertebrados (Rose et al. 2003).
El forrajeo en grupo de C. capucinus, se puede dar sin que haya interacciones entre los miembros del grupo o de distintos grupos; se dispersan y utilizan árboles fructificados diferentes, consumiendo en todos los estratos o secuencialmente, con clara adaptación a los ciclos de producción del bosque y siempre en grupo; muestran una estrategia flexible de forrajeo que cambia temporalmente la estructura del grupo en respuesta al tamaño del parche de alimentación; esta estrategia de forrajeo reduce las oportunidades de competencia intra-específica (Phillips,1995). Usan la misma estrategia de forrajeo inter- e intra-específicamente, evitan la proximidad cercana mientras se alimentan, pero pueden comer simultáneamente en el mismo lugar con otros miembros de su tropa o con otras especies, si el espacio interindividual está disponible, entre 50 y 100m, para la misma especie (Phillips, 1995).
En cuanto a C. capucinus y S. oedipus es claro que ésta última especie evita la cercanía de C. capucinus, porque podría ser un eventual depredador, dada su mayor talla, mayor tamaño del grupo, hábito de cacería y consumo de carne. Existe evidencia de depredación hacia primates de menor talla (De Luna et al. 2010).
Conflicto de intereses: El manuscrito fue preparado y revisado con la participación de todos los autores, quienes declaramos que no existe ningún conflicto de intereses que ponga en riesgo la validez de los resultados presentados. Financiación: Este estudio fue financiado con aportes del Grupo de Investigación en Biodiversidad Tropical de la Universidad de Sucre, Colombia.
BIBLIOGRAFÍA
1. ARROYO-RODRÍGUEZ, V.; DIAS, P.A.D. 2010. Effects of habitat fragmentation and disturbance on howler monkeys: a review. Am. J. Primatol. 72:1-16.
2. ARROYO-RODRÍGUEZ, V.; MANDUJANO, S. 2009. Conceptualization and Measurement of Habitat Fragmentation from the Primates' Perspective. Int. J. Primatol. 30:497-514.
3. BARBOSA, C. 1988. Observaciones sobre el comportamiento de una manada del "Mono Colorado" Alouatta seniculus (Linnaeus, 1766) (Mammalia: Primates) en el Arroyo Coloso, Sucre, Colombia. Trianea. 1:123-129.
4. BRAZA, F.; ÁLVAREZ, F.; AZCARATE, T. 1981. Behavior of the red howler monkey (Alouatta seniculus) in the Llanos of Venezuela. Primates. 22(4):459-473.
5. BUCKLEY, S. 1983. The feeding behavior, social behavior, and ecology of the white-faced monkey, Cebus capucinus, at Trujillo, Northern Honduras Central America. Ann Arbor, University Microfilms International. 222p.
6. CHAPMAN, C.; BALCOMB, S. 1998. Population characteristics of howlers: Ecological conditions or group history. Int. J. Primatol. 19:385-403.
7. CUARÓN, D. 1997. Conspecific aggression and predation, cost for a solitary mantled howler monkey. Folia Primatol. 68:100-105.
8. CUERVO, A.; BARBOSA, C.; DE LA OSSA, J. 1986. Aspectos ecológicos y etológicos de primates con énfasis en Alouatta seniculus (Cebidae), de la región de Coloso, Serranía de San Jacinto (Sucre), costa norte de Colombia. Caldasia. 14:68-70.
9. DE LA OSSA, V.J.; FAJARDO, P.A. 1996. Densidad del mono aullador Alouatta seniculus (Linnaeus, 1766) Mammalia: Primates en el arroyo Colosó, Departamento de Sucre, Colombia. Acta Biol. Col. (3):43-52.
10. DE LUNA, G.; SANMIGUEL, R.; DI FIORE, A.; FERNANDEZ-DUQUE, E. 2010. Predation and predation attempts on red titi monkeys (Callicebus discolor) and equatorial sakis (Pithecia aequatorialis) in Amazonian Ecuador. Folia Primatol. 81:86-95.
11. EISENBERG, F. 1989. Mammals of the Neotropics- the northern neotropics. Vol1. Panamá, Colombia, Vene- zuela, Guyana, Suriname, French Guiana. The Univer- sity of Chicago Press. Chicago anal London. 449 p.
12. FAJARDO-PATIÑO, A.; DE LA OSSA, J. 1994. Censo preliminar de primates en la Reserva Forestal Protectora Serranía de Coraza - Montes de María. Trianea. 5:289-303.
13. FEDIGAN, M.; JACK, K. 2001. Neotropical Primates in a regenerating Costa Rican dry forest: a comparison of howler and capuchin population patterns. Int. J. Primatol. 22(5):689-713.
14. FLEAGE, J. 1999. Primate adaptation and evolution. San Diego, Academic Press. 596p.
15. GÓMEZ-POSADA, C.; MARTÍNEZ, J.; GIRALDO, P.; KATTAN, G.H. 2007. Density, habitat use, and ranging patterns of red howler monkeys in a Colombian Andean forest. Neotrop. Primates. 14(1):2-10.
16. HEYMANN, W.; ENCARNACIÓN, F.; CANAQUIN, J. 2002. Primates of the Rio Curaray, northern peruvian Amazon. Int. J. Primatol. 23(1):191-201.
17. HEYMANN, E.W.; KNOGGE, C.; TIRADO HERRERA, E.R.. 2000. Vertebrate predation by sympatric tamarins, Saguinus mystax and Saguinus fuscicollis. Am. J. Primat. 51:153-158.
18. IZAWA, K. 1993. Soil-eating by Alouatta and Ateles. Int. J. Primat. 14(2):229-242.
19. KIMURA, K. 1992. Demographic approach to the social group of wild red howlermMonkeys (Alouatta seniculus). Field studies of New World Monkeys, La Macarena, Colombia. 7:29-34.
20. MARSDEN, J. 1999. Estimation of parrot and hornbill densities using a point count distance sampling method. Ibis. 141:377-390.
21. MORALES-JIMÉNEZ, L. 2002. Densidad de los monos aulladores (Alouatta seniculus) en un bosque subandino, Risaralda, Colombia. Neotrop. Primates. 10(3):141-144.
22. NAPIER, R.; NAPIER, H. 1967. A handbook of living primates. Academic Press, London. 456p.
23. NEYMAN, F. 1977. Aspects of the ecology and social organization of free-ranging cotton-top tamarins (Saguinus oedipus) and the conservation status of the species. En: Kleiman, D.G. (ed): The Biology and Conservation of the Callitrichidae. Washington, DC: Smithsonian Institution Press. p.39-71.
24. OCHOA, D.F.; MARTÍNEZ, E.; DE LA OSSA, J. 2011. Densidad poblacional y estructura de grupo de Alouatta seniculus(Primates, Atelidae) en Colosó, Sucre, Colombia. Rev. U.D.C.A Act. & Div. Cient. 14(2):101-108.
25. PERES, A. 1997. Effects of habitat quality and hunting pressure on arboreal folivore densities in Neotropical forests: a case study of howler monkeys (Alouatta spp.). Folia Primatol. 68:199-222.
26. PHILLIPS, A. 1995. Resource patch size and flexible foraging in white-faced capuchins (Cebus capucinus). Int. J. Primatol. 16(3):509-519.
27. POZO, W. 2009. Uso preferencial de hábitat en primates atélidos en el Parque Nacional Yasuní, Ecuador. Boletín Técnico 8, Serie Zoológica. 4-5:25-34.
28. QUEIROZ, L. 1991. Levantamento das Populações de Três Espécies de Primatas na Fazenda Sucupira, Brasília, DF. p.369-374.
29. ROSE, M.; PERRY, S.; PANGER, A.; JACK, K.; MANSON, H.; GROS-LOUIS, J. 2003. Interspecific interactions between Cebus capucinus and other species: Data from three Costa Rican sites. Int. J. Primatol. 24(4):759-796.
30. SAVAGE, A.; THOMAS, L.; LEIGHTY, A.; SOTO, H.; MEDINA, F. 2010. Novel survey method finds dramatic decline of wild cotton-top tamarin population. Nature Communicat. 1(7):1-30.
31. SCHAIK, C. 1992. Estimating Population Densities of Summation Rain Forest Animals: A Brief Guide. WCI project. 87p.
32. SIEMERS, M. 2000. Seasonal variation in food resource and forest strata use by brown capuchin monkeys (Cebus apella) in a disturbed forest fragment. Folia Primatol. 71:181-184.
33. SIMMEN, B. 1992. Competitive utilization of Bagassa fruits by sympatric Howler and Spider monkeys. Folia Primatol. 58:155-160.
34. SOLER, M.; CARRANZA, J.; CORDERO-RIVERA, A.; MORENO, J.; SENAR, C.; SOLER, J. 2001. Traducción al español de los términos ingleses más conflictivos utilizados en Etología, Ecología y Evolución. Etología. 9:43-46.
35. STEVENSON, P. 1991. Relación entre la abundancia de frutos y las estrategias alimenticias de 4 especies de primates, en la Macarena Colombia. Informe final, Fundación para la Promoción de la Investigación y la Tecnología, Banco de la República, Bogotá. 209p.
36. STEVENSON, P.; QUIÑONES, M. 1993. Vertical stratification of four new world primates at Tinigua National Park, Colombia. Field Studies of New World Monkeys, La Macarena, Colombia. 8:11-18.
37. STEVENSON, R.; QUIÑONES, M.; AHUMADA, J. 2000. Influence of fruit availability on ecological overlap among four neotropical primates at Tinigua National Park, Colombia. Biotropica. 32 (3):533-544.
38. STONER, E.; RIBA-HERNANDEZ, P.; VULINEC, K.; LAMBERT, E. 2007. The role of mammals in creating and modifying seed shadows in tropical forests and some possible consequences of their elimination. Biotropica. 39:316-327.
39. URBANI, B. 2003. Utilización del estrato vertical por el mono aullador de manto (Alouatta palliata, Primates) en Isla Colón, Panamá. Antropo. 4:29-33.
40. VILELA, L. 2007. Simpatria e dieta de Callithrix penicillata (Hershkovitz) (Callitrichidae) e Cebus libidinosus (Spix) (Cebidae) em matas de galeria do Distrito Federal, Brasil. Rev. Bras. Zool. 24(3):601-607.
41. WALLACE, B.; PAINTER, L.; TABER, A. 1998. Primate diversity, habitat preferences, and population density estimates in Noel Kempff Mercado National Park, Santa Cruz Department, Bolivia. Am. J. Primatol. 46:197-211.
42. YOULATOS, D. 1998. Positional behavior of two sympatric Guianas capuchin monkeys, the brown capuchin (Cebus apella) and the wedge-capped capuchin (Cebus olivaceus). Mammalia. 62(3):351- 365.
43. ZAR, H. 1996. Bioestatistical analysis. 3ed. Prentice- Hall, Inc. Englewood Cliff, N.J. 663p.
Recibido: Agosto 16 de 2012 Aceptado: Marzo 20 de 2013

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.