CIENCIAS AGRARIAS-Artículo Científico
EVALUACIÓN DEL EFECTO AUXIN-LIKE DE ÁCIDOS HÚMICOS EN MAÍZ MEDIANTE ANÁLISIS DIGITAL DE IMÁGENES
EVALUATION OF AUXIN-LIKE EFFECT OF HUMIC ACIDS ON MAIZE THROUGH DIGITAL IMAGE ANALYSIS
Manuel Pantoja Guerra1, Yezid Almanza Pérez2, Nelson Valero Valero3.
1 Microbiólogo, cM.Sc. Ciencias - Biotecnología, Docente, Grupo de Investigación Microbiología Agrícola y Ambiental (MAGYA), Programa de Microbiología. Universidad Popular del Cesar, Valledupar - Cesar, Colombia, email manuelpantojag@unicesar.edu.co
2 Ingeniero Electrónico, cM.Sc. Enseñanza de las Ciencias, Docente, Grupo de Investigación DSP-ASIC Builder Group, Departamento de Ingeniería Electrónica, Facultad de Ingenierías. Universidad Popular del Cesar, Valledupar - Cesar, Colombia, emailyezidalmanza@unicesar.edu.co
3 Biólogo, M.Sc., Ph.D, Docente, Facultad de Ciencias. Universidad de La Guajira, Riohacha - La Guajira, Colombia, emailnvalerov@uniguajira.edu.co
Rev. U.D.C.A Act. & Div. Cient. 19(2): 361-369, Julio- Diciembre, 2016
RESUMEN
El efecto auxin-like consiste en la promoción del crecimiento vegetal por ácidos húmicos (AH). En este trabajo, se evaluó el efecto auxin-like de ácidos húmicos, mediante la determinación del área foliar y la superficie radicular de plántulas de maíz. Los AH fueron obtenidos por solubilización alcalina de carbón, denominados AH-NaOH y mediante solubilización bacteriana de carbón, designados AH-BSC3 y AH-BSC25. Se probó la aplicación de AH, mediante inmersión de semillas en soluciones de 20, 80 y 150mgAH/L y por aspersión foliar sobre plántulas de dos semanas. El ensayo, se desarrolló bajo condiciones de casa de malla y constó de cinco repeticiones por tratamiento; 30 días después de la siembra en suelo, se determinó el área foliar, utilizando el software ImageJ y la superficie total de raíces, mediante un algoritmo desarrollado en Matlab. Se registraron incrementos significativos en el área foliar de plantas tratadas mediante la inmersión de semillas, en soluciones de AH-BSC-3-80mg/L y 150mg/L, AH-BSC-25-20mg/L y 150mg/L, y AH-NaOH-80mg/L y plantas tratadas mediante aspersión foliar de AH-BSC-3-150mg/L, AH-BSC-25-150mg/L y AH-NaOH-150mg/L. También, se evidenciaron incrementos significativos en la superficie total de raíces de plántulas tratadas con AH-BSC25-150mg/L, AH-NaOH-80mg/L y AH-BSC3-80mg/L y todos los tratamientos de AH por aspersión. Se presentó el efecto auxin-like de AH sobre el desarrollo radicular y foliar de plántulas de maíz, a través del análisis digital de imágenes; esta herramienta puede producir información precisa para medir algunos parámetros del proceso vegetal.
Palabras clave: Procesamiento digital, sustancias húmicas, Matlab, ImageJ.
SUMMARY
The auxin-like effect consists in plant growth promotion by humic acids (HA). In this research the auxin-like effect was determined by digital image processing, both foliar and root surface of corn plants were assessed. The HA were obtained through alcaline solubilization coal, HA-NaOH and through coal bacterial solubilization, HA-CSB3 and HA-CSB25. The application of the HA solutions of 20, 80 and 150mgHA/L was evaluated through seed immersion and foliar spray on two week-old plants. The experiment was carried out under shade cloth with five replicates by treatments; 30 days after planting in soil, leaf area was measured using ImageJ software and total root surface through an algorithm of Matlab. Significant increase in leaf area of plants treated by immersion of seeds in HA-BSC3-80mg/L and 150mg/L, AH-CSB25-20mg/L and 150mg/L, and HA-NaOH-80mg/L was found, as well as in plants treated by foliar aspersion of HA-CSB3-150mg/L, AH-CSB 25-150mg/L and HA-NaOH-150mg/L. Moreover significant increase in total root surface of plants treated with HA-CSB25-150mg/L, HA-NaOH-80mg/L and HA-CSB3-80mg/L and all treatments of HA by aspersion was found. The auxin-like effect of humic acids on maize plants was evidenced through digital image analysis; this tool can produce accurate information to measure some plant development parameters.
Key words: Digital processing, humic substances, Matlab, ImageJ.
INTRODUCCIÓN
El análisis de imágenes constituye una herramienta útil en el estudio de algunas variables biométricas, en áreas como la medicina, las ciencias biológicas y la agricultura (Abramoff et al 2004). En la investigación con plantas, las mediciones de área foliar y radicular también pueden ser desarrolladas mediante análisis de imágenes; estas variables resultan de mucho interés en el campo de la fisiología vegetal, debido a que son sensibles a cambios biológicos y ecofisiológicos del desarrollo vegetal, tales como el contenido hormonal, distribución de la radiación solar y del agua, nutrición mineral, eficiencia fotosintética, calidad del suelo, entre otros (Galindo & Clavijo, 2007; Cabezas-Gutiérrez et al 2009; Rincón et al 2012).
La medición de las áreas radicular y foliar tienen particular importancia en trabajos relacionados con la microbiología agrícola, en los que se evalúa el efecto de diferentes sustancias y microorganismos sobre el desarrollo vegetal, sustancias, como las sales minerales y las fracciones de la materia orgánica humificada, dentro de la que sobresalen los ácidos húmicos (AH); para monitorear efectos deletéreos de microorganismos patógenos en plantas, de acuerdo con Herre et al. (2007), hongos endófitos, conforme al reporte de Arnold (2007), microorganismos, tales como bacterias promotoras de crecimiento vegetal, conforme el estudio de Gholami et al. (2009) y micorrizas, según Porras et al. (2009) y Wang et al. (2011)
Los ácidos húmicos son una fracción de las sustancias húmicas, conformados por núcleos aromáticos y poliaromáticos, unidos a través de cadenas alifáticas. Estos poseen una diversidad de grupos funcionales, que les permiten ejercer varias funciones en la relación suelo - planta (Peña et al. 2005; Canellas et al. 2010). Asociado al complejo supramolecular de los AH, se ha detectado la presencia de moléculas similares al ácido indol acético (AIA) (Canellas et al. 2002), una hormona inductora del crecimiento vegetal; debido a esta similaridad entre AH y AIA, se ha demostrado la bioactividad y la capacidad de promoción de crecimiento vegetal de los AH, efecto denominado auxin-like (Canellas & Olivares, 2014).
El efecto auxin-like consiste en el incremento de la actividad de la enzima H+-ATPasa de la membrana plasmática, que acidifica el apoplasto (Canellas et al. 2002) y genera un aumento de concentración de las giberelinas, que favorece la actividad de enzimas, que debilitan la pared celular y permiten el alargamiento de la célula (Bohórquez et al. 2011). Estos cambios, se reflejan en el crecimiento y en la proliferación de raíces y un consecuente incremento del área radicular y foliar (Canellas & Olivares, 2014). Los AH, se obtienen a partir del suelo, residuos de materia orgánica compostados o carbones de bajo rango, mediante extracción con compuestos alcalinos; sin embargo, recientemente se ha descrito la obtención de AH, mediante la solubilización bacteriana de carbones de bajo rango (Valero et al. 2014), por lo tanto, existe el interés de comparar la diferencia entre los efectos y la bioactividad que, tanto los AH obtenidos por extracción alcalina como los obtenidos por solubilización bacteriana de carbón de bajo rango, ejercen sobre el crecimiento vegetal.
Los métodos tradicionalmente usados para medir el crecimiento de raíces y follaje en ensayos de crecimiento vegetal son la determinación de biomasa, número y longitud de raíces y área foliar por planimetría; sin embargo, en muchos estudios resulta de especial interés la determinación de la superficie total de las raíces, puesto que es un parámetro que está directamente relacionado con el área efectiva de contacto con el suelo, para la absorción de agua, nutrientes e interacciones con los microorganismos; por lo tanto, es más conveniente utilizar un método que evalúe el desarrollo radicular en función de la superficie.
Bajo el anterior contexto, este trabajo buscó evaluar el efecto auxin-like de ácidos húmicos obtenidos mediante extracción alcalina y solubilización bacteriana de carbón sobre el desarrollo de plántulas de maíz, a través del análisis y procesamiento de imágenes, con el fin de obtener un criterio más adecuado en la evaluación.
MATERIALES Y MÉTODOS
Este trabajo, se desarrolló en el laboratorio de Microbiología Agrícola y Ambiental de la Universidad Popular del Cesar y los ensayos de vivero, en la casa de malla del Centro Biotecnológico del Caribe - SENA, en Valledupar (norte de Colombia).
Semillas. Se utilizaron 115 semillas de maíz, variedad ICA V-109, las cuales, fueron previamente lavadas con agua destilada estéril, desinfectadas en una solución de hipoclorito de sodio al 1% por dos minutos y posteriormente enjuagadas en agua destilada estéril, siguiendo las recomendaciones de Cubillos et al (2011).
Obtención de ácidos húmicos (AH). Se obtuvieron AH, tanto por el método clásico como por el de solubilización bacteriana del carbón. Por el método clásico, se utilizó lignito triturado y tamizado hasta llevarlo a un tamaño de partícula de 300µm y se aplicó el protocolo de extracción alcalina, descrito por Sharif et al. (2002). Se trabajó a una relación 1:10 p/v de lignito y NaOH 0,5N, se incubó a 100°C por diez horas; después de este tiempo, se dejó reposar durante 24 horas y se eliminaron por filtración los residuos no solubles de carbón; de esta forma, se obtuvo el extracto húmico total (EHT). Para obtener AH, se llevó el EHT hasta pH 2, mediante la adición de HCl 1N; a este valor de pH, se separan dos fases: los AH que son insolubles, se precipitan y los ácidos fúlvicos (AF) solubles, quedan en el sobrenadante; la fracción de AF, se descartó y los AH fueron lavados y secados por liofilización. Para obtener AH por solubilización bacteriana del carbón, se utilizaron las cepas bacterianas Bacillus mycoides BSC25 y Microbacterium sp. BSC3, siguiendo el protocolo descrito por Valero et al (2014).
Ensayo de bioactividad de AH sobre el desarrollo foliar y radicular de plántulas de Z mays. Se ejecutaron dos ensayos bajo condiciones de casa de malla, probando dos formas de aplicación de los AH. En el primer ensayo, se probó el efecto de los AH, aplicados mediante la inmersión de las semillas de maíz pregerminadas, en soluciones con diferentes concentraciones de AH, obtenidos mediante extracción alcalina y AH obtenidos por solubilización bacteriana de lignito. En el segundo ensayo, se evaluó el efecto de los dos tipos de AH, pero aplicados mediante aspersión foliar sobre plántulas de maíz, después de dos semanas de haber germinado. Cada ensayo, se realizó bajo un diseño completamente al azar, con cinco repeticiones por tratamiento y una duración de 30 días, al cabo de los cuales, se llevó a cabo la medición de las variables.
Aplicación de AH mediante inmersión de semillas en soluciones. Se utilizaron soluciones de AH de 20, 80 y 150mg/L, obtenidas por el método clásico, que fueron denominadas AH-NaOH y por solubilización bacteriana de lignito, llamadas AH-BSC3 y AH-BSC25 y soluciones de la auxina ácido 3-indol acético (AIA) a concentraciones de 2, 5 y 10mg/L. las soluciones de AIA, se utilizaron como un control positivo del efecto estimulador del crecimiento vegetal; como control absoluto, se utilizó agua destilada estéril. Las semillas de maíz pregerminadas fueron colocadas en imbibición por 3h, en cada una de las soluciones de AIA y AH; las semillas del tratamiento control fueron sumergidas en agua destilada estéril por el mismo tiempo; después, las semillas fueron sembradas en contenedores con 300g de suelo. De esta forma, el experimento constó de 13 tratamientos y cinco repeticiones, con una semilla por repetición. Después de 30 días, se tomaron las muestras del material vegetal de las 65 plántulas para la medición de variables.
Aplicación de AH mediante aspersión foliar. Se sembraron semillas pregerminadas de maíz en contenedores con 300g de suelo; se dejaron crecer las plántulas durante 15 días y se procedió a realizar la aplicación de 10mL de AH por planta, mediante aspersión foliar, utilizando un atomizador. Se asperjaron soluciones de AH-NaOH, AH-BSC3 y AH-BSC25 con concentraciones de 20, 80 y 150mg/L; el control absoluto fue asperjado con 10mL de agua destilada estéril. De esta forma, el ensayó constó de 10 tratamientos y cinco repeticiones; transcurridos 15 días después de la aplicación de AH, se tomaron muestras de material vegetal de las 50 plántulas, para la medición de variables.
Medición de variables Después de 30 días de crecimiento, las plantas fueron desenterradas cuidadosamente y la parte foliar fue separada de las raíces, con un bisturí. Para evitar que la marchitez generara cambios en la forma de las hojas, éstas fueron fotografiadas en un lapso máximo de 10 minutos, después de haber desenterrado las plantas. Las hojas de cada planta fueron dispuestas paralelamente, de tal forma que se obtuvo un dato de área foliar por planta. La fotografía fue tomada sobre un fondo blanco, en una habitación cerrada, iluminada con luz blanca, con una cámara digital Cannon PowerShot SD 1300 IS, configurada en modo instantáneo nocturno, sin flash, con una distancia focal de 35cm, fijada con soporte universal. Durante el proceso, se evitó el efecto de la sombra, ajustando la dirección de incidencia de la luz. Paralelo a las hojas fue dispuesta una escala, con una longitud conocida de 10cm, como referencia en la conversión de pixeles a cm2. En total, fueron analizadas 115 fotografías, para el análisis de área foliar.
El área foliar, se determinó mediante el procesamiento digital de imágenes, haciendo uso del software ImageJ (Abramoff et al. 2004; Rincón et al. 2012; Schneider et al. 2012). Primero, se seleccionó la imagen de los archivos obtenidos de la cámara, se fijó la escala de conversión de unidades y se convirtió la imagen a escala de grises; posteriormente, la imagen fue binarizada en dos fases, se seleccionó el área y se hizo la medición.
Por otra parte, las raíces fueron separadas cuidadosamente del suelo, evitando fragmentarlas; fueron sumergidas en agua, para facilitar la eliminación de las partículas de suelo; posteriormente, fueron mantenidas sobre papel absorbente en cámara de humedad, hasta ser procesadas. Para fotografiar las raíces fueron puestas sobre una superficie de color negro, lo que permitió obtener condiciones de contraste, que facilitaron la posterior binarización de la imagen y reducción del efecto de las sombras; se utilizaron las condiciones de cámara, luz y distancia focal, mencionadas anteriormente.
Para la determinación de la superficie total de raíces, se tomaron fotografías en formato JPG (Joint Photographic Experts Group). Las imágenes obtenidas fueron pretratadas en una computadora con procesador Athlon X2 y sistema operativo Windows 7, bajo el software Adobe Photoshop CS3 Extended®, para mejorar el brillo y el contraste. Posteriormente, el procesamiento de la imagen, para la determinación de la superficie de la raíz, se realizó por medio de un algoritmo desarrollado en Matlab®, que consistió en recortar la raíz de la imagen original, creando un marco desde una distancia inicial y final, magnificada sobre la regla, para reducir el error de la medida. Después, cada imagen fue convertida a escala de grises y se transformó a blanco y negro, bajo el mismo parámetro escalar; finalmente, se le aplicaron filtros para el procesamiento morfológico. De esta forma, se logró obtener la dimensión del área ocupada por la raíz, a partir del número de pixeles blancos por unidad de área. En este trabajo, se procesaron 115 imágenes de raíces de plántulas de maíz, tratadas con AH, por inmersión y por aspersión foliar.
Analisis estadístico. Se utilizó el paquete estadístico IBPM SPSS Statistic Versión 22. Para los datos de cada variable obtenidos por experimento, se realizó verificación de la normalidad, mediante la prueba de Shapiro-Wilk (P>0,05). Posteriormente, se hizo análisis de varianza a una vía, por medio de la comparación de promedios entre tratamientos, con la prueba de Diferencia Mínima Significativa (LSD).
RESULTADOS Y DISCUSIÓN
En todos los ensayos, se observó la tendencia a incrementar la superficie radicular y el área foliar, cuando las plántulas fueron tratadas con las concentraciones más altas de AH- BSC25, AH-BSC3 y AH-NaOH.
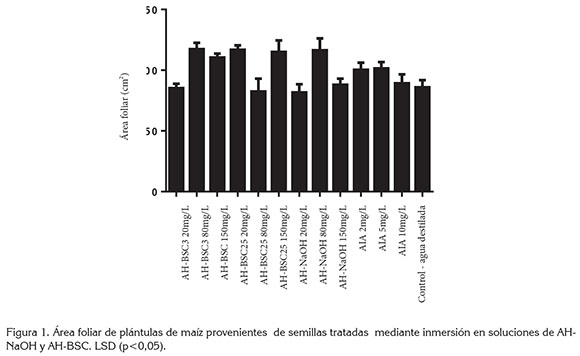
En la figura 1, se presenta el resultado de la medición de área foliar de plántulas de maíz, tratadas con los diferentes tipos de AH y AIA, mediante inmersión de semillas. Este resultado no muestra diferencias estadísticas significativas entre el tratamiento control y los tratamientos con AIA, mientras que los tratamientos con AH-BSC3 80mg/L y 150mg/L, AH-BSC25 20mg/L y 150mg/L, y AH-NaOH 80mg/L sí generaron incrementos significativos en el área foliar, con respecto al control y a los demás tratamientos.

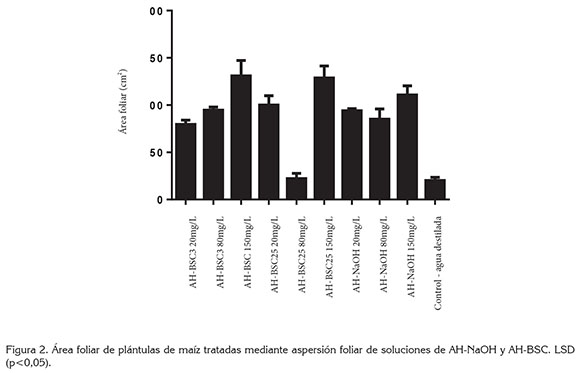
En la figura 2, se presenta el resultado de la medición de área foliar de las plantas tratadas mediante aspersión foliar, de los diferentes tipos de AH. El análisis de varianza mostró incrementos en el área foliar en todos los tratamientos, con diferencias significativas con respecto al control, exceptuando AH-BSC25 80mg/L; este resultado difiere de la tendencia del experimento, al presentar incrementos en el área foliar en respuesta a la aspersión foliar de AH. El mayor efecto fue ocasionado por los tratamientos AH-BSC3 150mg/L, AH- BSC25 150mg/L y AH-NaOH 150mg/L, los cuales, constituyen las concentraciones más altas y presentan áreas foliares de 130,9, 128,7 y 110,7cm2, respectivamente, mientras que el área foliar en el tratamiento control fue de 20,2cm2.
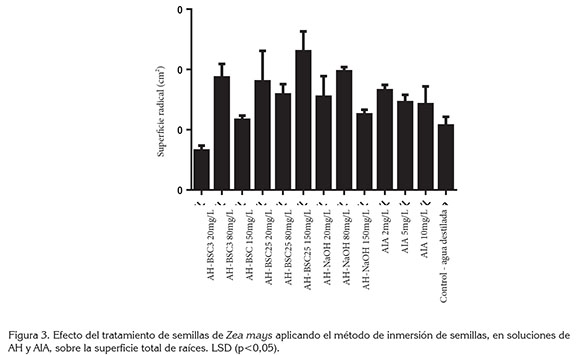
En el ensayo de bioactividad, mediante inmersión de semillas en soluciones de AH y AIA, se encontró que el uso de AIA en concentraciones de 2 y 5mg/L ocasiona incrementos significativos en la superficie total de raíces. Los tratamientos AH-BSC25 150mg/L, AH-NaOH 80mg/L y AH-BSC3 80mg/L también presentaron incrementos significativos con respecto al control (Figura 3). Estos resultados indican que el tratamiento con este tipo de AH induce en la raíz una respuesta morfométrica comparable a la que ocasiona la auxina AIA, que es la hormona natural que promueve el desarrollo de raíces (Canellas et al. 2014); los demás tratamientos no mostraron diferencias estadísticas significativas con respecto al control.
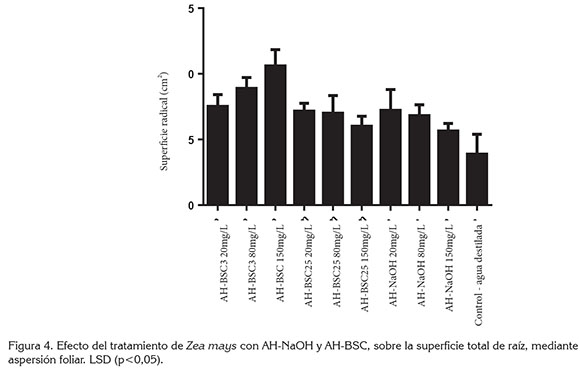
Los resultados del ensayo de aplicación de AH mediante aspersión foliar, muestran que todos los tratamientos con AH ocasionan incrementos significativos en la superficie total de raíces. Los tratamientos con AH-BSC3 150mg/L y 80mg/L causaron la respuesta más alta en la superficie radicular. El tratamiento con AH-NaOH incrementa significativamente la superficie radicular, cuando se aplica a concentraciones de 20 y 80mg/L (Figura 4).
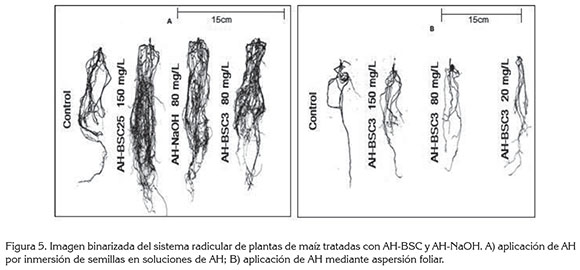
La figura 5A muestra la imagen binarizada utilizada en el análisis de imágenes, mediante Malab®, en la que se observa el incremento en la superficie radicular, debido a la proliferación de raíces, con los tratamientos AH-BSC25 150mg/L, AH-BSC3 80mg/L y AH-NaOH 80mg/L, que muestan una respuesta estadísticamente significativa superior al tratamiento control. En la figura 5B, se puede observar el incremento en la proliferación de raíces, con los tratamientos AH-BSC3 150mg/L, AH-BSC3 80mg/L y AH-NaOH 20mg/L.
El incremento en el área foliar y superficie total de la raíz, ocasionado por los tratamientos con los diferentes tipos de AH, contribuye a la hipótesis de una acción bioestimulante por parte de los AH, en el desarrollo vegetal. Según Barros et al (2010), los AH influyen en la proliferación de raíces secundarias, en la absorción de nutrientes por la raíz y constituyen un factor importante en el establecimiento y en la adaptación de las plantas en el suelo bajo condiciones adversas.
El contacto directo de los AH con las semillas de maíz, durante el ensayo por inmersión, con los tratamientos AH-BSC25 150mg/L, AH-NaOH 80mg/L y AH-BSC3 80mg/L ocasionó un incremento en la proliferación de raíces, mientras que los tratamientos con AH-BSC3 80mg/L y 150mg/L, AH-BSC25 150mg/L, y AH-NaOH 80mg/L incrementaron significativamente el área foliar. Probablemente, estos cambios se deben a un aumento en la actividad de la ATPasa-H+ en la membrana celular, lo cual, desencadena una serie de reacciones que finalizan en la división celular, lo que incrementa el número de puntos de mitosis activa y pelos radiculares, la tasa fotosintética y movilización de nutrientes hacia la planta (Canellas et al. 2002; Canellas et al. 2010; Canellas & Olivares, 2014), de esta forma, aumenta la superficie radicular y el área foliar.
Evidencias recientes demuestran que los AH, al entrar en contacto con las células radiculares, estimulan el desarrollo vegetal, a través del mecanismo conocido como crecimiento ácido de la raíz; el incremento de H+ bombeados al apoplasto por la ATPasa-H+ acidifican la pared celular, haciéndola más flexible, lo que facilita la elongación de las raíces y la aparición de puntos de mitosis activa, que se convierten en puntos de emergencia radicular(Canellas & Olivares, 2014; Canellas et al. 2015; Nardi et al. 2016); además, la acumulación de H+ en el apoplasto, inducida por la bioactividad de los AH, genera cambios en el potencial electroquímico de la membrana plasmática, lo que facilita el aumento en el flujo de elementos, a través de la membrana y se traduce en un incremento en la capacidad de absorción de nutrientes por parte de las plantas; estos efectos fisiológicos han sido demostrados en maíz y se relacionan directamente con el incremento en la superficie radicular (Canellas & Olivares, 2014; Canellas et al. 2015). Este comportamiento, se ha observado solo para algunas concentraciones específicas de AH, por lo tanto, es posible obtener un comportamiento inverso con dosis muy altas de AH y, ello, se debe a la naturaleza hormonal del efecto auxin-like (Canellas et al. 2014).
El incremento en la superficie radicular y el área foliar también se puede explicar por el aumento en la capacidad de absorción calcio por parte de las plantas, por efecto de la bioactividad de los AH; Ramos et al. (2015) reportaron que en presencia de algunas fracciones de las sustancias húmicas, se genera la sobre expresión de unas proteínas de membrana encargadas del transporte de Ca, lo cual, aumenta el flujo de este elemento hacia el citosol de las células vegetales, necesario para activar una proteína kinasa dependiente de calcio, responsable de reacciones de fosforilación, útiles en el metabolismo primario y secundario de las plantas.
De igual forma, se presentaron cambios en el desarrollo foliar y radicular de las plántulas de maíz asperjadas con AH en la superficie de sus hojas; las plántulas tratadas con AH-BSC3 150mg/L y 80mg/L mostraron incrementos en la superficie radicular, mientras que las tratadas con AH-BSC3 150mg/L, AH-BSC25 150mg/L y AH-NaOH 150mg/L manifestaron el valor más alto de área foliar. Sani (2014) obtuvo incrementos en la altura y biomasa vegetal en plantas de canola, por la aspersión foliar de AH, obteniendo el valor más alto con la aplicación de una solución de AH de 2%. Canellas & Olivares (2014) describen cambios en el metabolismo primario en hojas de plantas de maíz tratadas con AH, tales como la reducción del contenido de carbohidratos (almidón, glucosa y fructosa), así como el incremento en la actividad de enzimas tipo amilasa, lo cual, está directamente relacionado con el incremento de la tasa fotosintética; de esta forma, el contacto de hojas de plántulas de maíz con AH desencadena reacciones, que conducen al incremento del desarrollo vegetal.
Los resultados demuestran que los AH obtenidos por extracción alcalina y por solubilización bacteriana de lignito ejercen un efecto estimulador del desarrollo radicular y foliar de plántulas de maíz; además, este efecto puede ser determinado, a través de la detección de cambios morfometricos de la plantas, mediante métodos de procesamiento digital de imágenes.
Rincón et al. (2012) demostraron que el software ImageJ es una herramienta adecuada y económica para la cuantificación del área foliar; este método fue validado en cinco especies vegetales, comparando los resultados obtenidos con un equipo especializado y obtuvieron índices de error inferiores a 2%. Respecto al análisis de raíces, Van der Weele et al (2003) determinaron cambios en la morfogénesis radicular de plántulas de Arabidopsis thaliana, Lycopersicon lycopersicum, Lactuca sativa, Aurinia saxatilis y Phleum pratense, mediante el procesamiento digital de imágenes y el desarrollo de un algoritmo acoplado a un software previamente diseñado para el estudio de raíces, detectando cambios en la elongación, diferencias en la zona apical y basal de la raíz y velocidad de crecimiento; por su parte, Lobet et al (2011), utilizaron un software semiautomatizado de análisis de imágenes para cuantificar cambios en el desarrollo y arquitectura de las raíces de plántulas de Lupinus albus y Zea mays, mediante un mecanismo de representación vectorial de la raíz y un algoritmo para acoplar el tamaño y la calidad de la imagen al software. Ambos antecedentes describieron la utilidad del procesamiento digital de imágenes en el estudio de raíces y destacaron su potencial como herramienta útil en investigación en fisiología vegetal y agricultura.
El procesamiento digital de imágenes resultó una herramienta adecuada y sensible para evaluar los cambios inducidos por efecto de los AH, a nivel foliar y radicular, superando algunos inconvenientes de los métodos tradicionales, resultando en una herramienta económica y práctica.
Agradecimientos. Los autores expresan su agradecimiento a la Universidad Popular del Cesar, por la financiación del proyecto 104-2013 y a COLCIENCIAS, por financiar la beca jóvenes investigadores e innovadores, mediante la convocatoria 566 de 2012. Conflictos de interés: El manuscrito fue preparado y revisado con la participación de todos los autores, quienes declaramos que no existe conflicto de intereses que ponga en riesgo la validez de los resultados presentados.
BIBLIOGRAFÍA
1. ABRAMOFF, M.D.; MAGALHÃES, P.P.; RAM, S.J. 2004. Image processing with ImageJ. Biophotonics International. (United States). 11(7):36-43.
2. ARNOLD, A.E. 2007. Understanding the diversity of foliar endophytic fungi: progress, challenges, and frontiers. Fungal Biology Reviews. (United Kingdom).21(2):51-66.
3. BARROS, L.; CANELLAS, L.; LOPES, F.; OLIVEIRA, N. 2010. Bioactivity of chemically transformed humic matter from vermicompost on plant root growth. J. Agric. Food Chem. (United States). 58(6):3681-3688.
4. BOHÓRQUEZ, C.; ÁLVAREZ-HERRERA, J.G.; NIÑO, R.C. 2011. Giberelinas y 6-Bencialminopurina en la plantulación de semillas de tomate (Solanum lycopersicum L.) Híbrido Adrale RZ F1. Temas Agrarios. (Colombia). 16(2): 42-53.
5. CABEZAS-GUTIÉRREZ, M.; PEÑA, F.; DUARTE, H.W.; COLORADO, J.F.; SILVA, R. 2009. Un modelo para la estimación del área foliar en tres especies forestales de forma no destructiva. Rev. U.D.C.A Act. & Div. Cient. (Colombia). 12(1):121-130.
6. CANELLAS, L.P.; OLIVARES, F.L.; OKOROKOVA- FAÇANHA, A.L.; FAÇANHA, A.R. 2002. Humic acids isolated from earthworm compost enhance root elongation, lateral root emergence, and plasma membrane H+-ATPase activity in maize roots. Plant Physiology. (United States). 130(4):1951-1957.
7. CANELLAS, L.P.; PICCOLO, A.; DOBBSS, L.B.; SPACCINI, R.; OLIVARES F.L.; ZANDONADI, D.B.; FAÇANHA, A.R. 2010. Chemical composition and bioactivity properties of size-fractions separated from a vermicompost humic acid. Chemosphere. (United Kingdom). 78(4):457-466.
8. CANELLAS, L.P.; OLIVARES, F.L. 2014. Physiological responses to humic substances as plant growth promoter. Chem. Biol. Techno. Agricult. (Itlay). 1(1):1-11.
9. CANELLAS, L.P.; OLIVARES, F.L.; AGUIAR, N.O.; JONES, D.L.; NEBBIOSO, A.; MAZZEI, P.; PICCOLO, A. 2015. Humic and fulvic acids as biostimulants in horticulture. Scientia Horticulturae. 196:15-27.
10. CUBILLOS, J.G.; MILIAN, P.E.; HERNÁNDEZ, J.L. 2011. Biological nitrogen fixation by Rhizobium sp. native gliricidia (Gliricidia sepium [ Jacq.] Kunth ex Walp.) under greenhouse conditions. Agr. Col. 29(3):465-472.
11. GALINDO, J.; CLAVIJO, J. 2007. Modelos alométricos para estimar el área de los foliolos de arveja (Pisum sativum L.). Ciencia y Tecnología Agropec. (Colombia). 8(1):37-43.
12. GHOLAMI, A.; SHAHSAVANI, S.; NEZARAT, S. 2009. The effect of plant growth promoting rhizobacteria(PGPR) on germination, seedling growth and yield of maize. Int. J. Biol. Life Sci. (Australia). 1(1):35-40.
13. HERRE, E.A.; MEJÍA, L.C.; KYLLO, D.A.; ROJAS, E.; MAYNARD, Z.; BUTLER. A.; VAN BAEL, S.A. 2007. Ecological implications of anti-pathogen effects of tropical fungal endophytes and mycorrhizae. Ecology. (United States). 88(3):550-558.
14. LOBET, G.; PAGÈS, L.; DRAYE. X.A. 2011. Novel imageanalysis toolbox enabling quantitative analysis of root system architecture. J. Plant Physiology. 157(1):29-39.
15. NARDI, S.; PIZZEGHELLO, D.; SCHIAVON, M.; ERTANI, A. 2016. Plant biostimulants: physiological responses induced by protein hydrolyzed-based products and humic substances in plant metabolism. Scientia Agricola. 73(1):18-23.
16. PEÑA, E.M.; HAVEL, J.; PATOČKA, J. 2005. Humic substances-compounds of still unknown structure: applications in agriculture, industry, environment, and biomedicine. J. Appl. Biomed. (Czech Republic).3(1):13-24.
17. PORRAS, A.; SORIANO, M. L.; PORRAS, A.; AZCÓN, R. 2009. Arbuscular mycorrhizal fungi increased growth, nutrient uptake and tolerance to salinity in olive trees under nursery conditions. J. Plant Physiology. (Germany). 166(13):1350-1359.
18. RAMOS, A.C.; DOBBSS, L.B.; SANTOS, L.A.; FERNANDES, M.S.; OLIVARES, F.L.; AGUIAR, N.O.; CANELLAS, L.P. 2015. Humic matter elicits proton and calcium fluxes and signaling dependent on Ca2+-dependent protein kinase (CDPK) at early stages of lateral plant root development. Chem. Biological Technol. Agriculture. 2:3.
19. RINCÓN, N.; QUINTERO, A.; PÉREZ, J. 2012. Determinación del área foliar en fotografías tomadas con una cámara web, un teléfono celular o una cámara semiprofesional. Rev. Fac. Nal. Agr. (Colombia).65(1):6399-6405.
20. SANI, B. 2014. Foliar application of humic acid on plant height in canola. APCBEE Procedia. (China). 8:82-86.
21. SCHNEIDER, C.A.; RASBAND, W.S.; ELICEIRI, K.W. 2012. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. (United Kingdom). 9(7):671-675.
22. SHARIF, M.; KHATTAK, R.A.; SARIR, M.S. 2002. Effect of different levels of lignitic coal derived humic acid on growth of maize plant. Communications Soil Sci. Plant Analysis. (United States). 33(19-20):3567-3580.
23. VALERO, N.; GÓMEZ, L.; PANTOJA, M.; RAMIREZ, R. 2014. Production of humic substances through coal-solubilizing bacteria. Brazilian J. Microbiol. 45(3):911-918.
24. VAN DER WEELE, C.M.; JIANG, H.S.; PALANIAPPAN, K.K.; IVANOV V.B.; PALANIAPPAN, K.; BASKIN, T.I. 2003. A new algorithm for computational image analysis of deformable motion at high spatial and temporal resolution applied to root growth. Roughly uniform elongation in the meristem and also, after an abrupt acceleration, in the elongation zone. Plant Physiol. 132(3):1138-1148.
25. WANG, X.; PAN, Q.; CHEN, F.; YAN, X.; LIAO, H. 2011. Effects of co-inoculation with arbuscular mycorrhizal fungi and rhizobia on soybean growth as related to root architecture and availability of N and P. Mycorrhiza. (Germany). 21(3):173-181.
Recibido: Marzo 9 de 2016 Aceptado: Septiembre 26 de 2016

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.