CIENCIAS AGROPECUARIAS-Artículo Científico
EFICIENCIA DE DOS MÉTODOS PARA EVALUAR LA VIABILIDAD DEL POLEN DE BERENJENA (Solanum melongena L. cv. Lila criolla)
EFFICIENCY OF TWO METHODS FOR EGGPLANT (Solanum melongena L. cv. Lila criolla) POLLEN VIABILITY EVALUATION
Hermes Araméndiz-Tatis1, Carlos Cardona- Ayala2, Alfredo Jarma-Orozco3
1 I.A. Ph.D., Facultad de Ciencias Agrícolas, Universidad de Córdoba, Montería. Colombia, haramendiz@hotmail.com
2 I.A. M.Sc. Facultad de Ciencias Agrícolas, Universidad de Córdoba, ccardonaayala@yahoo.com
3 I.A. Ph.D. Facultad de Ciencias Agrícolas, Universidad de Córdoba, Ciudad Universitaria Carrera 6 No. 76-103. Código Postal: 354. Montería - Colombia, ajarma24@yahoo.com
Rev. U.D.C.A Act. & Div. Cient. 16(2): 351-358, Julio-Diciembre, 2013
RESUMEN
La viabilidad del polen influye en la producción y en la calidad de frutos de las especies cultivadas. Su estudio es necesario en los programas de mejoramiento, especialmente, cuando se pretende producir cultivares híbridos. La investigación, se realizó en Montería, Departamento de Córdoba, Colombia, con el propósito de comparar la eficiencia de dos métodos para evaluar la viabilidad del polen de berenjena (Solanum melongena L. cv. Lila criolla) -germinación in vitro y sal de tetrazolio-, bajo condiciones tropicales, y determinar su uso potencial, para la producción de semilla híbrida. La prueba de viabilidad con la sal de tetrazolio mostró que la concen tración de 0,25% permite diferenciar, cualitativa y cuantitativamente, los granos de polen viables y, además, acusó disminución lineal significativa por cada unidad porcentual de la concentración de la sal. Con el método in vitro, el incremento lineal fue significativo por cada hora de incubación. Ambos métodos resultaron confiables, para estimar la viabilidad del polen en el cultivar estudiado, con la salvedad de la concentración de tetrazolio.
Palabras clave: Respiración del polen, floración, tetrazolio, germinación in vitro.
SUMMARY
Pollen viability influences the production and fruit quality of cultivated species. Its study is necessary in breeding programs, especially when trying to produce hybrid cultivars. The research was carried out at Monteria, Cordoba, Colombia, in order to compare the efficiency of two methods for assessing pollen viability of the eggplant (Solanum melongena L. cv. Lila criolla): in vitro germination and tetrazolium saltunder tropical conditions, and to determine its potential use in hybrid seed production. The viability test with the tetrazolium salt showed that the concentration of 0.25% allows differentiating, qualitatively and quantitatively, viable pollen grains, and it also presented significant linear decrease per unit of concentration of salt. In the in vitro method, the linear increase was significant for each hour of incubation. Both methods were reliable for estimating pollen viability in the cultivar studied.
Key words: Pollen respiration, flowering, tetrazolium, in vitro germination.
INTRODUCCIÓN
En el Caribe colombiano, la producción de berenjena se realiza durante todo el año con variedades, cuyos rendimientos no superan las 10t*ha-1, lo que afecta la competitividad y la posibilidad de incursionar en mercados internacionales (Agronet, 2011). La baja productividad obedece a factores que afectan el potencial de producción y la calidad de fruto, tales como floración deficiente, aborto de flores y la malformación de frutos, a causa de las oscilaciones de humedad relativa (79% a 99%), número de horas luz inferiores a siete y valores altos de temperatura ambiental (24°C a 30°C), que inciden en la microsporogénesis y germinación del grano de polen (Araméndiz et al. 2007). Esto constituye un problema, si se pretende acceder a mercados altamente demandantes y exigentes, como Estados Unidos y Canadá (Araméndiz et al. 2008), de manera que, volumen, calidad y trazabilidad, resultan relevantes para el aprovechamiento de los tratados comerciales, presentes y futuros. Ante este escenario, el uso de semilla híbrida representa una alternativa para mejorar los indicadores de rendimiento y de calidad de fruto.
El almacenamiento del polen es de gran importancia en los programas de mejoramiento genético, cuando los padres difieren en su etapa reproductiva, ya que permite la sincronía artificial, con fines de hibridación para la producción de semilla híbrida, con características genéticas favorables presentes en parentales; en tales casos, el polen podría ser utilizado en cualquier momento para polinización artificial, como también para complementar la acción de agentes polinizadores (Bettiol Neto et al. 2009).
La viabilidad del polen puede ser medida, a través de diferentes técnicas. Estas pueden ser agrupadas en métodos directos in vitro (Gomes et al. 2003; Pio et al. 2007) e in vivo (Oliveira et al. 2001) y métodos indirectos, basados en parámetros ecológicos, como el color de la reacción bioquímica (Dafni, 1992).
La prueba de tinción con sales de tetrazolio pertenece al grupo de las pruebas citológicas, cuya característica es entregar una indicación colorimétrica de la actividad metabólica de los granos de polen luego de su rehidratación, permitiendo estimar la viabilidad del polen (Astudillo, 2006). Estas pruebas tiñen los constituyentes específicos de los granos de polen maduros, almidón y calosa, en particular, gracias al azul de anilina o al yoduro de potasio (Dumas et al. 1984) y la pared y el protoplasma, simultáneamente (Alexander, 1969). Además, pueden indicar la presencia de enzimas funcionales, como peroxidasa, esterasa y deshidrogenasa (Iborra et al. 1992).
Considerando lo antes anotado, el objetivo de la presente investigación fue comparar la eficiencia de dos métodos para evaluar la viabilidad del polen de berenjena (Solanum melongena L. cv. Lila criolla), bajo condiciones tropicales y suministrar información valiosa para su uso potencial en la producción de semilla híbrida.
MATERIALES Y MÉTODOS
El material experimental, se obtuvo en la vereda ''Garzones'', del municipio de Montería, Colombia, ubicada a 13 m.s.n.m. y coordenadas geográficas de 8° 44' de latitud norte y 75° 33' de longitud oeste. En abril de 2011, se colectó polen de berenjena del cultivar regional ''Lila criolla'', a partir de botones florales en pre-antesis, en horas de la mañana (7:00 a.m. a 8:00 a.m.). Se almacenó, inicialmente, en bolsas de papel y se transportó en nevera de polietileno expandido, al Laboratorio de Genética y Fitomejoramiento de la Facultad de Ciencias Agrícolas de la Universidad de Córdoba. Para la extracción del polen de los botones florales, se usó un vibrador eléctrico, siguiendo las indicaciones de Araméndiz et al. (2008). Las condiciones ambientales del día de recolección del polen fueron: 27,3°C de temperatura, 81,0% de humedad relativa, 2,8 horas de brillo solar y 7,0mm de precipitación.
Prueba de la sal de tetrazolio: para evaluar la calidad del polen, se llevó a cabo un experimento con la sal de tetrazolio, diluida en agua destilada, a las concentraciones de 0,25%; 0,50%; 0,75% y 1,0%. El efecto de la sal de tetrazolio, se evaluó sobre 250 granos de polen contenidos en cinco tubos eppendorf, los cuales, fueron cubiertos con una lámina de aluminio. Cada unidad experimental estuvo conformada por 50 granos de polen. Una vez aplicada la sal de tetrazolio, se agitaron los tubos durante 20 segundos, para un mejor contacto entre los granos de polen y la solución, siguiendo la metodología de França Neto et al. (2009); luego, se colocaron en una incubadora a 25°C, durante 24 horas.
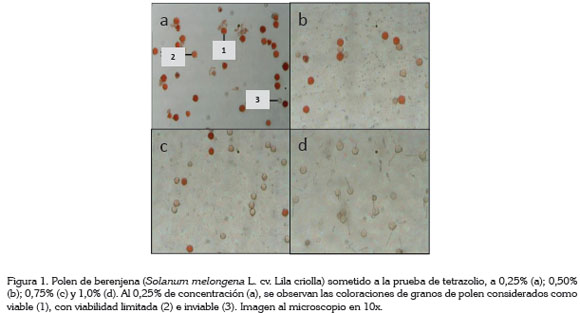
Las variables respuesta consideradas en la investigación fueron el color de la masa en el microtubo a simple vista; el color de los granos de polen observados al microscopio óptico a 10x; el color de los granos de polen visualizados en el computador, después de ser puestos en papel filtro, usando lentes de aumento 0,5x y registros fotográficos, utilizando una cámara Visca Visión modelo DV-2B acoplada al microscopio y el porcentaje de polen viable (obtenido por la relación entre el número de granos de polen viables y el total de cada tratamiento). Es importante resaltar que los granos de polen viables registran coloración roja, en tanto que los no viables, acusan ausencia de coloración.
Prueba de evaluación in vitro: Para determinar la viabilidad del polen en condiciones in vitro, se utilizó el medio de cultivo de Reddy & Kakani (2007), constituido por 100g de sacarosa (C12H22O11), 500mg de nitrato de calcio [Ca (NO3)2. 4H2O], 120mg de sulfato de magnesio (MgSO4), 100mg de nitrato de potasio (KNO3) y 120mg de ácido bórico (H3BO3), disueltos en 1000 ml de agua destilada. Posteriormente, se le agregó 10g de agar y el pH fue ajustado a 6,0.
El medio de cultivo (28mL) fue vertido en cajas de Petri de vidrio de 9,0cm de diámetro. Previo a su dispersión en el medio de cultivo, con el uso de un pincel, los granos de polen fueron rehidratados durante dos horas en cámara húmeda, a temperatura ambiente, para la restauración de lípidos en las membranas celulares (França Neto et al. 2010), facilitando su germinación. La temperatura de incubación fue de 25°C, por ocho horas, con lecturas cada dos, de acuerdo a la metodología propuesta por Guler et al. (1995).
Se tomaron cinco campos ópticos al azar por repetición, para el conteo de polen. Un grano de polen, se consideró germinado, cuando el tubo polínico registró una longitud mayor o igual al diámetro del grano de polen, siguiendo las indicaciones de Singh & Shono (2003), França Neto et al. (2009) y Suárez et al. (2010).
Las variables de respuesta fueron la longitud del tubo polínico (mm), el diámetro del grano de polen (mm), el número de granos de polen viables y el porcentaje de granos de polen germinados, sobre la base de 50 granos tomados al azar por repetición. Éste, se definió por la relación entre el número de granos de polen germinados en cada campo óptico y total de granos de polen en el mismo, de acuerdo a Sorkheh et al. (2011). Para las observaciones, conteo y fotografía de los granos de polen germinados, se utilizó un estereoscopio óptico Carl Zeiss, Stani 2000-C, con aumento de 4x, acoplado a una cámara fotográfica Canon Power Shot G10, con visualización en un monitor Philips. Las mediciones, se realizaron utilizando el Software Analizador de Imagen Carl Zeiss, AxioVision 4.3.
Para la prueba de evaluación in vitro, se utilizaron cinco tiempos de incubación: 2, 4, 6 y 8 horas. El efecto del tiempo de incubación, en el medio de cultivo, sobre la viabilidad del polen, se evaluó sobre los granos de polen, contenidos en cinco cajas de petri (unidades experimentales). La estructura del diseño de tratamientos es de gradiente, por lo que las estimaciones se hicieron mediante análisis de regresión.
Como complemento, se empleó la prueba de Tukey al 5%. Se analizaron los datos con el paquete estadístico SAS versión 9.2 (SAS, 2008).
RESULTADOS Y DISCUSIÓN
Viabilidad del polen con la prueba del tetrazolio: El análisis cualitativo para determinar la viabilidad del polen de berenjena (Figura 1), mostró respuesta diferencial a las concentraciones de la sal de tetrazolio, en las condiciones que se realizó el estudio. A concentraciones mayores a 0,25%, los granos de polen presentaron tonalidad de roja muy tenue, lo que según Ilgin et al. (2007), se pueden calificar como semiviables y se explica por la escasa reducción de la sal de tetrazolio a formazán, por acción de las enzimas deshidrogenasas en las células constituyentes de los granos de polen (Delouche et al. 1976). Ello coincide con lo reportado por França Neto et al. (2009), quienes a concentraciones de 0,5% y 1,0% reportaron coloración blanca y muy oscura de los granos de polen, para la primera y la segunda concentración, en el cultivar híbrido de berenjena Ciça, lo que conduce a evaluaciones inadecuadas, ya que dichas concentraciones afectan la actividad de la deshidrogenasa.

La concentración de 0,25% de sal de tetrazolio fue la mejor para identificar granos de polen viables (Figura1), cuya condición está relacionada con la alta humedad relativa (81%) y temperatura del ambiente (22°C), al momento de la colecta, lo que según Bonaventure (1999) son dos aspectos fundamentales para la polinización y la fecundación. La sal de tetrazolio reacciona con el hidrógeno, producto de la respiración celular, al entrar en contacto con tejidos vivos y vigorosos y facilita la coloración lenta y uniforme de color rojo, por lo que se considera un método colorimétrico confiable, que suministra resultados semejantes a los estimados, a través de métodos in vitro (Munhoz et al. 2008; Gaspar - Oliveira et al. 2010).
Las concentraciones de 0,50%, 0,75% y 1,0% (Figura 1) afectan la uniformidad y la distribución del color rojo, que resulta mucho más claro, por la poca reducción de la sal de tetrazolio a formazán por las enzimas deshidrogenasas (Delouche et al. 1976) y concuerda con lo reportado por Barros et al. (2005), en semillas de Cucurbita pepo y Bhering et al. (2005), en semillas de Citrullus lanatus. Estos últimos autores indican que los tejidos vigorosos, cuando son sometidos a altas concentraciones, en vez de registrar un color rojo intenso, acusan una coloración rojo tenue, por la poca actividad de las enzimas deshidrogenasas.
Contrariamente, en semillas de leucaena (Leucaena leucocephala (Lam.) de Wit.), en las cuales, se evaluó la respuesta a tres concentraciones de tetrazolio, Costa & Santos (2010) observaron que, bajo la concentración de 1,0%, los tejidos asumen un color rojo intenso. Esto dificulta la valoración de las semillas, siendo ideal el tratamiento de 0,15%, por un tiempo de dos a cuatro horas.
El color rojo intenso, se relaciona con polen viable. En las coloraciones rojo tenue y muy tenue, el polen presenta una viabilidad limitada y los granos sin color son inviables, de acuerdo a la guía la técnica utilizada por ISTA (1996), para análisis de viabilidad de semillas agrícolas. De acuerdo a lo observado en el presente trabajo (Figura 1), la concentración de tetrazolio más adecuada para evaluar la viabilidad de polen de berenjena es la de 0,25%, ya que presentó una mejor reacción bioquímica, obteniéndose una coloración roja bien definida de los granos de polen viables; sin embargo, França Neto et al. (2009) reportaron el valor de 0,75%, señalando que la tinción del polen al 1% fue demasiado oscura y al 0,5% clara, lo que puede obedecer al genotipo y a las condiciones ambientales de colecta. Reportan, además, que la mayoría de los granos de polen resultaron incoloros, cuando se observaron al microscopio, bajo lupa y en papel, a la concentración de 0,5%. Esto corrobora lo anotado por Barros et al. (2005) y Bhering et al. (2005), en el sentido de que las altas concentraciones de sal de tetrazolio afectan la coloración roja normal, arrojando conclusiones ambiguas, en razón a que granos de polen abortados pueden presentar coloración semejante a la de los granos viables (Heslop- Harrison & Heslop-Harrison, 1970).
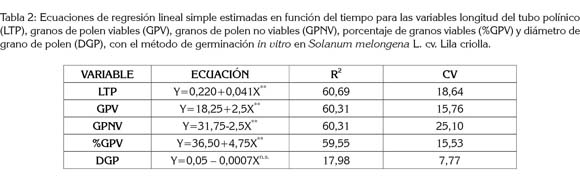
El porcentaje de granos de polen viables presentó respuesta lineal negativa altamente significativa, con respecto a las concentraciones de tetrazolio (0,25%, 0,50%, 0,75% y 1,0%). En la ecuación estimada Y= 53 - 43,84X, (R2 54,35%), el porcentaje de granos de polen viable disminuye en 43,84% por cada centésima porcentual de concentración de la sal de tetrazolio, en el rango de concentración probado.
El análisis de varianza para el porcentaje de granos de polen viable registró diferencias altamente significativas, entre las concentraciones de tetrazolio.
La prueba de comparación de medias (Tabla 1) corrobora que la concentración de 0,25% resultó ser el mejor tratamiento para cuantificar el porcentaje de granos de polen viable, con un 42,80%, hecho que concuerda con la valoración cualitativa realizada en los tubos Eppendorf, coloración en el papel y microscopio óptico en 10x, donde se registró una declinación en la coloración, cuando se incrementó la concentración de la sal de tetrazolio. Esto indica que la viabilidad del polen es afectada por la sal, ya que una mayor absorción de la misma puede causar daño en los tejidos vivos, por una alta actividad respiratoria.
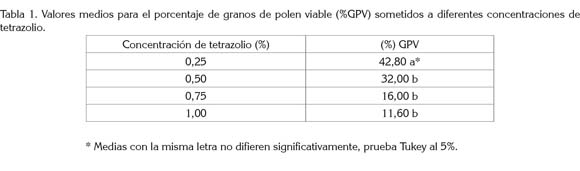
Viabilidad del polen bajo condiciones de germinación in vitro: La tabla 2 resalta las regresiones lineales estimadas para la germinación de los granos de polen en condiciones in vitro, en función del tiempo de incubación. Las ecuaciones que explican el comportamiento de la longitud del tubo polínico (LTP), número de granos de polen viables (GPV) y no viables (GPNV) y porcentaje de granos de polen viables (%GV), resultaron ser altamente significativas. Para el diámetro del grano de polen (DGP), la regresión lineal resultó no significativa, por lo que no pudo ser explicado satisfactoriamente, dada la magnitud de su coeficiente de determinación (Tabla 2).
El porcentaje de granos de polen viable in vitro, se ajustó a un modelo de regresión lineal altamente significativa y destaca incrementos del 4,75%, por cada hora de incubación. Este efecto, se podría atribuir al calcio y a los iones de hidrógeno, que juegan un papel importante en el crecimiento y en la orientación del tubo polínico, como lo reportado por Michard et al. (2008), destacando el rol importante de estos elementos en la actividad respiratoria. Estos valores, se consideran superiores a los reportados por França Neto et al. (2010), quienes después de cuatro horas registraron ausencia de germinación, logrando un 66,0% a las 24 horas de incubación, dado que a medida que transcurre el tiempo, se incrementa el porcentaje de germinación de los granos de polen, hasta un punto máximo, después, del cual, decrece hasta hacerse nulo, por declinación de la respiración (Karapanos et al. 2009).
La longitud del tubo polínico presentó respuesta lineal altamente significativa, según, la cual, el crecimiento del tubo polínico es de 0,041mm por cada hora de incubación, en el periodo de 8 horas de duración de la prueba. Tal crecimiento es relativamente lento para la fecundación, ante una posible similitud del tejido conductor del estilo con la composición del medio de cultivo utilizado, ya que una demora considerable para la cariogamia en el saco embrionario del rudimento seminal, podría conducir a la degradación del ovario (Sharafi, 2011), afectándose la calidad de fruto y el rendimiento (Karapanos et al. 2009).
La tasa de crecimiento en longitud del tubo polínico, estimada en el presente estudio, es inferior a las registradas por Figueroa-Castro & Holtsford (2009), en Nicotiana longiflora y N. plumbaginifolia, quienes después de 12 horas de incubación encontraron valores entre 0,39 ± 0,06mm/h y 0,70 +0,08mm/h, respectivamente, siendo además superiores para polen derivado de polinización cruzada que por autofecundación. Esto se explica por mecanismos de postpolinización, que favorecen el crecimiento del tubo polínico, que no garantizan éxito en la fecundación, dada la existencia de mecanismos pre - zigóticos, como la interacción entre el estilo y el grano de polen, que pueden favorecer o inhibir el crecimiento del tubo polínico (Erbar, 2003; Kruszewski & Galloway, 2006).
El diámetro del tubo polínico no registró regresión significativa en los modelos polinómico, logarítmico y exponencial probados, por lo que el crecimiento diametral permanece prácticamente constante, mientras crece en longitud. No se observó un crecimiento diferencial entre estos dos tipos de crecimiento alométrico, que puede estar influenciado por la concentración variable de calcio y de magnesio (Gass et al. 2005; Karapanos et al. 2006).
El análisis de regresión para el número de granos de polen viables mostró respuesta lineal significativa, indicando una reducción de 2,5 granos de polen por cada hora de incubación, en el medio de cultivo; lo que indica, que las reservas de energía endógena en los granos de polen son suficientes para mantener una tasa respiratoria, que garantiza la viabilidad de los mismos. De forma similar, Karapanos et al. (2009) encontraron que en tomate tal tasa respiratoria decrece después de ocho horas de período de incubación. Al respecto, Soares et al. (2008) y França Neto et al. (2009) señalan que el azúcar en el medio de cultivo debe proveer un balance osmótico entre la solución y la germinación del grano de polen, con el fin de suministrar la energía necesaria, para el crecimiento del tubo polínico, simulando el ovario de la planta.
Los anteriores resultados confirman que el método de germinación in vitro da una aproximación mucho más cercana a lo que ocurre en realidad (La Porta & Roselli 1991), puesto que este medio de cultivo simula el exudado estigmático y proporciona un sustrato para que la germinación del polen, se lleve a cabo. Posteriormente, el conteo de los tubos polínicos y su longitud aseguran que los granos de polen están vivos y que están ocurriendo procesos metabólicos en ellos.
Los dos métodos aquí evaluados son útiles para estimar la calidad del polen de berenjena. La concentración de tetrazolio al 0,25% permite identificar la viabilidad de granos de polen bajo las condiciones en que fue realizado el estudio. El porcentaje de germinación de granos de polen, la longitud del tubo polínico y los granos de polen viables, determinados a través del método in vitro, acusaron respuesta lineal en las primeras ocho horas de incubación, por lo que este método resulta confiable para evaluar la viabilidad polínica en ambientes tropicales. El polen fresco presenta características de vigor, de viabilidad y de longevidad en las primeras ocho horas de colecta, que garantizan su calidad para la hibridación artificial.
Conflicto de intereses: El manuscrito fue preparado y revisado con la participación de todos los autores, quienes declaramos que no existe ningún conflicto de intereses, que ponga en riesgo la validez de los resultados presentados.
BILBIOGRAFÍA
1 AGRONET. 2011. Área cosechada, producción y rendimiento de berenjena 1997-2010. Ministerio de Agricultura y Desarrollo Rural. Disponible desde Internet en: http://www.agronet.gov.co (con acceso: 31/10/2011).
2. ALEXANDER, M.P. 1969. Differential staining of aborted and non aborted pollen. Stain Techn. (USA). 44(3):117-122.
3. ARAMÉNDIZ, H.; CARDONA, C.; JARMA, A.; ESPITIA, M. 2008. El cultivo de la Berenjena (Solanum melongena L.). 1ª ed. Bogotá, Ed. Produmedios. 152p.
4. ARAMÉNDIZ, H.; CARDONA, C.; JARMA, A.; ROBLES, J.; MONTALVAN, R. 2007. Efectos del almacenamiento en la calidad fisiológica de la semilla de berenjena (Solanum melongena L.). Agr. Col. 25(1):104-112.
5. ASTUDILLO, M.J. 2006. Evaluación de métodos de conservación de polen sometido a distintos tiempos de almacenaje de tomate (Lycopersicon esculentum Mill). Ed. Pontificia Universidad Católica de Valparaiso. 54p.
6. BARROS, D.I.; DIAS, D.C.F.S.; BHERING, M.C., DIAS, L.A.S.; ARAUJO, E.F. 2005. Uso do teste de tetraazolium para avalição da qualidade fisiológica de sementes de abobrinha (Cucúrbita pepo L.). Rev. Bras. Sementes. 27(2):165-172.
7. BETTIOL NETO, J.E.; DEL NERO, M.; KAVAT, R.; PINTO-MAGLIO, C. 2009. Viabilidade e conservação de pólen de três anonas comerciais. Bragantia (Brasil). 68(4):825-837.
8. BHERING, M.C.; DIAS, D.C.; BARROS, D.I. 2005. Adequação da metodologia do teste de tetrazolio para avaliação da qualidade fisiológica de sementes de melancia. Rev. Bras. Sementes. 27(1):176-182.
9. BONAVENTURE, L. 1999. A cultura da cherimólia e de seu híbrido a atemóia. São Paulo, Ed. Nobel. 181p.
10. COSTA, C.; SANTOS, C. 2010. Teste de tetrazólio em sementes de leucina. Rev. Bras. Sementes. 32(2):66-72.
11. DAFNI, A. 1992. Pollination ecology: a practical approach (the practical approach series). Oxford University Press. New York. 250p.
12. DELOUCHE, T.; STILL, W.; RASPET, M.; LIENHARD, M. 1976. Prueba de viabilidad de la semilla con tetrazol. Brasília, DF. Agiplan. 103p.
13. DUMAS, C.; DUPLAN, J.C.; GAUDE, T.; SAID, C. 1984. Cytologie et physico-chimie, deux approches complémentaires pour tester la viabilité pollinique. Versalles. 27-30 sept 1983. Les colloques de l'INRA. 21:415-421.
14. ERBAR, C. 2003. Pollen tube transmitting tissue: place of competition of male gametophytes. Int. J. Plant Sci. (USA). 164:S265-S277.
15. FIGUEROA-CASTRO, D.; HOLTSFORD, T.P. 2009. Postpollination mechanisms in Nicotiana longiflora and N. plumbaginifolia: pollen tube growth rate, offspring paternity and hybridization. Sexual Plant Reprod. (USA). 22(3):187-196.
16. FRANÇA NETO, L.V.; NASCIMENTO, W.; CARMONA R., DE FREITAS, R. 2010. Tolerância à dessecação de pólen de berinjela. Rev. Bras. Sementes. 32(1):53- 59.
17. FRANÇA NETO, L.V.; NASCIMENTO, W.; CARMONA, R.E.; DE FREITAS, R. 2009. Viability of eggplant pollen. Crop Breeding Appl. Biotechn. (Brasil). 9(4):320-327.
18. GASS, N.; GLAGOTSKAIA, T.; MELLEMA, S.; STUURMAN, J.; BARONE, M.; MANDEL, T.; ROESSNERTUNALI, U.; KUHLEMEIER, C. 2005. Pyruvate decarboxylase provides growing pollen tubes with a competitive advantage in Petunia. The Plant Cell (USA). 17(8):2355-2368.
19. GASPAR-OLIVEIRA, M.C.; MARTINS, C.CH.; NAKAGAWA, J. 2010. Avaliação da qualidade fisiológica de sementes de mamoneira (Ricinus communis l.) pelo teste de tetrazólio. Rev. Bras. Sementes. 32(1):186-196.
20. GOMES, P.R.; RASEIKA, M.C.B.; BAUDET, L.L.; PESKE, S.T. 2003. Armazenamento de grão de pólen de cebola (Allium cepa L.). Rev. Bras. Sementes. 25(1):14-17.
21. GULER, H.Y.; ABAK, K.; ETI, S. 1995. Method, medium and incubation time suitable for in vitro germination of eggplant (S. melongena) pollen. Acta Hort. (Bélgica). 412:99-105.
22. HESLOP-HARRISON, J.; HESLOP-HARRISON, Y. 1970. Evaluation of pollen viability by enzymatically induced fluorescence; intracellular hydrolysis of fluorescein diacetate. Stain Techn. 45(3):115-120.
23. IBORRA, J.L.; GUARDIOLA, J.; MONTANER, S.; CANOVAS, M.; MANJON, A. 1992. 2, 3, 5 Triphenyltetrazolium chloride as a viable assay for immobilized plant cells. Biotechn. Techn. (Reino Unido). 6(4):319-322.
24. ILGIN, M.; ERGENOGLU, F.; CAGLAR, S. 2007. Viability, germination and amount of pollen in selected caprifig types. Pak. J. Bot. (Pakistan). 39(1):9-14.
25. INTERNATIONAL SEED TESTING ASSOCIATION (ISTA). 1996. International Rules For Seed Testing. Adopted at the Twenty - Fourth International Seed Testing Congress, Denmark 1995, to become effective on 1 July 1996. Zurich, Switzerland. 335p.
26. KARAPANOS, I.C.; AKOUMIANAKIS, K.A.; OLYMPIOS, C.M.; PASSAM, H.C. 2009. The effect of substrate, ADP and uncoupler on the respiration of tomato pollen during incubation in vitro at moderately high temperature. Sexual Plant Reprod. 22(3):133-140.
27. KARAPANOS, I.C.; AKOUMIANAKIS, K.A.; OLYMPIOS, C.M.; PASSAM, H.C. 2006. The influence of gelling agent purity and ion additions on in vitro tomato pollen germinability and pollen tube growth on semi-solid substrates. Plant Cell Tiss. Organ Cult. 87(2):181-190.
28. KRUSZEWSKI, L.J.; GALLOWAY, L.F. 2006. Explaining outcrossing rate in Campanulastrum americanum (Campanulaceae): geitonogamy and cryptic self-incompatibility. Int. J. Plant Sci. 167(3):455-461.
29. LA PORTA, N.; ROSELLI, G. 1991. Relationship between pollen germination in vitro and fluorochromatic reaction in cherry clone F12/1 (Prunus avium L.) and some of its mutants. J. Hort. Sci. & Biotechn. (Reino Unido). 66(2):171-175.
30. MICHARD, E.; DIAS, P.; FEIJÓ, J.A. 2008. Tobacco pollen tubes as cellular models for ion dynamics: improved spatial and temporal resolution of extracellular flux and free cytosolic concentration of calcium and protons using pHluorin and YC3.1 CaMeleon. Sexual Plant Reprod. 21(3):169-181.
31. MUNHOZ, M.; FERNANDES, C.; MEISSNER, P.; BARTH, O.; REINERT, F. 2008. Viabilidade polínica de Carica papaya L.: uma comparação metodológica. Rev. Bras. Bot. 31(2):209-214.
32. OLIVEIRA, M.S.P.; MAVES, M.M.; KALUME, M.A.A. 2001. Viabilidade de pólen in vivo e in vitro em genótipos de açaizeiro. Acta Bot. Bras. 15(1):27-33.
33. PIO, L.A.S.; RAMOS, S.D.; PASQUAL, M.; JUNQUEIRA, K.P.; SANTOS, F.C.; RUFINI, J.C.M. 2007. Viabilidade do pólen de laranjas doces em diferentes condições de armazenamento. Ciência e Agrotecn. (Brasil). 31(1):147-153.
34. REDDY, K.R.; KAKANI, V.G. 2007 Screening Capsicum species of different origins for high temperature tolerance by in vitro pollen germination and pollen tube length. Sci. Hort. 112(2):130135.
35. SAS, 2008. Statistical Analysis System, Institute Inc.SAS/STAT® 9.2 User's Guide. Cary, NC. 7880p.
36. SHARAFI, Y. 2011. An investigation on the pollen germination and tube growth in some Prunus persica genotypes and cultivars. Afr. J. Microbiol. Res. (Surafrica). 5(14):2003-2007.
37. SINGH, I.; SHONO, M. 2003. Effect of 24-epibrassinolide on pollen viability during heat-stress in tomato. Indian J. Experim. Biol. 41(2):174-176.
38. SOARES, T.; OLIVEIRA, S.; CARVALHO COSTA, M.A.; SANTOS-SEREJO, J.; SOUZA, A.; MORAIS LINO, L.; SOUZA, E.; JESUS, O. 2008. In vitro germination and viability of pollen grains of banana diploids. Crop Breed. Appl. Biotechn. 8(2):111-118.
39. SORKHEH, K.; SHIRAN, B.; ROUHI, V.; KHODAMBAS- HI, M. 2011. Influence of temperature on the in vitro pollen germination and pollen tube growth of various native Iranian almonds (Prunus L. spp.) species. Trees (Canada). 25(5):809-822.
40. SUÁREZ, L.; CASTILLA, Y.; HERNÁNDEZ, M.; SALOMÓN, J.; ESTÉVEZ, A.; CÉSPEDES, O.; ARAUJO, B. 2010. Efecto del PECTIMORF® en la germinación in vitro del polen de papa (Solanum tuberosum). Temas Cienc.Tecn. (Cuba). 14(40):43-46.
Recibido: Enero 23 de 2013 Aceptado: Agosto 24 de 2013

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.