CIENCIAS AGROPECUARIAS-Artículo Científico
RESIDUO AGRÍCOLA DE CEBOLLA LARGA COMO FUENTE DE ÁCIDO GIBERÉLICO
AGRICULTURAL WELSH ONION WASTE AS A SOURCE OF GIBBERELLIC ACID
Luis Eduardo Díaz1, Alejandra Henao2, Leidy Alejandra Ramírez3
1 Ph.D, Profesor Ingeniería Química. Universidad de La Sabana, Autopista Norte, Km. 7, Puente del Común, Chía, Cundinamarca, Colombia, luisdb@unisabana.edu.co
2Estudiante de Ingeniería de Producción Agroindustrial, Joven Investigador Semillero ProNIUS, Universidad de La Sabana. Facultad de Ingeniería. Chía, Cundinamarca, Colombia
3Estudiante de Ingeniería Química, Joven Investigador Semillero ProNIUS, Universidad de La Sabana. Facultad de Ingeniería. Chía, Cundinamarca, Colombia.
Rev. U.D.C.A Act. & Div. Cient. 16(2): 369-377, Julio-Diciembre, 2013
RESUMEN
Se evaluó la obtención de ácido giberélico a partir de la rama de la cebolla junca, como una opción a la producción convencional, a partir del hongo Gibberella fujikuroi y como alternativa para darle un valor agregado a este desecho agrícola. A partir de ramas de Allium fistulosum, se obtuvo un extracto en el que, mediante cromatografía en capa fina y comparación con un patrón comercial, se evidenció la presencia de ácido giberélico. La espectrofotometría ultravioleta reveló que la cantidad de ácido giberélico corresponde al 2,70% de cebolla seca. Para determinar el efecto biológico del extracto, se organizaron tres grupos de plantas de arveja, incluyendo un control, tratado con ácido giberélico comercial. Los resultados mostraron que el extracto incrementó la longitud de los tallos en un 47% y, el follaje, en un 67%, pero no presentó ningún efecto en la elongación de la raíz principal, frente al control. En estudios con grupos de semillas de lechuga, organizadas de forma similar que las plantas de arveja, pero con 39 individuos en cada grupo, se encontró que el extracto promueve la germinación de las mismas en un 28%, frente al control. En todos los ensayos, la respuesta con el extracto fue muy similar al obtenido con el patrón comercial; no se presentaron diferencias en el análisis de varianza por ANOVA y la prueba de Tukey (p < 0.05). Se concluye que, a partir de las ramas de la cebolla larga, se puede obtener un extracto crudo con presencia de ácido giberélico.
Palabras clave: Giberelinas, Allium fistulosum, fitohormonas.
SUMMARY
The obtention of gibberellic acid from the branches of the Welsh onion, as an option to the conventional gaining from the fungus Gibberella fujikuroi and as an alternative to give some value to this agricultural waste was evaluated. A extract was obtained from the branches and by thin layer chromatography and by comparison with a commercial pattern, the presence of gibberellic acid was evidenced. A ultraviolet spectrophotometry revealed that the concentration of gibberellic acid correspond to a 2.70% of the dry Welsh onion.To evaluate the biological effect of the extract, three groups of peas plants were arranged, including a control, treated with the commercial pattern of the Gibberellic acid. The results showed that the onion branch extract increased the length of plant's stem in a 47%, the foliage in a 67% but had no effect on the main root's elongation compared to the control. In studies with groups of lettuce seeds, arranged in similar ways than the peas plants but with 39 individuals per group, it was found that the extract promotes the seed's germination in 28% more, compared to the control. All the biological tests performed with the onion's extract presented similar behavior to those treated with the gibberellic acid pattern, presenting no differences in the variance analysis ANOVA and Turkey test (p < 0.05). It was concluded that it is possible to obtain a crude extract with the presence of gibberellic acid from this agricultural waste.
Key words: Gibberellins, Allium fistulosum, phytohormones.
INTRODUCCIÓN
El ácido giberélico, conocido como GA3, es un ácido carboxílico tetracíclico diterpenoide (Cardoso et al. 2012), miembro importante de la familia de las giberelinas y actúa en plantas, como una hormona de crecimiento natural. GAn es la forma en la que las giberelinas son identificadas, siendo en el orden en el que fue descubierta la giberelina en concreto. Las giberelinas controlan varios procesos del desarrollo, que son de gran interés alrededor del mundo, debido a su efectivo uso en agricultura, en viveros, en cultivo de tejidos y en jardines de té (Shukla et al. 2005); estimula la división y la elongación celular que afecta a las hojas, como también las células nacientes (Taiz & Zeiger, 2010). El GA3, se encuentra presente en pequeñas cantidades en un gran número de plantas y en algunos hongos (Contreras et al. 2001).
El GA3 ha sido empleado para incrementar la longitud y el peso de las plantas, incrementando el número de flores e induciendo la floración (Taiz & Zeiger, 2010). El uso global de GA3 por año es aproximadamente de 50 toneladas, excluyendo a China (Taiz & Zeiger, 2010). Industrialmente, el GA3 es producido por fermentación sumergida o cultivos de sustrato sólido usando Gibberella fujikuroi, renombrada Fusarium fujikuroi (Meleigy & Khalaf, 2009; Chavez et al. 2008; Shukla et al. 2005; Tang et al. 2000). El costo de la producción de GA3 usando esta técnica es muy alto, debido principalmente al bajo rendimiento y su costoso procesamiento (Rodrigues et al. 2009); dicho costo ha excluido la aplicación del GA3, a excepción de algunas plantas de gran valor. La reducción en sus costos de producción podría conducir a aplicaciones más amplias, para una variedad de cultivos.
El efecto de la pulverización de GA3 en concentraciones bajas (apróximadamente 5 a 200ppm) puede ser explotado, beneficiosamente, en las plantas, para controlar su desarrollo (Afshari et al. 2011; Da Silva et al. 2011). En melocotones y en nectarinas, se ha encontrado que es útil en la reducción de la densidad de flores y, consecuentemente, aumenta el tamaño de la fruta (Stern & Ben-Arie, 2009). Los niveles más elevados de giberelinas, se encuentran en las semillas inmaduras y en los frutos en desarrollo; sin embargo, el nivel normal de giberelinas es prácticamente nulo en las semillas maduras (Taiz & Zeiger, 2010).
El hecho que varios microrganismos, como bacterias y hongos sean capaces de sintetizar estas fitohormonas, ha propiciado su síntesis biotecnológica, siendo el empleo de éstas en la agricultura una alternativa compatible con el concepto de agricultura sostenible; no obstante, es necesario un buen método de extracción, pues esta operación puede representar un porcentaje considerable en el costo total del proceso y que presenta algunos problemas, como son la baja concentración en el medio de cultivo final y la presencia de sustancias extrañas, además del ácido giberélico. Actualmente, las investigaciones se han enfocado en buscar nuevos métodos de fermentación (Rodrigues et al. 2009), sustratos más económicos de cultivo (Cuali et al. 2011) y métodos más eficientes de extracción (Berrios et al. 2010).
La cebolla larga es una de las hortalizas de mayor consumo en los hogares colombianos, representa el 12,9% de la producción de hortalizas cosechadas en el territorio nacional (Pinzón, 2004). Su valor nutricional, se debe al aporte de minerales, compuestos fenólicos, vitaminas, provitaminas y moléculas con actividad antioxidante (Silveira et al. 2003). Este cultivo, se adapta a casi todos los climas, en un rango altitudinal entre los 1500 y los 3000msnm. Según el Departamento Administrativo Nacional de Estadística, (2001), las principales zonas productoras fueron: Aquitania (Boyacá), con el 80% de la producción nacional, Sabana de Bogotá, Tenerife (Valle del Cauca), Manizales y Villa María (Caldas), Pereira (Risaralda), Pasto, La Laguna (Nariño) y Cajamarca (Tolima).
En el 2011, se sembraron en Colombia 13.377ha, con una producción de 197.142t y un rendimiento de 24,5t/ha; la región con mayor área sembrada fue Boyacá, con 4.851ha (DANE, 2011).
En la presente investigación, se evaluó la obtención de ácido giberélico, a partir de la rama de la cebolla junca, como una opción a la producción convencional, a partir del hongo Gibberella fujikuroi y como alternativa para darle un valor agregado a este desecho agrícola. En la actualidad, las ramas de la cebolla larga son un desecho en los hogares y restaurantes colombianos; con este estudio, se pretende darles un valor agregado, utilizándolas como materia prima para la extracción del GA3.
MATERIALES Y MÉTODOS
Como patrón de ácido giberélico, se utilizó Auxillin® (Merck), un producto comercial que consiste en una giberelina con aproximadamente 90% de actividad biológica de la giberelina GA3; los demás reactivos empleados en el desarrollo del estudio, tales como etanol, cloroformo, acetato de etilo, ácido acético y ácido sulfúrico fueron reactivos analíticos (Sigma, Aldrich).
Se prepararon extractos etanólicos de cebolla larga Allium fistulosum, utilizando, específicamente, las ramas secas, parte de la cebolla que experimenta un crecimiento acelerado y prolongado, lo que permite plantear la hipótesis de la presencia de giberelinas, en esta parte de la planta. Se utilizó la cebolla Junca, variedad que se caracteriza por producir mayor número de tallos y por generar mayor rendimiento.
Para determinar cualitativamente la presencia de ácido giberélico en los extractos, se llevaron acabo estudios de cromatografía en capa fina (CCE) y, cuantitativamente, por espectrofotometría ultravioleta (UV). Adicionalmente, para evaluar su funcionalidad biológica, se determinó la longitud del tallo, número de hojas producidas, longitud de la raíz principal en plantas de alverja y tasa de germinación en semillas de lechuga.
Obtención del extracto: Se secaron 600g de hojas frescas provenientes de cebollas recién cosechadas, en un horno de laboratorio UNB-500 Memmert, durante siete días, a 22± 5°C. Después del proceso de secado, se pasó el producto por molino kitchenaid, reduciendo el producto a polvo, obteniendo 182,36g. Esto se hizo, con el fin de aumentar el área de contacto con el solvente y extraer, de manera más eficiente, las fitohormonas. Se introdujo el producto molido en etanol absoluto, en una proporción de 2:1 de etanol y cebolla, respectivamente. Se eligió el etanol, porque se comprobó, preparando diluciones ensayos previos del patrón del ácido giberélico en este solvente, que éste es completamente soluble en el mismo.
Las soluciones de etanol y cebolla, se dejaron en un ambiente oscuro y fresco durante dos semanas, para poder lograr una mejor extracción del ácido, con agitación de 200 rpm (MR3001K, Heidolph), a 18°C. Para concentrar el extracto y retirar completamente el etanol, se realizó una destilación a presión reducida en rotaevaporador, de referencia Heidolph Laborota-400, a una temperatura no mayor a los 35°C y 200 psi y, luego, se colocó la muestra en una estufa (horno de laboratorio UNB-500 Memmert), a la misma temperatura, hasta obtener una pasta verde oscura, que fue pesada. Se obtuvieron 16,0090g consistentes de sustancias solubles en etanol como giberelinas y clorofila, entre otros.
Análisis espectrofotométrico: Para la cuantificación de ácido giberélico en el extracto, primero se realizó un barrido en el espectro ultravioleta-visible (190-900 nm), con la muestra patrón de ácido giberélico Auxillin® (Merck), al 10% p/v, en etanol absoluto, para identificar la longitud de onda en la que el ácido tenía su máxima absorbancia. Para calibrar el equipo, se empleó el mismo alcohol, que se preparó con una solución etanolica de concentración 10% p/v y se corrió el análisis de barrido en el espectrofotómetro (Genesys 10s-uv/ vis, Thermo Scientific).
En el estudio espectrofotométrico, mediante los barridos realizados, se obtuvieron dos picos de máxima absorción en el espectro UV a 230 y 217nm, al emplear el patrón de ácido giberélico (Auxillin® (Merck)) y en el extracto de las ramas de cebolla, lo cual, fue acorde con lo reportado por Contreras et al. (2001).
Para leer las absorbancias de todas las muestras, se escogió una longitud de onda igual a 217nm, que está entre el rango de la longitud de onda para el ácido giberélico (Cuali et al. 2011); para tal efecto, se construyó una curva de calibración con ácido giberélico al 90% (Merck), entre 50 a 300µg/mL en etanol; cada punto de esta curva, se realizó por triplicado. Una vez preparadas las soluciones, se procedió a leer la absorbancia de cada una de ellas a la longitud de onda seleccionada (Genesys 10s-uv/vis, Thermo Scientific). Se observó gran similitud entre las absorbancias de las concen traciones más bajas (50 -150µg/mL), indicando que no existe diferencia entre los datos, pero a altas concentraciones (200-300µg/mL), se observó un incremento en la desviación estándar, por lo que se recomienda trabajar con concentraciones menores de 150µg/mL de esta fitohormona, para así disminuir el error entre los resultados.
Para el cálculo de la concentración de ácido giberélico en los extractos, se tomaron las absorbancias medidas y se interpolaron en la ecuación de la recta obtenida en la curva de calibración.
Analisis del extracto por Cromatografía en Capa Fina (CCF): Para corroborar la presencia del ácido giberélico en el extracto obtenido, se realizaron estudios de cromatografía en capa fina y análisis cualitativo, que permitió identificar la presencia del ácido giberélico en el extracto de cebolla obtenido (Castillo et al. 2007). Se disolvió una pequeña muestra de la pasta de cebolla obtenida (2mg), en un mililitro de etanol; luego, con ayuda de un capilar, se sembró una pequeña porción de la muestra y del patrón Auxillin® (Merck) en la placa de cromatografía en capa delgada (Merck), una al lado de la otra, con 0,8cm de distancia entre las muestras, se introdujo la lámina en un recipiente con ácido acético glacial, acetato de etilo y cloroformo en una proporción de 1:4:5, respectivamente, se permitió que el frente de corrido llegará hasta 0,5cm del extremo superior de la placa; este procedimiento se repitió tres veces. Las placas, se revelaron con una mezcla de ácido sulfúrico-etanol (95:5) y se determinaron las constantes Rf (Ratio of front), de las bandas que se desarrollaron.
Análisis de la funcionalidad biológica del extracto: Para determinar la funcionalidad biológica del ácido giberélico en el extracto, se diseñaron dos experimentos: el primero, consistió en organizar tres grupos de plantas de arveja: control (agua), tratado con extracto (0,5mg/mL) y tratado con patrón de ácido giberélico comercial (0,1mg/mL)), cada uno conformado por siete individuos, con un diseño experimental completamente al azar; las variables de respuesta fueron: longitud de los tallos, número de hojas y longitud de la raíz principal. Para el segundo experimento, se organizaron los mismos grupos de tratamiento con semillas de lechuga, con 39 individuos en cada grupo, para estudiar su relación con la germinación de las mismas; cada grupo fue sembrado en vasos con agua estéril y se les puso algodón en la parte superior, de tal manera, que el algodón tocara el agua, para que éste se mantuviese hidratado y las semillas tuvieran una fuente de agua permanente; la variable de respuesta fue el número de semillas germinadas. El nivel de agua original, se mantuvo constante todo el tiempo. Los vasos con las semillas, se dejaron en un cuarto con ventilación permanente, luz solar indirecta y con una temperatura promedio de 13°C. Las semillas del grupo uno, se rociaron por una sola vez, con 2mL de agua cada uno; las semillas del grupo dos, con 2mL, de una solución preparada con el extracto (0,5mg/mL) y, a las semillas del tercer grupo, se rociaron con 2mL del patrón de ácido giberélico (0,1mg/mL). Cada uno de los experimentos, se realizó tres veces.
Análisis estadístico. Para cada uno de los experimentos, se llevó a cabo el análisis de varianza y la prueba de Tukey (p< 0.05), para determinar diferencias entre los tratamientos utilizando el software SAS.
RESULTADOS Y DISCUSIÓN
Se determinó que el espectro UV de los extractos de cebolla era similar al patrón de ácido giberélico comercial (Auxillin®, Merck) y al obtenido por Contreras et al. (2001); sin embargo, el barrido mostró, para el extracto, un pequeño corrimiento (0,2nm) en la longitud de onda de mayor absorción frente al patrón de ácido giberélico. Esto pudo haber ocurrido, porque el ácido giberélico que se encuentra en la cebolla no está puro, consiste en una mezcla de giberelinas, que presentan absorción de la luz, a longitudes de onda entre los 210nm y los 230nm (Contreras et al. 2001), y a otros compuestos presentes en la mezcla, que interactúan con el ácido giberélico y causan un efecto hipsocrómico es decir desplazamiento hacia longitudes de onda más cortas. Se determinó, que el contenido de ácido giberélico en el extracto fue de 30,8%, en masa y, en la cebolla seca, de alrededor del 2,70%, que indica un alto contenido de esta fitohormona, en el concentrado obtenido.
En los estudios de cromatografía en capa fina (CCF), se encontró una banda para el patrón y el extracto, correspondiente a un Rf de 0,44, la cual, fue fluorescente bajo irradiación, con luz UV (254 y 350nm); este mismo resultado ha sido reportado por otros autores, para el ácido giberélico, obtenido de otras fuentes (Cuali et al. 2011; Castillo et al. 2007). La intensa fluorescencia presentada en el extracto permitió concluir que la concentración de ácido giberélico era alta, concordante con el valor de la concentración de ácido obtenido en los estudios espectrofotométricos. Mediante estos ensayos, se pudo determinar la presencia y la cantidad de ácido giberélico en las ramas de cebolla junca.
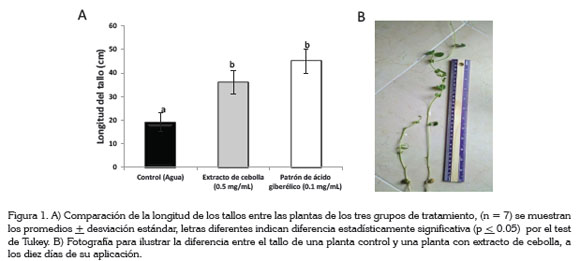
A nivel funcional, en plantas de arveja, se apreció claramente el efecto que tiene el extracto (0,5mg/mL) y el patrón de ácido giberélico Auxillin® (0,1mg/mL), en la elongación de los tallos; las plantas que estuvieron en contacto con el extracto son en promedio 18cm más altas y, para el patrón, 25cm más altas, aunque se proporcionó en una dosis, con una concentración cinco veces más baja que el extracto. Estadísticamente, por la prueba de Tuckey (95%), no se encontró diferencia entre la longitud del tallo de plantas tratadas con el extracto de cebolla y las tratadas con el patrón de ácido giberélico (Figura 1). Este fenómeno fisiológico fue el más notable y el primero que se le asignó a la aplicación de giberelinas en plantas enanas y en roseta y se debe, principalmente, a la activación de la elongación y la división celular (Balaguera et al. 2009). La actividad de algunas de las enzimas de la pared se ha correlacionado con el crecimiento inducido por giberelinas y la despolimerización de la pared celular (Taiz & Zeiger, 2010). Las giberelinas promueven el crecimiento celular, debido a que incrementan la hidrólisis de almidón, de fructanos y de sacarosa, con lo que se originan moléculas de fructosa y de glucosa. Estas hexosas proporcionan energía, vía respiración, contribuyendo a la formación de la pared celular; también hacen momentáneamente más negativo el potencial hídrico de la célula, lo que genera que el agua penetre con mayor rapidez, provocando la expansión celular y diluyendo los azúcares (Herrera et al. 2006). El elongamiento del tallo se ha encontrado en otras plantas, como las de tomate, provenientes de semillas embebidas en diferentes soluciones de GA3 (Balaguera et al. 2009), maracuyá dulce (Passiflora alata) (Leonel & Pedroso, 2005) y soya (Tanimoto, 1990), como respuesta a la extensibilidad de la pared celular. Con este ensayo, se evidencia funcionalmente la presencia de ácido giberélico en el extracto, al estimular la elongación del tallo, específicamente, de la distancia intermodal en las plantas, que fueron tratadas con esta mezcla.

Se encontró una diferencia significativa estadísticamente (p ≤ 0.05) entre las plantas que fueron expuestas al extracto o al patrón, en cuanto al número de hojas producidas (Figura 2), en comparación con el tratamiento control.
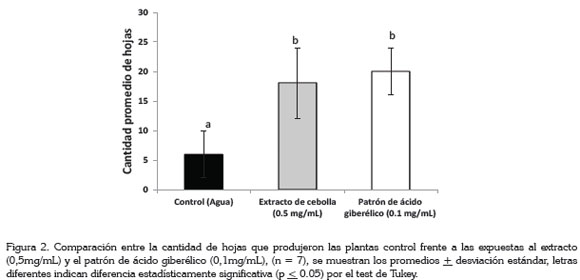
Como se puede observar en la figura 2, las plantas que estuvieron expuestas al extracto o al patrón presentaron tres veces mayor cantidad de hojas que las plantas control, mostrando que el ácido giberélico ejerce un aumento en el follaje de las plantas. Paroussi et al. (2002) determinaron que la aplicación de GA3, en una concentración de 200mg/L en fresa (Fragaria x annanassa Duch.), aumentaba el follaje, pero causó un excesivo incremento de la longitud del peciolo y de las inflorescencia, reduciendo la producción de frutos; no obstante, los mismos autores reportaron que con 50mg/L de GA3, se incremento en un 71% el follaje frente al testigo, sin afectar negativamente el desarrollo de la planta y la producción. Resultados similares en aumento de follaje, por la acción de GA3, también han sido descritos en remolacha (Garrod, 1974), en plántulas de papayo (Andrade et al. 2008) y en soya, lo cual, se atribuyó a la elongación celular (Leite et al. 2003).
En cuanto al efecto del extracto y del patrón de ácido giberélico en la elongación de la raíz, no se observaron diferencias en las plantas pertenecientes a estos dos grupos, en comparación con el grupo control, por la prueba de Tuckey (p ≤ 0.05). Este resultado es contradictorio con los encontrados por algunos investigadores en Arabidopsis, donde se ha determinado que el GA3 promueve el crecimiento de la raíz induciendo la degradación de proteínas, mediante la coacción con otras hormonas (Achard et al. 2003; Fu & Harberd, 2003; Fleet & Sun, 2005). Estas diferencias pueden ser debidas a las formas en como se condujeron los experimentos. Adicionalmente, Schmidt et al. (2003) mencionan que la acción de un regulador de crecimiento depende de los factores ambientales, el número y período de aplicación, la concentración utilizada, el estadio de crecimiento y la especie o cultivo evaluado, razones por las cuales, se pueden presentar comportamientos diferentes, bajo el mismo estímulo.
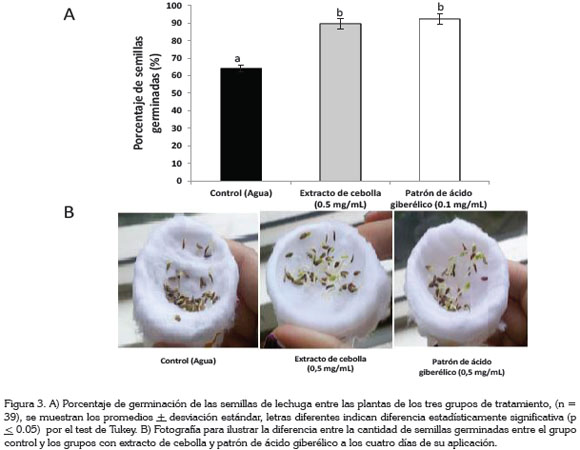
Igualmente, se pudo comprobar el efecto que tiene el ácido giberélico sobre la tasa de germinación de las semillas de lechuga; en promedio, el 90% de las semillas expuestas al extracto germinaron, mientras que solamente el 64% de las semillas expuestas a agua germinaron; la mayor diferencia se obtuvo con la aplicación del patrón de ácido giberélico, pues con él germinaron el 92% de las semillas; no se obtuvo diferencia estadística por la prueba de Tuckey (p ≤ 0.05), en el número de semillas germinadas, entre los grupos tratados con el extracto frente a las tratadas con el patrón (Figura 3). Este efecto, se puede deber a los efectos pleiotropicos del ácido giberélico como regulador de la germinación de las semillas, en alguna de las siguientes etapas: la activación del crecimiento vegetativo del embrión, el debilitamiento de la capa del endospermo constreñida por el crecimiento que rodea al almidón y la movilización de las reservas almacenadas en el endospermo (Taiz & Zeiger, 2010).
El GA3, se produce industrialmente vía microbiana por fermentación sumergida del hongo Gibella fujikoi (Shukla et al. 2005); sin embargo, en los últimos años se han realizado estudios para la obtención de GA3, que se basan, principalmente, en el mejoramiento de las condiciones para el crecimiento de las cepas productoras de GA3, nuevos diseños de fermentación y procesos de separación del principio activo (Rodrigues et al. 2009; Berrios et al. 2010).
Actualmente, se está evaluando el efecto que tiene GA3 en cultivos específicos (Khan et al. 2006; Sharma & Singh, 2009; Mansouri et al. 2011; Afshari et al. 2011; da Silva et al. 2011; Dagar et al. 2012; Cardoso et al. 2012; Imsabai & van Doorn, 2013) y se han obtenido grandes avances en el mecanismos de biosíntesis y de acción de la misma (Karakoc & Aksoz, 2006; Schwechheimer & Willige, 2009).
El principal problema de la producción de ácido giberélico consiste en la extracción y la purificación del ácido, que puede representar un porcentaje considerable en el costo total del proceso, debido a la baja concentración que se presenta en el medio de cultivo final y la presencia de otras sustancias, como el ácido acético, láctico y otras giberelinas (Eleazar, 2000). Aunque el contenido de ácido giberélico en las ramas de la cebolla junca es bajo (2,7%) comparado con el trabajo de Corona et al. 2005, en el cual, por medio de fermentación con el hongo Gibberella fujikuroi en estado sólido, utilizando harina de trigo y almidón soluble, como sustrato y optimizando las condiciones físicas y químicas en bioreactores, consistentes en columnas de vidrio, obtuvo 4,5-5,0% de ácido giberélico; esta puede ser una fuente alterna promisoria y darle un valor agregado a este tipo de material agrícola, que forma parte de los desperdicios en la industria de alimentos.
Por otra parte, en presencia del extracto y del patrón, se evidenció un mayor número de semillas germinando, 28 y 30% más, respectivamente, que en el grupo control.
Tomando en conjunto los resultados, se puede concluir que es posible obtener un extracto de ácido giberélico a partir de las hojas de la cebolla larga, desecho agrícola que forma parte de la basura de los restaurantes y de los hogares en Colombia.
Agradecimientos: Los autores expresan sus agradecimientos a la Facultad de Ingeniería y a la División de Investigación de la Universidad de La Sabana, por la financiación de la presente investigación. Conflicto de intereses: El manuscrito fue preparado y revisado con la participación de todos los autores, quienes declaramos que no existe ningún conflicto de intereses, que ponga en riesgo la validez de los resultados presentados.
BIBLIOGRAFÍA
1. ACHARD, P.; VRIEZEN, W.; VAN DER STRAETEN, D.; HARBERD, N. 2003. Ethylene regulates Arabidopsis development via the modulation of DELLA protein growth repressr function. Plant Cell. 15:2816-2825.
2. AFSHARI, H.; EFTEKHARI, M.; FARAJI, M.; EBADI, A.; ABBASPOUR, H. 2011. Effect of different levels of gibberellic acid on seed sprouting of some species of Salvia genus grown in Iran. J. Med. Plant. Res. 5(18):4688-4690.
3. ANDRADE, M.; AYALA, J.; ALIA, I.; RODRÍGUEZ, H.; ACOSTA, C.; LÓPEZ, V. 2008. Effect of germination promoters and substrates in the development of papayo seedlings. Rev. Fac. Agron. (LUZ)., 25:617-635.
4. BALAGUERA, H.; CÁRDENAS, J.; ÁLVAREZ, J. 2009. Effect of gibberellic acid (GA3) on seed germination and growth of tomato (Solanum lycopersicum L.). Acta Hort. 821:141-148.
5. BERRIOS, J.; PYLE, D.; AROCA, D. 2010. Gibberellic acid extraction from aqueous solutions and fermentation broths by using emulsion liquid membranes. J. Membr. Sci. 348(1-2):91-98.
6. CARDOSO, J.; ONO, E.; RODRIGUES, J. 2012. Gibberellic acid in vegetative and reproductive development of Phalaenopsis orchid hybrid genus. Hortic. Bras. 30(1):71-74.
7. CASTILLO, G.; ORTEGA, G.; CARABEO, V.; DELGADO, G.; MICHELENA, G. 2007. Determinación cualitativa de giberelinas y auxinas por cromatografía de capa fina. ICIDCA. Sobre los Derivados de la Caña de Azúcar. 1:12-17.
8. CHÁVEZ, M.; GONZÁLEZ, O.; NEGRETE, M.; VALLARINO, I.; ALATORRE, G.; ESCAMILLA, E. 2008. Kinetic of the gibberellic acid and bikaverin production in an airlift bioreactor. Process Biochem. 43:855-860.
9. CONTRERAS, P.; FAINI, F.; ROJAS, M. 2001. Obtención y separación de giberelinas lactónicas producidas por el hongo Gibberella fujikuroi para usarlas como estandares cromatograficos. Bol. Soc. Chil. Quím. 46(2):197-202.
10. CORONA, A.; SÁNCHEZ, D.; AGOSTIN, E. 2005. Effect of water activity on gibberellic acid production by Gibberella fujikuroi under solid-state fermentation conditions. Process Biochem. 40:2655-2658.
11. CUALI, I.; PAVÓN, S.; COLÍN, A. 2011. Producción de ácido giberélico a partir de Gibberella fujikuroi utilizando lodo residual municipal como sustrato. Univ. Sci. 16(1):51-62.
12. DAGAR, A.; WEKSLER, A.; FRIEDMAN, H.; LURIE, S. 2012. Gibberellic acid (GA3) application at the end of pit ripening: Effect on ripening and storage of two harvests of 'September Snow' peach. Scientia Hort. 140:125-130.
13. DANE. 2011. Dirección de Metodología y Producción Estadística - DIMPE -. Resultados Encuesta Nacional Agropecuaria ENA. Producción de cebolla junca en Colombia. Reportes estadísticos del sector agropecuario con base en evaluaciones agropecuarias del Ministerio de Agricultura y Desarrollo Rural. En línea: http://www.agronet.gov.co/agronetweb1/ Estad%C3%ADsticas/ReportesEstad%C3%ADsticos. aspx (con acceso 16/07/2013).
14. DA SILVA VIEIRA, M.; PEREIRA, G.; VACARO, A.; NEPOMUCENO, P.; GUIMARAES, C.; DE SOUSA, L.; GERALDO, N. 2011. Effect of gibberellic acido in the quality of chrysanthemum (Dendranthema grandiflora L.) c. Faroe. Afr. J. Biotechn. 10(71):15933-15937.
15. DEPARTAMENTO ADMINISTRATIVO NACIONAL DE ESTADÍSTICA. 2001. Primer censo del cultivo de cebolla larga en la región de la Laguna de Tota. Bogotá: DANE. p.24.
16. ELEAZAR, M. 2000. Optimization of gibberellic acid production by immobilized Gibberella fujikuroi mycelium in fluidized bioreactors. J. Biotecnol. 76(2- 3):147-155.
17. FLEET, C.; SUN, T. 2005. A DELLAcate balance: the role of gibberellin in plant morphogenesis. Curr. Opin, Plant. Biol. 8:77-85.
18. FU, X.; HARBERD, N. 2003. Auxin promotes Arabidopsis root growth by modulating gibberellin response. Nature. 421:740-743.
19. GARROD, J. 1974. The role of gibberellins in early growth and development of sugar beet. Plant Cell Physiol. 25(5):945-954.
20. HERRERA, J.; ALIZAGA, R.; GUEVARA, E.; JIMÉNEZ, V. 2006. Germinación y crecimiento de la planta. Fisiología de la producción de los cultivos tropicales. Editorial UCR. Vol. 4, 108p.
21. IMSABAI, W.; VAN DOORN, W.G. 2013. Effects of auxin, gibberellin, and cytokinin on petal blackening and flower opening in cut lotus flowers (Nelumbo nucifera). Postharvest Biol. Technol. 75:54-57.
22. KARAKOC, S.; AKSOZ, N. 2006. Some optimal cultural parameters for gibberellic acid biosynthesis by Pseudomonas sp. Turk. J. Biol. 30:81-85.
23. KHAN, M.; GAUTAM, C.; MOHAMMAD, F.; SIDDIQUI, M.; NAEEM, M.; KHAN, M. 2006. Effect of Gibberellic Acid Spray on Performance of Tomato. Turk. J. Biol. 30:11-16.
24. LEITE, V.; ROSOLEM, A.; RODRIGUES, J. 2003. Gibberellin and cytokinin effects on soybean growth. Sci. Agric. 60(3):537-541.
25. LEONEL, S.; PEDROSO, C. 2005. Producao de mudas de maracujazeiro-doce com o uso de biorregulador. Rev. Bras. Frutic. 27(1):107-109.
26. MANSOURI, H. ; ASRAR, Z.; AMAROWICZ, R. 2011. The response of terpenoids to exogenous gibberellic acid in Cannabis sativa L. at vegetative stage. Acta Physiol. Plant. 33 (4):1085-1091.
27. MELEIGY, S.; KHALAF, M. 2009. Biosynthesis of gibberellic acid from milk permeate in repeated batch operation by amutant Fusarium moniliforme cells immobilized on loofa sponge. Bioresour Technol. 100:374-379.
28. PAROUSSI, G.; VOYIATZIS, D.; PAROUSSI, E.; DROGOUR, P. 2002. Growth, flowering and yield responses to GA3 of strawberry grown under different enviromental conditions. Scientia Hort. 9:103-113.
29. PINZÓN, H. 2004. La cebolla de rama (Allium fistulosum) y su cultivo. Bogotá D.C. Corpoica. 40p.
30. RODRIGUES, C.; PORTO DE SOUZA, L.; TEODORO, J.; FRARON, J.; PANDEY, A.; SOCCOL, C. 2009. A New Alternative to Produce Gibberellic Acid by Solid State Fermentation. Braz. Arch. Biol. Technol. 52:181-188.
31. SCHMIDT, C.; BELLE, R.; NARDI, C.; TOLEDO, K. 2003. Acido giberelico (GA3) no crisantemo (Dedranthema grandiflora Tzvelev.) de corte viking: cultivo de verao. Ciencia Rural. 33(2):267-274.
32. SCHWECHHEIMER, C.; WILLIGE, B. 2009. Shedding light on gibberellic acid signalling. Curr. Opin. Plant Biol. 12(1):57-62.
33. SHARMA, R.; SINGH, R. 2009. Gibberellic acid influences the production of malformed and button berries, and fruit yield and quality in strawberry (Fragaria × ananassa Duch.). Scientia Hort. 119(4):430-433.
34. SHUKLA, R.; CHAND, S.; SRIVASTAVA, A. 2005. Batch kinetics and modeling of gibberellic acid production by Gibberella fujikuroi. Enz. Microb. Technol.6(4):492-497.
35. SILVEIRA, M.; MONEREO, S.; MOLINA, B. 2003. Alimentos funcionales y nutrición óptima ¿Cerca o lejos? Rev. Esp. Salud Públ. 77:323-324.
36. STERN, R.; BEN-ARIE, R. 2009. GA3 inhibits flowering, reduces hand-thinning, and increases fruit size in peach and nectarine. J. Hortic. Sci. Biotech.4(2):119-124.
37. TAIZ, L.; ZEIGER, E. 2010. Gibberellins: Regulators of Plant Height and Seed Germination, In: Plant Physiology. California: He Bejamin/Cumming PublishingCompany, Inc. Fifth ed. p.583-621.
38. TANG, Z.; ZHOU, R.; DUAN, Z. 2000. Separation of gibberellic acid (GA3) by macroporous adsorption resins. J. Chem. Technol. Biot. 75:695-700.
39. TANIMOTO, E. 1990. Gibberelin requirement for the normal growth of roots. En: Takahashi, N.; Phinney, B.; MacMillan, J. (eds.). Gibberelins. Springer-Verlag, New York. p.229-240.
Recibido: Abril 9 de 2013 Aceptado: Octubre 7 de 2013

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.