CIENCIAS AGROPECUARIAS-Artículo Científico
NIFEDIPINA, INCIDENCIA DE HIPERTENSIÓN PULMONAR HIPÓXICA Y ENGROSAMIENTO MUSCULAR DE ARTERIOLAS EN POLLOS DE ENGORDE
NIFEDIPINE, HYPOXIC PULMONARY HYPERTENSION INCIDENCE AND ARTERIOLES MUSCULAR ENGROSSMENT IN BROILERS
Rocío Rincón1, Martha Moreno2, Camilo Orozco3, Aureliano Hernández4
1 MVZ, c.M.Sc., Universidad Nacional de Colombia, Sede Bogotá, Facultad de Medicina Veterinaria y de Zootecnia, rprinconl@ unal.edu.co
2 DMV, M.Sc., Ph.D., Universidad Nacional de Colombia, mjmorenod@unal.edu.co
3 MV, Ph.D., Universidad Nacional de Colombia, Sede Bogotá, Facultad de Medicina Veterinaria y de Zootecnia, caorozcos@unal.edu.co
4 DMV, M.Sc, Ph.D. Universidad Nacional de Colombia, Sede Bogotá, Facultad de Medicina Veterinaria y de Zootecnia, ahernandezv@unal. edu.co
Rev. U.D.C.A Act. & Div. Cient. 16(2): 435-444, Julio-Diciembre, 2013
RESUMEN
En la Hipertensión Arterial Pulmonar (HAP) hipóxica, enfermedad que afecta tanto a mamíferos como a pollos de engorde, ocurre una elevación exagerada de la concentración intracelular del calcio y, en consecuencia, vasoconstricción y el engrosamiento de la túnica muscular vascular. El bloqueador de canales de calcio nifedipina es un vasodilatador empleado en HAP en humanos. Se evaluó el efecto del suministro de nifedipina en pollos de engorde, en dosis de 6 y 2mg/kg de peso vivo, entre los días 4 a 21 y desde el día 22 hasta el 42 de edad, de 30 y 10mg/kg, respecto a un grupo control, sobre la incidencia de HAP, el índice de masa cardiaca (IC) y el grosor de la capa media muscular de arteriolas pulmonares (%T), con diámetros de 50 a 100 micrómetros (μM). Hubo reducción numérica de la mortalidad por HAP en los pollos tratados, relacionada con la dosis del fármaco. Los valores del IC de las aves que murieron espontáneamente antes del día 42 de edad no presentaron diferencias estadísticas entre tratamientos, así como entre las aves sacrificadas el día 42 de edad (P>0,05). Los valores de %T en los pollos hipertensos de los grupos tratados con 30 y 10mg/kg de nifedipina fueron significativamente menores (P<0,05), comparados con los pollos hipertensos del grupo control. Es deseable que haya más estudios, para evaluar la viabilidad del uso de la nifedipina en pollos de engorde con HAP.
Palabras clave: Ascitis, avicultura, bloqueador de canales de calcio, índice de masa cardíaca, remodelación vascular.
SUMMARY
In hypoxic Pulmonary Arterial Hypertension (PAH), a disease affecting mammals and broiler chickens, there is an exaggerated increase of the intracellular calcium concentration and therefore vasoconstriction and engrossment of the vascular muscle layer. Nifedipine, a calcium channel's blocker is a vasodilator employed in PAH in humans. The effect of nifedipine on PAH incidence, cardiac mass index (CI) and the muscle middle layer thickness of arterioles (%T) with diameters from 50 to 100 micrometers (μM) in broilers was presently evaluated. Doses employed were: 6 and 2mg/kg of body weight between days 4 to 21 and 30 and 10mg/kg between days 22 to 42 of age, as related to a control group. A numerical dose dependent reduction in the mortality by PAH in medicated broilers was detected. CI values of birds dying spontaneously before day 42 of age, did not show statistical differences between treatments. The above mentioned finding also applied to animals slaughtered at day 42 (P>0.05). %T values in pulmonary hypertensive chickens treated with 30 and 10mg/kg of nifedipine, were significantly lower (P<0.05) when compared to pulmonary hypertensive chickens in the control group. It is desirable that more studies should be undertaken as to evaluate the viability of employing nifedipine in pulmonary hypertensive chickens.
Key words: Ascites, calcium channel's blocker, cardiac mass index, poultry, vascular remodeling.
INTRODUCCIÓN
Existe evidencia de la susceptibilidad dentro y entre las estirpes de pollos de engorde (Gallus gallus) a la Hipertensión Arterial Pulmonar (HAP) (Menocal et al. 2007; Druyan et al. 2007). Los individuos hiperreactivos pueden desarrollar esta enfermedad, debido a la exposición crónica a la hipoxia hipobárica, presente en las grandes alturas (Beker et al. 2003; Vásquez & Hernández, 2012) o a la exposición prolongada a bajas temperaturas (Pan et al. 2005; Yang et al. 2010), entre otras causas. La hipoxia hipobárica, en los capilares aéreos, está asociada con la presentación de vasoconstricción arterial pulmonar, el aumento en la resistencia al flujo de sangre en las arteriolas de diámetros menores de 300mm y el engrosamiento de la media muscular y de la adventicia en las arteriolas (Wideman, 2000). El incremento de la resistencia vascular pulmonar, produce un sobreesfuerzo del ventrículo cardiaco derecho, éstasis venosa, congestión pasiva generalizada y falla cardiaca. En mamíferos (Scotland et al. 2001) y en aves (Moreno de Sandino & Hernández, 2003; Álvarez-Medina et al. 2012), la HAP se caracteriza por la disminución de los niveles plasmáticos de sustancias vasodilatadoras e inhibidoras de la mitosis, como el Óxido Nítrico (NO) y el factor de hiperpolarización derivado del endotelio (EDHF), alteración propia de la disfunción endotelial. Adicionalmente, durante la HAP también existe un aumento de la presencia de vasoconstrictores y mitógenos de las células musculares lisas vasculares, como el Tromboxano A2 (TXA2), la serotonina (5-HT) (Chapman et al. 2008) y la Endotelina-1 (ET-1) (Gómez et al. 2007). Este desequilibrio en la síntesis de sustancias vasoactivas, se refleja en la presentación de vasoconstricción sostenida y cambios estructurales en la vasculatura pulmonar (Kourembanas et al. 1991; Gómez et al. 2007).
La hipoxia hipobárica crónica propicia la alteración del funcionamiento de los canales iónicos de Ca2+, lo que constituye el mayor desencadenante de la vasoconstricción arterial pulmonar y la subsecuente hiperplasia de las células musculares lisas vasculares pulmonares (Sommer et al. 2008). El aumento de la entrada de Ca2+, a través de los canales permeables a este ión o la movilización de Ca2+ desde los sitios de almacenamiento intracelular, como el retículo sarcoplásmico, generan el incremento en la concentración del Ca2+ libre citosólico [(Ca2+) ], responsable de la vasoconstricción. Los canales de Ca2+ operados por voltaje (VOCC) tipo L, localizados en la membrana de las células musculares lisas de la arteria pulmonar, constituyen el principal mecanismo para aumentar la [(Ca2+) ], durante la hipoxia (Olschewski et al. 2002). El papel fundamental del incremento de la [(Ca2+) ] en la fisiopatología de la HAP justifica la utilización de fármacos bloqueadores de canales de Ca2+ (BCC), como una alternativa útil en la terapéutica de dicha enfermedad (Huber et al. 2000). Entre estas sustancias, las dihidropiridinas (DHP) poseen mayor selectividad por las células musculares lisas vasculares que por las células del músculo cardíaco (Poelaert & Roosens, 2000). De las diferentes DHP, la nifedipina posee los mejores efectos sobre las células musculares lisas vasculares (Yamakage & Namiki, 2002) y sobre la disminución de la proliferación de este tipo de células (Hérembert et al. 1995). Estas características favorables argumentan el amplio uso de este fármaco en humanos, con resultados eficientes en el control de la HAP hipóxica y de otros orígenes (Antezana et al. 1998).
En la industria del pollo de engorde, la HAP genera cuantiosas pérdidas económicas (Maxwell & Robertson, 1997; Pavlidis et al. 2007; Urbaityte, 2008; Medeiros et al. 2012). La HAP en esta especie puede ocurrir en animales susceptibles, bajo condiciones naturales de hipoxia hipobárica y su fisiopatología es similar a la de los humanos, por lo que puede ser útil como modelo animal, en el estudio de la HAP (Martínez-Lemus et al. 1999; Wideman & Hamal, 2011). La generación de alternativas terapéuticas orientadas a interrumpir o moderar los procesos de vasoconstricción, de proliferación y de remodelación vascular, busca contribuir al control de la HAP en la industria del pollo de engorde, a la vez, que podría generar una mejor comprensión de su fisiopatología. En este trabajo de investigación, se empleó el BCC Nifedipina, con el propósito de evaluar su posible efecto sobre la incidencia de HAP hipóxica hipobárica en pollos de engorde y sobre la muscularización de las arteriolas pulmonares.
MATERIALES Y MÉTODOS
Teniendo en cuenta que la tasa de mortalidad asociada con HAP en pollos de engorde de la estirpe Cobb500, criados a una altura de 2.638msnm puede llegar a alcanzar el 40%, al día 42 de edad (Vásquez & Hernández, 2012); se consideró que el empleo de 100 aves por cada tratamiento, era suficiente para obtener la cantidad de muestras necesarias para el análisis morfométrico de las arteriolas pulmonares.
Animales: Se alojaron 300 pollos machos de la estirpe Cobb500 de un día de edad, bajo condiciones naturales de hipoxia hipobárica (Bogotá, Colombia, 2.638msnm, presión atmosférica media: 560,75mmHg y PO2: 117,6mmHg) (Jiménez et al. 1998). La temperatura dentro del galpón fue controlada durante todo el experimento de forma automática, con un sensor conectado a la unidad central de las criadoras eléctricas, así: días 1 a 6, con 32-33°C; días 7 a 13, con 29 a 30°C; días 14 a 20, con 27 a 28°C; días 21 a 27, con 24 a 26°C; días 28 a 34, con 21 a 23°C; días 35 a 41, con 19 a 21°C, siguiendo las recomendaciones de la Guía de manejo Cobb500 (2008). Los animales fueron recibidos en cama de viruta de madera nueva y previamente desinfectada. Se suministró agua de bebida potable ad libitum. Todos los animales recibieron el alimento concentrado comercial tipo Iniciación desde el día 1 hasta el 21 (Energía metabolizable (EM) 2900Kcal y proteína bruta (PB) 20%) y de finalización, a partir del día 22 hasta el 42 (EM 3000Kcal y PB 19%); para ambos tipos, se empleó la presentación de quebrantado, la cantidad de alimento suministrado fue el recomendado por la Guía de manejo Cobb500 (2008). Se utilizó una densidad de población 11,3 pollos por m2.
Tratamientos: Los pesajes de las aves se realizaron semanalmente. El día 1 de edad, se pesó la totalidad de las aves y se conformaron 12 grupos experimentales homogéneos, según el peso. Cada grupo quedó compuesto por 25 aves y fue ubicado en un cubículo experimental independiente. Para cada tratamiento, se asignaron cuatro grupos de forma aleatoria (100 pollos/tratamiento). Los tres tratamientos evaluados fueron los siguientes: Tratamiento 1: del día 4 a 21 de edad, se suministró, vía oral, nifedipina disuelta en agua destilada, en dosis diaria de 6mg/kg de peso y, a partir del día 22 hasta el 42, de 30mg/kg. Tratamiento 2: del día 4 al 21 nifedipina disuelta en agua destilada, en dosis diaria de 2mg/kg de peso y, a partir del día 22 hasta el 42, de 10mg/kg de peso. Tratamiento 3 (control): a los pollos de este tratamiento, se les suministró agua destilada solamente, a un volumen idéntico al de las soluciones de los dos tratamientos anteriores. En humanos, ha sido recomendado el uso de dosis más bajas de nifedipina en niños que en adultos (Palma-Aguirre et al. 1999), razón por la cual, en este experimento, se optó por el uso de una dosis menor, para las aves entre los días 4 a 21, que en aves comerciales, que corresponde al periodo de cría y levante. Las dosis, se ajustaron diariamente, según la tabla de peso de la estirpe (Guía de manejo Cobb500, 2008). Los tratamientos, se suministraron dos veces al día, por via oral e individualmente, a las 7:00 a.m. y 7:00 p.m.; para ello, se usó un inyector Socorex®, que proporcionó un volumen idéntico para cada ave. Debido a la naturaleza fotosensible de la nifedipina, durante el pesaje, la preparación y el suministro de ésta, se utilizó iluminación con reflectores de luz de sodio exclusivamente; el resto del tiempo se emplearon bombillos de luz día.
Evaluación de la mortalidad: Se registró la mortalidad ocurrida durante la fase experimental y se realizó la necropsia correspondiente a cada individuo, en la que se tuvo en cuenta la determinación del índice de masa cardíaca (IC). El IC es el resultado de dividir el peso del ventrículo derecho/peso ventricular total, todo esto multiplicado por 100 (Alexander & Jensen, 1959) y es una forma indirecta para determinar la ocurrencia de la HAP, debido a la alta correlación existente entre estas dos variables (Burton et al. 1968; Cueva et al. 1974; Hernández, 1979). Se considera sin HAP (PNHP) a aquellos animales, con un IC≤25 e hipertensos (PHP), con un IC≥26 (Vásquez & Hernández, 2012). Los animales que sobrevivieron hasta el final de la fase experimental fueron sacrificados, siguiendo las normas aprobadas por el comité de ética institucional y también se les realizó la necropsia y la posterior determinación del IC.
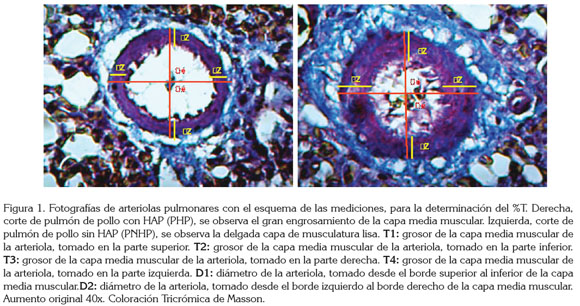
Muscularización arterial pulmonar: La hipertrofia de la capa media muscular es una de las lesiones predominantes, que caracterizan a la remodelación vascular y se ha encontrado que sucede, tanto en la HAP de los humanos como en la de algunos modelos animales (McLauglhin & McGoon, 2006). El promedio del grosor de la capa media muscular de las arteriolas pulmonares, se conoce también como %T, que se calcula mediante la fórmula %T=T/D x 100 (Tucker et al. 1975). El valor promedio de la capa media muscular (T) de una arteriola determinada, se obtiene a través de cuatro mediciones realizadas en los bordes superior, inferior y laterales de la capa media muscular de la correspondiente arteriola (T1+T2+T3+T4)/4 (Figura 1). D corresponde al promedio del diámetro del vaso sanguíneo y se calcula a partir de dos mediciones perpendiculares entre sí, en las que se excluye la capa adventicia del vaso sanguíneo, como se indica: una desde el borde superior al inferior y la segunda, uniendo los bordes laterales (D1+D2)/2 (Figura 1). Dado que la nifedipina puede tener un efecto sobre el tono de la capa media muscular o sobre el grado de muscularización (Roth et al. 1996), se evaluaron las posibles diferencias del valor del %T entre tratamientos, teniendo en cuenta, para ello, cierto grado de homogeneidad, según los agrupamientos por IC. Se seleccionaron de cada tratamiento 8 animales PNHP (IC≤23%) y otros 8 animales PHP (IC de 30 a 35%). Para el cálculo del %T, se sacrificó a la totalidad de los animales que sobrevivieron al día 42, a cada uno de ellos se les extrajeron el pulmón izquierdo, que se fijó en una solución de formalina bufferada al 10% (pH= 7,4) y el corazón, para el cálculo del IC. Para cada individuo, se seleccionaron aleatoriamente 10 arteriolas interparabronquiales, con diámetros externos entre 50 y 100μm, a las que les calculó el %T. Para el análisis histológico, se realizaron cortes sagitales y se utilizó la coloración tricrómica de Masson (Luna, 1968). Todas las mediciones se realizaron con un analizador de imágenes microcomputarizado (Image-Pro plus 7, Bethesda. MD. EEUU. 2010). Para la obtención de imágenes, se empleó un microscopio óptico.

Análisis Estadístico: Para los animales sacrificados al día 42, se compararon los valores obtenidos para el %T y el IC, entre tratamientos, utilizando un diseño completamente al azar y un análisis de varianza de una vía. Por otro lado, se compararon entre tratamientos los IC de los animales que murieron espontáneamente antes del día 42, empleando la misma metodología. Al encontrar diferencias significativas, se realizó la prueba de comparación múltiple LSD. Se consideró un valor de P<0,05 como significativo. Para el análisis estadístico, se empleó el software SAS 9.2.
RESULTADOS Y DISCUSIÓN
Todos los animales que murieron antes del día 42 presentaron valores de IC superiores a 25%, que junto con las lesiones macroscópicas observadas son compatibles con las reportadas para HAP (Machorro Velasco & Paasch-Martínez, 1985). La mayor mortalidad, se observó a la quinta semana de edad en cada tratamiento. La mortalidad obtenida fue: a) tratamiento 1 (nifedipina 6mg/kg, día 4 al 21 y 30mg/ kg, día 22 al 42): 39% (n=39); b) tratamiento 2 (nifedipina 2mg/kg, día 4 al 21 y 10mg/kg, día 22 al 42): 45% (n=45) y c) tratamiento 3 (control): 52% (n=52), es decir, que la medicación con nifedipina tuvo un efecto positivo sobre la prevención de la mortalidad, debida a HAP relacionada con la dosis de la misma. Al analizar los resultados de mortalidad por HAP en pollos de engorde, se debe tener en cuenta que no existe un patrón cronológico generalizado para el desarrollo de la HAP y, por el contrario, cada caso parece obedecer a las circunstancias particulares del individuo (Hernández & de Sandino, 2011). Adicionalmente, la incidencia varía dentro de la misma estirpe (Zhang et al. 2007; Areiza et al. 2011; Vásquez & Hernández, 2012).
El análisis de los valores de peso corporal que se registraron semanalmente no indicó diferencias significativas entre los tres tratamientos (datos no mostrados).
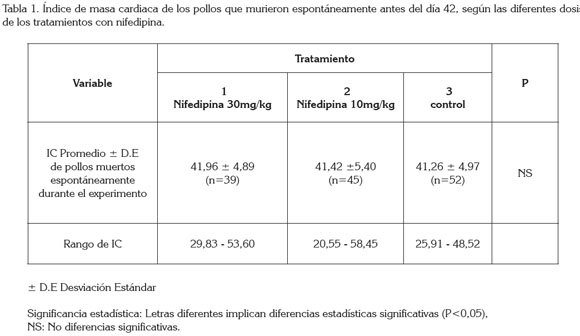
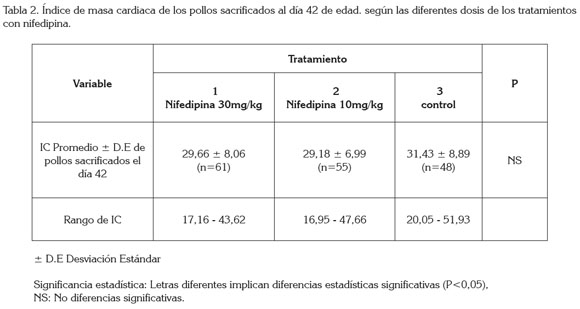
Al comparar entre grupos el IC de los pollos que murieron espontáneamente antes del día 42, no se encontraron diferencias estadísticamente significativas (P>0,05) (Tabla 1); tampoco, cuando se compararon los valores de IC de los pollos que se sacrificaron el día 42 (P>0,05) (Tabla 2). Lo anterior, no parece reflejar un efecto benéfico de la nifedipina sobre la capacidad de prevención de la hipertrofia cardiaca derecha; sin embargo, se pudo observar que si bien los resultados no fueron estadísticamente significativos, los valores más altos en el rango de IC (límite inferior y límite superior) de las aves sacrificadas, se presentaron en el grupo de pollos que no recibieron la nifedipina (Tabla 2). Es importante resaltar que no existen estudios que relacionen directamente el IC con el tiempo que el animal lleva presentando la HAP, por lo anterior, pueden existir pollos con duración breve de la enfermedad (15 a 17 días de edad) cuyo IC puede ser tan alto como el de aquellos animales, cuya evolución dura entre 36 y 41 días (Hernández & de Sandino, 2011; Areiza et al. 2011).
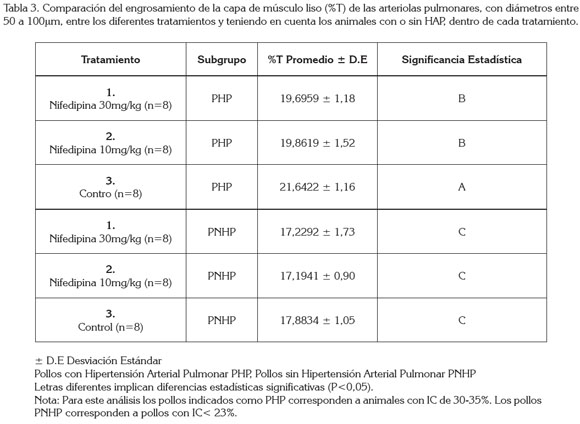
La evaluación de los resultados del %T de los PHP mostró diferencias significativas entre el tratamiento 1 y el 3 y entre el tratamiento 2 y el 3 (P<0,05). Pero no se encontraron diferencias al comparar los tratamientos 1 y 2 (P>0,05). Al comparar el %T entre los pollos PNHP, no se encontraron diferencias significativas entre los tres tratamientos (P>0,05) (Tabla 3).
Aunque en el presente estudio no se evidenció un efecto significativo en la disminución de los IC de los pollos bajo tratamiento con nifedipina (Tablas 1 y 2), como fue reportado por Sun et al. (2007), sí se pudo observar que los grupos que recibieron el medicamento presentaron una menor mortalidad. En contraposición, Paasch (1991), no encontró diferencia estadística significativa en la medición de la PAP, ni del IC entre los pollos tratados y los controles, cuando la medicación con nifedipina la realizó durante 20 días, a pollos de 6 semanas de edad, considerados con HAP. Yang et al. (2010) indujeron la HAP en pollos de engorde con bajas temperaturas y, adicional al análisis de la PAP, incluyeron el IC y el %T. La dosis empleada de nifedipina fue de 5mg/kg cada 12 horas, por vía oral, a partir del día 16 hasta el 43. La nifedipina previno el aumento de la PAP durante la fase inicial del estudio; sin embargo, no suprimió el desarrollo de HAP en la fase final y tampoco mantuvo el valor de la PAP, del IC ni del %T, en valores normales. Dado lo anterior, se podría plantear que la nifedipina tiene un mejor desempeño cuando se suministra desde muy temprana edad y con propósitos preventivos, para el control de la enfermedad en individuos predispuestos.
El valor más bajo del %T del grupo de PHP tratados con la dosis más elevada de la nifedipina, en el presente estudio, se podría atribuir a una reducción de la PAP, como ha sido postulado desde hace varias décadas y basado en el efecto vasodilatador e inhibidor de la vasoconstricción arterial pulmonar de origen hipóxico (Nelson et al. 1990). Un mecanismo por el que la nifedipina podría ejercer su función vasodilatadora es a través de la reducción de la producción de agentes vasoconstrictores y mitógenos, como el TXA2 (Alarayyed et al. 2002) y la ET-1 (Sudano et al. 2007). La nifedipina también reduce la síntesis de DNA y la proliferación de las células musculares lisas vasculares y modula el metabolismo del colágeno dentro de la matriz extracelular (Roth et al. 1996). Esto último, resulta ventajoso para el individuo, ya que, adicional a la mayor proliferación de células de músculo liso y de los fibroblastos vasculares, la mayor síntesis de colágeno en los vasos arteriales pulmonares está asociada con un alto IC (Hérembert et al. 1995). El mecanismo antiproliferativo de la nifedipina y otros BCC podría obedecer, además, a su actividad inhibitoria sobre varias moléculas, como el Factor de Crecimiento Derivado de las Plaquetas (PDGF), la Angiotensina II (Ang II), el Factor de Crecimiento básico de los Fibroblastos (bFGF) y el Factor de Crecimiento Epidermal (EGF) (Kataoka et al. 1997; Stepien et al. 1998; Soe et al. 2009). Otro aspecto fundamental, se debe a que algunos factores de crecimiento dependen de la entrada del Ca2+ extracelular y esto, a su vez, está relacionado con el antagonismo de estos bloqueadores a la apertura de los VOCC y con la inhibición de la liberación del Ca2+ intracelular, por acción directa de la producción continua de fosfatidilinositol y sobre algunas proteínas quinasas (PKC) (Kataoka et al. 1997) y del mRNA del factor de crecimiento transformante β (TGF-β) (Kim et al. 1995; Jeffery & Wanstall, 2001). En los pollos afectados con HAP, al igual que en los mamíferos, ocurre una sobreexpresión de algunas PKC. La activación de la PKCα favorece la remodelación vascular pulmonar. Este mecanismo implica el incremento de la [(Ca2+) ], que promueve la proliferación de las células musculares lisas de la arteria pulmonar y los fibroblastos de la adventicia (Barman, 2001; Tan et al. 2005).
El engrosamiento de la capa muscular de arteriolas pulmonares es mayor en los PHP respecto a los PNHP (Enkvetchakul et al. 1995; Tan et al. 2005; Moreno de Sandino & Hernández, 2006), lo cual, coincide con lo hallado en el presente trabajo. A su vez, la remodelación vascular pulmonar comprende cambios estructurales, que incluyen la extensión distal del músculo liso en vasos, previamente no muscularizados, característico de la HAP hipóxica y el engrosamiento medial y de la adventicia de los vasos musculares y elásticos. Dicho engrosamiento medial, se atribuye a la hipertrofia e hiperplasia de las células musculares lisas vasculares, así como al incremento de la deposición de proteínas de la matriz extracelular (Stenmark et al. 2006).
Las sustancias farmacológicas, como los BCC, tipo nifedipina, han sido ampliamente estudiados en el tratamiento de la HAP y, con ellas, se obtuvieron resultados satisfactorios, en cuanto a la reducción de la PAP y de la resistencia vascular pulmonar (Antezana et al. 1998); sin embargo, una nueva generación de estudios se ha centrado sobre la posible utilización de otros tratamientos farmacológicos específicos con capacidad vasodilatadora y de bloqueo de la proliferación de músculo liso. Dentro de los más relevantes e investigados, se encuentran los antagonistas de los receptores de ET-1, los inhibidores de la fosfodiesterasa tipo 5 (Sakao et al. 2012; Schwartz et al. 2013) y los prostanoides (Zhang et al. 2012).
En el presente trabajo, se encontró un efecto significativo de la nifedipina sobre el mejoramiento del %T de los PHP y en la reducción de la mortalidad en pollos de engorde, sometidos a hipoxia hipobárica crónica; sin embargo, no se evidenció una reducción significativa del IC asociado con su suministro. Ante los resultados obtenidos, cabe revaluar si la nifedipina constituye una alternativa viable para la prevención de la HAP en pollos de engorde o si son necesarias dosis más elevadas del fármaco, con el fin de encontrar un efecto benéfico contundente. En este último caso, sería necesario evaluar la posible toxicidad del fármaco y estimar la relación costo: beneficio para su utilización.
Agradecimientos: A Farmacápsulas S.A. e Incubacol S.A., por la donación de la nifedipina y los pollos, respectivamente. Al Doctor Rafael Areiza, por su ayuda con la revisión de la versión final del presente artículo. Financiación: A la Fundación para la Promoción de la Investigación y la Tecnología del Banco de la República y la División Investigación Bogotá (DIB) de la Universidad Nacional de Colombia. Conflicto de intereses: Los autores declaramos que no existe ningún conflicto de intereses, que ponga en riesgo la validez de los resultados presentados.
BIBLIOGRAFÍA
1. ALARAYYED, N.A.; PRICHARD, B.N.C.; BETTERIDGE, D.J.; SMITH, C.C.T. 2002. Differential actions of naftopidil, doxazosin and nifedipine on platelet thromboxane generation and platelet-derived growth factor efflux in vitro. Platelets. (UK). 13(5- 6):267-271.
2. ALEXANDER, A.F.; JENSEN, R. 1959. Gross cardiac changes in cattle with high mountain disease and in experimental cattle maintained at high altitudes. Am. J. Vet. Res. (USA). 20(10):680-689.
3. ÁLVAREZ-MEDINA, D.I.; HERNÁNDEZ, A.; OROZCO, C. 2012. Endothelial hyperpolarizing factor increases acetylcholine-induced vasodilatation in pulmonary hypertensive broilers arterial rings. Res. Vet. Sci. (England). 92(1):1-6.
4. ANTEZANA, A.M.; ANTEZANA, G.; APARICIO, O.; NORIEGA, I.; VELARDE, F.L.; RICHALET, J.P. 1998. Pulmonary hypertension in high-altitude chronic hypoxia: response to nifedipine. Eur. Respir. J. (UK). 12:1181-1185.
5. AREIZA, R.A.; RIVAS, P.C.; HERNÁNDEZ, A. 2011. A Quantitative study of the pulmonary vascular bed and pulmonary weight: Body weight ratio in chickens exposed to relative normoxia and chronic hypobaric hypoxia. J. Poult. Sci. (Japan). 48(4):267-274.
6. BARMAN, S.A. 2001. Effect of protein kinase C inhibition on hypoxic pulmonary vasoconstriction. Am. J. Physiol. Lung. Cell. Mol. Physiol. (USA). 280:L888- 895.
7. BEKER, A.; VANHOOSER, S.L.; SWARTZLANDER, J.H.; TEETER, R.G. 2003. Graded atmospheric oxygen level effects on performance and ascites incidence in broilers. Poult. Sci. (USA). 82:1550-1553.
8. BURTON, R.R.; BESCH, E.L.; SMITH, A.H. 1968. Effect of chronic hypoxia in the pulmonary arterial blood pressure of the chicken. Am. J. Physiol. (USA). 214(6):1438-1442.
9. CHAPMAN, M.E.; TAYLOR, R.L.; WIDEMAN, Jr. R.F. 2008. Analysis of plasma serotonin levels and hemodynamic responses following chronic serotonin infusion in broilers challenged with bacterial lipopolysaccharide and micropartcles. Poult. Sci. 87(1):116-124.
10. CUEVA, S.; SILLAU, H.; VALENZUELA, A.; PLOOG, H. 1974. High altitude induced pulmonary hypertension and Heart failure in broiler chickens. Res. Vet. Sci. 16:370-374.
11. DRUYAN, S.; BEN-DAVID, A.; CAHANER, A. 2007. Development of ascites-resistant and ascites- susceptible broiler lines. Poult. Sci. 86:811-822.
12. ENKVETCHAKUL, B.; BEASLEY, J.; BOTTJE, W. 1995. Pulmonary arteriole hypertrophy in broilers with pulmonary hypertension syndrome (ascites). Poult. Sci. 74:1676-1682.
13. GÓMEZ, A.P.; MORENO, M.J.; IGLESIAS, A.; CORAL, P.X.; HERNÁNDEZ, A. 2007. Endothelin 1, its endothelin type A receptor, connective tissue growth factor, platelet-derived growth factor, and adrenomedullin expression in lungs of pulmonary hypertensive and nonhypertensive chickens. Poult. Sci. 86:909-916.
14. Guía del manejo del pollo de engorde. Cobb500. 2008. Disponible desde internet en: http:// www.cobb-vantress.com/contactus/brochures/ BroilerGuideSPAN.pdf (con acceso el 17/02/2012).
15. HÉREMBERT, T.; ZHU, D-L.; MARCHE, P. 1995. Mechanism of action of the inhibitory effect of nifedipine on the growth of cultured aortic cells from spontaneously hypertensive and normotensive rats. Br. J. Pharmacol. 114:1703-1709.
16. HERNÁNDEZ, A. 1979. Comprobación de un síndrome ascítico de origen hipóxico (un tipo de edema aviar) en Bogotá. Rev. ACOVEZ. 3(11):52-54.
17. HERNÁNDEZ, A.; DE SANDINO, M. 2011. Hypoxic pulmonary hypertension in the chicken model. In: Sulica, R.; Preston, I. (eds). Pulmonary Hypertension - From Bench Research to Clinical Challenges. Ed. In Tech. (Croatia). p.111-150.
18. HUBER, I.; WAPPL, E.; HERZOG, A.; MITTERDORFER, J.; GLOSSMANN, H.; LANGER, T.; STRIESSNIG, J. 2000. Conserved Ca2+ antagonist-binding properties and putative folding structure of a recombinant high- affinity dihydropyridines-binding domain. Biochem. J. (UK). 347:829-836.
19. JEFFERY, T.K.; WANSTALL, J.C. 2001. Pulmonary vascular remodeling: a target for therapeutic intervention in pulmonary hypertension. Pharmacol. (Switzerland). 92:1-20.
20. JIMÉNEZ, E.; LOZANO, C.; HERNÁNDEZ, A.; FLÓREZ, H.; PULIDO, M. 1998. Presión parcial de oxígeno, pH, hematocrito, hemoglobina e índice cardíaco en pollos de engorde a 2600 metros sobre el nivel del mar. Arch. Med. Vet. (Chile). 30(1):67-74.
21. KATAOKA, S.; ALAM, R.; DASH, P.K.; YATSU, F.M. 1997. Inhibition of PDGF-mediated proliferation of vascular smooth muscle cells by calcium antagonists. Stroke. (USA). 28:364-369.
22. KIM, S.; OHTA, K.; HAMAGUCHI, A.; MIURA, K.; YUKIMURA, T.; IWAO, H. 1995. Suppression of vascular transforming growth factor-b1 and extracellular matrix gene expressions by cilazapril and nifedipine in hypertensive rats. Clin. Exp. Pharmacol. Physiol. (Australia). (Suppl. 1):S355-S356.
23. KOUREMBANAS, S.; MARSDEN, P.A.; McQUILLAN, L.P.; FALLER, D.V. 1991. Hypoxia induces endothelin gene expression and secretion in cultured human endothelium. J. Clin. Invest. (USA). 88:1054-1057.
24. LUNA, L.G. 1968. Routine staining procedures. Manual of histologic Staining Methods. 3rd ed. McGraw- Hills Book Co. New York. p.38.
25. MACHORRO VELASCO, E.; PAASCH-MARTÍNEZ, L. 1985. Evaluación del efecto de la hipertensión pulmonar en la presentación del síndrome ascítico en México. Vet. Mex. 16:15-19.
26. MARTÍNEZ-LEMUS, L.A.; HESTER, R.K.; BECKER, E.J.; JEFFREY, J.S.; ODOM, T.W. 1999. Pulmonary artery endothelium-dependent vasodilation is impaired in a chicken model of pulmonary hypertension. Am. J. Physiol. Regulatory. Integrative. Comp. Physiol. (USA). 277:R190-R197.
27. MAXWELL, M.H.; ROBERTSON, G.W. 1997. World broiler ascites survey 1996. Poultry Int. (USA). 4:16-30.
28. MCLAUGLHIN, V.V.; MCGOON, M.D. 2006. Pulmonary arterial hypertension. Circulation. (USA). 114:1417- 1431.
29. MEDEIROS, F.; DE AZEVEDO, P.; MOLETA, E.; DE VARGAS, J.G.; VIANNA, R.; GARCIA, J. 2012. Ocorrência de ascite em produção de frangos de corte no estado de Mato Grosso. Anuário 2013 da Avicultura Industrial. (BRASIL). (11):124-130.
30. MENOCAL, J.A.; ÁVILA, E.; LÓPEZ, C.; GÓNZALEZ, R.O. 2007. Estirpe y temperatura ambiental en la incidencia del síndrome ascítico en el pollo de engorda. Rev. Cub. Cien. Agr. 41(3):259-262.
31. MORENO DE SANDINO, M.; HERNÁNDEZ, A. 2003. Nitric oxide synthase expression in the endothelium of pulmonary arterioles in normal and pulmonary hypertensive chickens subjected to chronic hypobaric hypoxia. Avian. Dis. (USA). 47(4):1291- 1297.
32. MORENO DE SANDINO, M.; HERNÁNDEZ. A. 2006. Pulmonary arteriole remodeling in hypoxic broilers expressing different amounts of endothelial nitric oxide synthase. Poult. Sci. 85:899-901.
33. NELSON, M.T.; PATLAK, J.B.; WORLEY, J.F.; STANDEN, N.B. 1990. Calcium channels, potassium channels, and voltage dependence of arterial smooth muscle tone. Am. J. Physiol. 259:3-18.
34. OLSCHEWSKI, A.; HONG, Z.; NELSON, D.P.; WEIR, E.K. 2002. Graded response of K+ current, membrane potential, and [Ca2+]i to hypoxia in pulmonary arterial smooth muscle. Am. J. Physiol.283:L1143-L1150.
35. PAASCH, L. 1991. Desarrollo de algunas investigaciones sobre el síndrome ascítico en México. Ciencia Vet. 5:1-11.
36. PALMA-AGUIRRE, J.A.; CASTAÑEDA-HERNÁNDEZ, G.; CHÁVEZ-NEGRETE, A.; PONCE-MONTER, H. 1999. Nifedipina. Farmacocinética e indicaciones terapéuticas. Rev. Med. IMSS. (México). 37:47-58.
37. PAN, J.Q.; TAN, X.; LI, J.C.; SUN, W.D.; WANG, X.L. 2005. Effect of early feed restriction and cold temperature on lipid peroxidation, pulmonary vascular remodeling and ascites morbidity in broilers under normal and cold temperature. Br. Poult. Sci. 46:374-381.
38. PAVLIDIS, H.O.; BALOG, J.M.; STAMPS, L.K.; HUGHES Jr, J.D.; HUFF, W.E.; ANTHONY, N.B. 2007. Divergent selection for ascites incidence in chickens. Poult. Sci. 86:2517-2529.
39. POELAERT, J.; ROOSENS, C. 2000. Periopertive use of dihydropyridine calcium channel blockers. Acta Anaesthesiol Scand. 44:528-535.
40. ROTH, M.; EICKELBERG, O.; KÖHLER, E.; ERNE, P.; BLOCK, L.H. 1996. Ca2+ channel blockers modulate metabolism of collagens within the extracellular matrix. Proc. Nal. Acad. Sci. U. S. A. 93:5478-5482.
41. SAKAO, S.; TANABE, N.; KASAHARA, Y.; TATSUMI, K. 2012. Survival of japanese patients with pulmonary arterial hypertension after the introduction of endothelin receptor antagonists and/or phosphodiesterase type-5 inhibitors. Intern. Med. (Japan). 51:2721-2726.
42. SCHWARTZ, B.G.; JACKSON, G.; STECHER, V.J.; CAMPOLI-RICHARDS, D.M.; KLONER, R.A. 2013. Phosphodiesterase type 5 inhibitors improve endothelial function and may benefit cardiovascular conditions. Am. J. Med. (USA). 126(3):192-199.
43. SCOTLAND, R.S.; CHAUHAN, S.; VALLANCE, P.J.; AHLUWALIA, A. 2001. An endothelium derived hyperpolarizing factor-like factor moderates myogenic constriction of mesenteric resistance arteries in the absence of endothelial nitric oxide synthase-derived nitric oxide. Hypertension. (USA). 38:833-839.
44. SOE, N.N.; ISHIDA, T.; ISHIDA, M.; SAWANO, M.; ABE, K.; MIHO, N.; CHAYAMA, K.; KIHARA, Y.; YOSHIZUMI, M. 2009. Nifedipine interferes with migration of vascular smooth muscle cells via inhibition of Pyk2-src axis. J. Atheroscl. Thromb. (Japan). 16(3):230-238.
45. SOMMER, N.; DIETRICH, A.; SCHERMULY, R.T.; GHOFRANI, H.A.; GUDERMANN, T.; SCHULZ, R.; SEEGER, W.; GRIMMINGER, F.; WEISSMAN, N. 2008. Regulation of hypoxic pulmonary vasoconstriction: Basic mechanisms. Eur. Respir. J. 32(6):1639-1651.
46. STENMARK, K.R.; DAVIE, N.; FRID, M.; GERASIMOVSKAYA, E.; DAS, M. 2006. Role of the adventitia in pulmonary vascular remodeling. Physiology. (Bethesda). (USA). 21:134-145.
47. STEPIEN, O.; GOSUSEV, J.; ZHU, D.; IOUZALEN, L.; HEREMBERT, T.; DRUEKE, T.B.; MARCHE, P. 1998. Amlodipine inhibition of serum-, thrombin- or fibroblast growth factor-induced vascular smooth muscle cell proliferation. J. Cardiov. Pharmacol. (USA). 31:786-793.
48. SUDANO, I.; VIRDIS, A.; TADDEI, S.; SPIEKER, L.; CORTI, R.; NOLL, G.; SALVETTI, A.; LUSCHER, T.F. 2007. Chronic treatment with long-acting nifedipine reduces vasoconstriction to endothelin-1 in essential hypertension. Hypertension. (USA). 49:285-290.
49. SUN, M.; ZHANG, J.; DONG, S.; OU, D.; QIAO, J. 2007. Effect of Two Calcium Antagonists on PHS in Broiler. J. Anhui Agr. Sci. (China). (11): 3274-3275.
50. TAN, X.; LIU, Y-J.; LI, J-CH.; PAN, J-Q.; SUN, W-D.; WANG, X-L. 2005. Activation of PKC and pulmonary vascular remodeling in broilers. Res. Vet. Sci. 79(2):131-137.
51. TUCKER, A.; MCMURTY, I.F.; REEVES, J.T.; ALEXANDER, A.F.; WILL, D.H.; GROVER, R.F. 1975. Lung vascular smooth muscle as a determinant of pulmonary hypertension at high altitude. Am. J. Physiol. 228:762-767.
52. URBAITYTE, R. 2008. Como mitigar la ascitis en las parvadas de pollo de engorda. Industria Avícola. (USA). 55 (12):18-19.
53. VÁSQUEZ, I.C.; HERNÁNDEZ, A. 2012. Hipertensión pulmonar en pollos, lapso de exposición a la hipoxia hipobárica y relación peso pulmonar: peso corporal, bajo condiciones de temperatura controlada. Rev. Col. Cienc. Pec. 25:81-89.
54. WIDEMAN, R.F. 2000. Cardio-pulmonary hemodynamics and ascites in broiler chickens. Avian Poultry. Biol. Rev. (UK). 11(1):21-43.
55. WIDEMAN, R.F., HAMAL, K.R. 2011. Idiopathic Pulmonary Arterial Hypertension. An Avian Model for Plexogenic Arteriopathy and Serotonergic Vasoconstriction. J. Pharmacol. Toxicol. Methods. (UK). 63:283-295.
56. YAMAKAGE, M.; NAMIKI, A. 2002. Calcium channels- basic aspects of their structure, function and gene encoding; anesthetic action on the channels- a review. Can. J. Anesth. (Canada). 49:151-164.
57. YANG, Y.; GAO, M.; GUO, Y.; QIAO, J. 2010. Calcium antagonists, diltiazem and nifedipine, protect broilers against low temperature-induced pulmonary hypertension and pulmonary vascular remodeling. Anim. Sci. J. (Japan). 81(4):494-500.
58. ZHANG, H.; WU, C.X.; CHAMBA, Y.; LING, Y. 2007. Blood characteristics for high altitude adaptation in Tibetan chickens. Poult. Sci. 86:1384-1389.
59. ZHANG, H-L.; LIU, Z-H.; WANG, Y.; XIONG, CH-M.; NI, X-H.; HE, J-G.; LUO, Q.; ZHAO, Z-H.; ZHAO, Q.; SUN, X-G. 2012. Acute responses to inhalation of iloprost in patients with pulmonary hypertension. Chin. Med. J. 125(16):2826-2831.
Recibido: Enero 16 de 2012 Aceptado: Julio 30 de 2013

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.