
CIENCIAS AGRARIAS-Artículo de Revisión
INFECCIONES ZOONÓTICAS CAUSADAS POR LEVADURAS DEL GÉNERO Malassezia: UNA REVISIÓN
ZOONOTIC INFECTIONS CAUSED BYMalassezia YEASTS: A REVIEW
Juan C. Galvis Marín1, Fernando Borda Rojas2
1MD, Esp, M.Sc, profesor Microbiología e Inmunología, Grupo de Investigación GIBGA, Facultad de Medicina. Universidad de Ciencias Aplicadas y Ambientales U.D.C.A, Bogotá D.C., Colombia, e-mail juan.cgalvis@udca.edu.co
2 MV, Esp, Ph.D. (c), profesor Medicina Interna de Pequeños Animales, Grupo de Investigación Ciencia Animal, Facultad de Ciencias Pecuarias. Universidad de Ciencias Aplicadas y Ambientales U.D.C.A, Bogotá D.C., Colombia, e-mail fborda@udca.edu.coRev. U.D.C.A Act. & Div. Cient. 19(2): 381-393, Julio-Diciembre, 2016
RESUMEN
Las zoonosis son enfermedades que se transmiten de forma natural entre los animales vertebrados y el hombre. Existe un gran número de enfermedades bacterianas, virales y parasitarias, que son transmitidas de los animales a los humanos, mientras que pocas micosis son consideradas, actualmente, como zoonosis. Las micosis zoonóticas son más frecuentes en individuos inmunocomprometidos, incluyendo pacientes hospitalizados, en los cuales, Malassezia pachydermatis, una levadura zoofílica, aparece como un microorganismo importante, en la etiología de micosis nosocomiales. En esta revisión, se mencionan las publicaciones que han reportado la presencia de M pachydermatis en humanos, a través del tiempo, con especial énfasis, en infecciones sistémicas en población de riesgo, a partir de caninos y personal de la salud, colonizados por esta levadura. Asimismo, se recopilan estudios en los que se han aislado en animales, especies antropofílicas del género Malassezia, para contribuir al conocimiento de la ecología y posible mecanismo de transmisión zoonótica, de este microorganismo.
Palabras clave: Micosis, infecciones, humanos, animales, transmisión.
SUMMARY
Zoonoses are diseases transmitted naturally between vertebrate animals and man. There are a number of bacterial, viral and parasitic diseases that are transmitted from animals to humans, while few mycosis are currently considered as zoonoses. Zoonotic fungal infections are more common in immunocompromised individuals, including inpatient, in which Malassezia pachydermatis, a zoophilic yeast, appears as an important microorganism in the etiology of nosocomial fungal infections. In this review, we mentioned the publications had reported the presence of M pachydermatis in humans over time, with special emphasis on systemic infections in populations at risk from dogs and health care workers colonized by this yeast. Studies in which animals have been isolated anthropophilic species of Malassezia are also mentioned, to contribute to the knowledge of ecology and possible mechanism of zoonotic transmission of this organism.
Keywords:Mycosis,infections,humans,animals,transmission.
INTRODUCCIÓN
Según la Organización Mundial de la Salud, una zoonosis se entiende como una enfermedad que se transmite de forma natural entre los animales vertebrados y el hombre (World Health Organization, 1967; Hubálek, 2003). En la sociedad existe una importante interacción entre humanos y diversos grupos de animales de compañía. Estas asociaciones no están libres de riesgos a los propietarios de mascotas, particularmente, enfermedades infecciosas (Pacheco, 2003). Existe un gran número de enfermedades bacterianas, virales y parasitarias, que son transmitidas de los animales a los seres humanos, mientras que pocas micosis son consideradas, actualmente, como zoonosis. Los múltiples mecanismos de transmisión, incluyen, contacto directo, arañazo, mordedura, inhalación, contacto con orina o heces, ingestión de carne, derivados lácteos y huevos y contacto con huéspedes artrópodos intermediarios. Muchas enfermedades emergentes y reemergentes son consideradas zoonosis, contempladas, las infecciones por hantavirus y la mayoría de fiebres hemorrágicas virales. Inclusive, el virus de la inmunodeficiencia humana (VIH), probablemente, se originó y evolucionó a partir de primates inferiores (Marcus & Marcus, 1998).
Es bien conocida la asociación entre las excreciones de aves y la criptococosis, de acuerdo con Castellá et al. (2008); los casos de esporotricosis transmitidos por gatos, según el reporte de Peralam et al. (2009) y las dermatofitosis o tiñas, asociadas con especies de dermatofitos zoonóticos, de acuerdo con lo reportado por Nenoff et al. (2012). Algunas micosis con potencial zoonótico han recibido menos atención, entre las que están las infecciones causadas por Penicillium marneffei, Lacazia loboi, Emmonsia spp., Basidiobolus ranarum, Conidiobolus spp. y Paracoccidioides brasiliensis (Seyedmousavi et al 2015); sin embargo, la participación de los animales en la epidemiología de las principales micosis humanas todavía no es bien conocida y los nichos ecológicos definitivos de los agentes fúngicos respectivos no han sido completamente determinados (Cabañes, 2008). Las micosis zoonóticas son más frecuentes en individuos inmunocomprometidos (Mani et al 2009), principalmente, en pacientes hospitalizados, en los cuales, Malassezia pachydermatis aparece como un microorganismo importante en la etiología de micosis nosocomiales, sea su fuente caninos que visitan hospitales (Lefebvre et al 2006) o el personal de la salud, que poseen perros, como animales de compañía (Marcus & Marcus, 1998).
El género Malassezia comprende levaduras lipofílicas, lípidodependientes y no lípido-dependientes (Figura 1), comensales de la piel de humanos y de animales, que se pueden llegar a convertir en patógenos, cuando hay factores predisponentes, como cambios en el microambiente cutáneo o alteración de los mecanismos de defensa del hospedero (Cafarchia et al 2011a; Gaitanis et al 2012; Arendrup et al 2014). En humanos, las especies más frecuentes son M furfur, M globosa, M sympodialis y M slooffiae, que tienen la capacidad de producir cuadros dermatológicos, como pitiriasis versicolor, dermatitis seborreica, dermatitis atópica y psoriasis, por lo que se consideran antropofílicas; sin embargo, se han reportado en animales domésticos (Bond et al 2010).

De otra parte, M pachydermatis ha sido la especie más aislada de piel y mucosas de mamíferos y aves, por lo que se considera una especie zoofílica; no obstante, esta especie ha sido reportada, ocasionalmente, en infecciones humanas, potencialmente graves, en individuos con factores de riesgo asociados (Guillot & Bond, 1999; Chitty & Hendricks, 2007; Ferreira et al 2008; Mani & Maguire, 2009; Bond, 2010; Prohic et al 2016).
Aún no es completamente clara la transmisión de este hongo desde animales domésticos a sus propietarios y viceversa, ya que son muy pocos los estudios que han evaluado su potencial zoonótico (Guillot et al 1997; Chang et al 1998; Morris et al 2005; Fan et al 2006), ninguno de ellos realizado en Colombia y dado que no existen revisiones actualizadas de infecciones humanas causadas por M pachydermatis y por especies lípido-dependientes en animales, el objetivo de la presente revisión fue recopilar el conocimiento concerniente a reportes y publicaciones de especies zoofílicas, en humanos y antropofílicas, en animales, para contribuir al entendimiento de la epidemiología y la ecología de las levaduras del género Malassezia
MATERIALES Y MÉTODOS
Se realizó una revisión de la literatura disponible en las bases de datos Scopus, ScienceDirect, PubMed, Medline, Scielo y Google Académico, en las que se utilizaron las palabras clave: micosis, infecciones, humanos, animales, transmisión. Se buscaron las publicaciones en el periodo de tiempo comprendido desde el primer reporte encontrado, en 1971 hasta el 2016; se incluyeron artículos de revisión, reportes de caso y estudios experimentales, publicados en idioma español e inglés.
RESULTADOS Y DISCUSIÓN
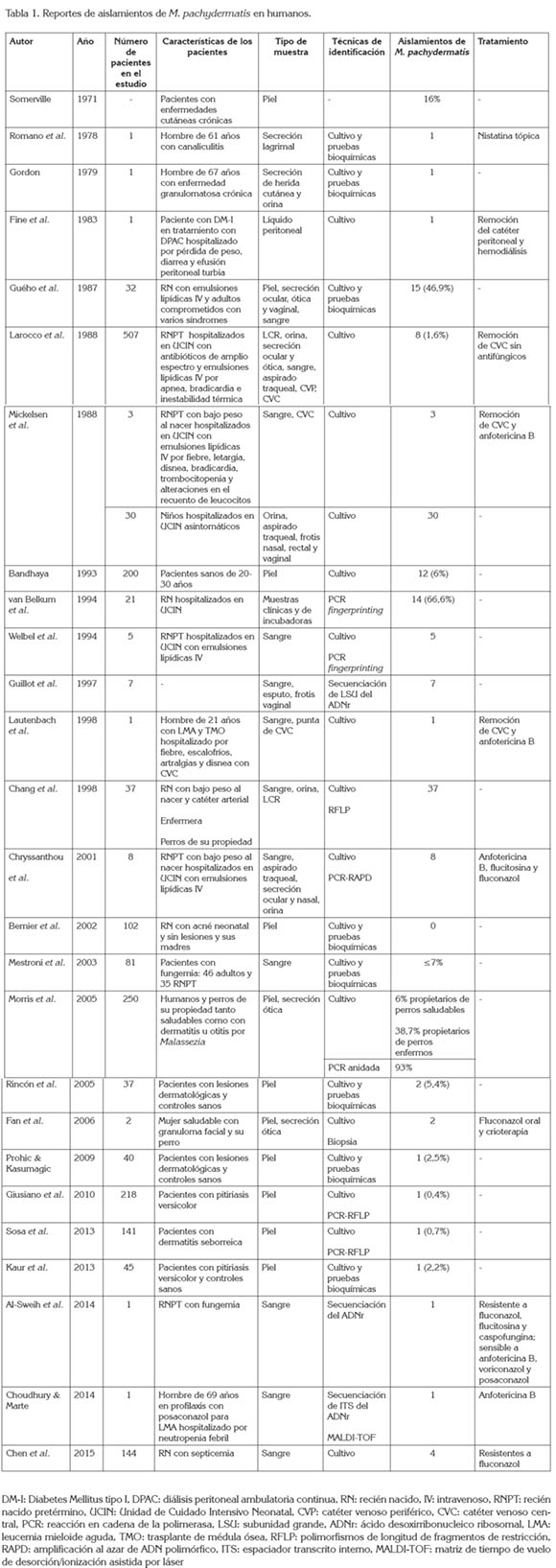
Primeros reportes de M pachydermatis en humanos y su posible origen nosocomial: Las primeras publicaciones acerca de la presencia de M pachydermatis en humanos datan de la década del 70: aislada de piel, secreción lagrimal y secreción de herida cutánea, en pacientes con enfermedades cutáneas crónicas o condiciones de inmunodeficiencia, pero sin las condiciones que más adelante se identificaron como factores de riesgo para infección sistémica (Somerville, 1971; Romano et al 1978; Gordon, 1979); sin embargo, estos hallazgos no fueron confirmados por otros investigadores, quienes concluyeron que, en la mayoría de los casos, la presencia de M pachydermatis en piel humana era rara y transitoria (Bandhaya, 1993).
El primer reporte de infección sistémica en humanos por M pachydermatis fue publicado en la década del 80, en un caso de peritonitis, en un paciente diabético hospitalizado para tratamiento de su falla renal con diálisis peritoneal ambulatoria continua (Fine et al 1983), pero no se especula acerca del origen de la levadura. Existen varios reportes de fungemia asociada a M pachydermatis en niños pretérmino, en Unidades de Cuidado Intensivo Neonatal (UCIN), recibiendo emulsiones lipídicas IV y, en adultos, con enfermedades subyacentes graves, como neoplasias hematológicas y trasplantes de médula ósea (Guého et al 1987; Larocco et al 1988; Mickelsen et al 1988; van Belkum et al 1994; Welbel et al 1994; Lautenbach et al 1998; Chang et al1998; Chryssanthou et al 2001). En ese entonces, los casos de sepsis neonatal por Malassezia sp., relacionada con catéteres, había sido ocasionada por la especie antropofílica M furfur, una causa relativamente poco común, comparada con otras levaduras, como Candida spp. (Marcon & Powell, 1992; Mestroni et al 2003). Durante este periodo, la epidemiología de M pachydermatis con infecciones sistémicas en humanos era misteriosa, debido a que el hombre se consideraba como un portador raro de esta especie zoofílica. También, era poco claro, si esta especie fue albergada por un número significativo de pacientes o si algunos individuos eran simples reservorios para asociaciones comensales o infecciosas, entre mascotas y humanos predispuestos (Guého et al 1987).
Es imposible determinar si la mayoría de los aislamientos mencionados fueron causa de la infección e, incluso, de la muerte de algunos de estos pacientes, pues en la mayoría de estudios no incluyen descripciones clínicas o no se realizaron autopsias y sugieren que M pachydermatis puede colonizar varios sitios anatómicos en pacientes hospitalizados, particularmente, en UCIN (Larocco et al 1988; Marcon & Powell,
1992; Lautenbach et al 1998). Para este momento, parecía que el factor predisponente más importante para infección sistémica por M pachydermatis era el mismo, que para el caso de fungemia por M furfur; la nutrición parenteral, rica en lípidos en pacientes inmunocomprometidos, debido a la lipofilia que comparten todas las especies dentro del género y su comportamiento oportunista (Gaitanis et al 2012).
Posteriormente, con el advenimiento de las pruebas de biología molecular y la tipificación genética de aislamientos clínicos, claramente se demostró la naturaleza nosocomial de las epidemias causadas por M pachydermatis, en las UCIN. Todos los aislamientos recuperados, tanto de los pacientes como de las superficies de las incubadoras, fueron genéticamente comparables. Incluso, a pesar de la limpieza regular de las incubadoras, las levaduras persistieron en las superficies de vidrio, al menos por tres meses. Por lo tanto, fueron implementadas medidas meticulosas de higiene personal en los médicos y demás personal de la salud, que manipulaban los neonatos, así como modificaciones en los procedimientos de limpieza (van Belkum et al 1994).
Los datos de estos estudios muestran que M pachydermatis puede causar brotes de fungemia nosocomial; que los recién nacidos pretérmino, recibiendo nutrición parenteral de lípidos, podrían estar en un riesgo mayor y que la transmisión es más probable de persona a persona, vía las manos del personal médico (Welbel et al 1994). En estudios posteriores, se generaron perfiles genéticos idénticos, entre las cepas de M pachydermatis -aisladas de neonatos en UCI-y fue admitida una transferencia exógena de esta levadura (Chryssanthou et al 2001), lo cual, apoya la idea que esta especie no hace parte de la microbiota humana y que la diseminación nosocomial del personal de la salud a los pacientes se ve favorecida, por técnicas inadecuadas de asepsia y antisepsia de superficies y el incorrecto lavado de manos.
Algunas evidencias de zoonosis por M pachydermatis: Los primeros estudios que sugieren la transmisión zoonótica de M pachydermatis datan de finales del siglo XX (Guillot et al
1997), en el que, por medio de pruebas moleculares, clasificaron aislamientos recuperados de humanos en el secuevar, donde se encuentran las secuencias tipo más frecuentes de cepas aisladas, a partir de perros, lo que sugiere el origen animal de las infecciones humanas, producidas por esta especie.
Posteriormente, se especuló la asociación zoonótica de mascotas con infecciones neonatales por M pachydermatis, en un brote descrito en una UCIN, cuyo origen, al parecer, fueron las manos del personal de la salud después de haber sido colonizados por los perros de su propiedad en casa. El mecanismo de introducción y de reservorio de M pachydermatis fue trazado por tipificación molecular, en la cual, se encontró que una cepa común causó la colonización en los perros, en los trabajadores de la salud y en los neonatos y fue esencial introducir prácticas rigurosas de lavado de manos en el personal, para detener el brote (Chang et al 1998). Este es el primer estudio, donde se realizaron pruebas de epidemiología molecular, para hacer el seguimiento de un brote nosocomial de sepsis por M pachydermatis en recién nacidos, con factores predisponentes; sin embargo, la presencia de dispositivos intravasculares e infusión lipídica no fueron identificados como factores de riesgo, a pesar de lo que se creía, hasta entonces; lo que puede sugerir, que las infecciones sistémicas por M pachydermatis no comparten un trasfondo idéntico al de las infecciones sistémicas por especies de Malassezia lipofílicas (Marcus & Marcus, 1998).
Un hallazgo adicional que sugiere el origen animal de M pachydermatis en infecciones humanas es el hecho que la colonización cutánea por especies de Malassezia en neonatos saludables a término, inicia con el nacimiento y aumenta en las primeras semanas de vida, para el caso de M sympodialis y M globosa, pero M pachydermatis no fue aislada a partir de la piel de recién nacidos ni de sus madres (Bernier et al 2002). El estado de portador de M pachydermatis en propietarios de perros fue evidenciado por técnicas microbiológicas convencionales y moleculares, encontrándose una mayor proporción en el caso de propietarios sanos de caninos con patologías asociadas a Malassezia, que en propietarios de perros saludables y con menor rendimiento diagnóstico del cultivo, comparado con pruebas basadas en PCR (Morris et al 2005); igualmente, en el caso de una mujer con un granuloma facial y el perro de su propiedad a partir de raspados de piel, mediante técnicas microbiológicas e histopatológicas (Fan et al 2006), lo que ratifica la posible ruta de transmisión zoonótica en infecciones humanas, específicamente, a partir del contacto estrecho con caninos.
Galvis & Borda (datos sin publicar), entre 2015 y 2016, llevaron a cabo un estudio que pretendía evaluar el potencial de transmisión zoonótica de levaduras del género Malassezia aisladas de caninos y sus propietarios, que acudían a la Clínica Veterinaria Universitaria de la U.D.C.A, en Bogotá, Colombia. En la investigación, se tomaron muestras óticas de 48 caninos, con otitis externa y 48 muestras cutáneas de sus respectivos propietarios sanos, durante un periodo de un año. Se obtuvieron 32 aislamientos sugestivos de Malassezia spp. (29 de origen canino y 3 de origen humano), a los cuales, se les realizó identificación fenotípica con pruebas bioquímicas, cuyos resultados arrojaron 29 aislamientos compatibles con M pachydermatis y los tres restantes con Malassezia spp. Posteriormente, se realizó amplificación por PCR de las regiones genéticas 5.8S ADNr-ITS2 y 26S ADNr, obteniéndose productos de tamaño molecular, aproximado de 500 y 550 pb, respectivamente, al igual que con la cepa de referencia M pachydermatis CBS 1879. Las secuencias de ADN confirmaron que el total de aislamientos correspondían a M pachydermatis, con ambas regiones genéticas. Es interesante el hallazgo de la especie zoofílica M pachydermatis en tres humanos propietarios de caninos con patologías asociadas a esta levadura, lo cual, podría sugerir la capacidad de adaptación de este hongo a nuevos hospederos, como también, lo han propuesto diversos investigadores (Cabañes et al 2005; Cafarchia et al 2008; Cafarchia et al 2011b) y apoya, una vez más, el origen zoonótico de esta levadura en la piel humana, poniendo en riesgo a los pacientes con factores predisponentes, ya sea locales o sistémicos, de sufrir infecciones cutáneas o diseminadas por M pachydermatis
Estudios recientes sobre M pachydermatis en humanos: en publicaciones recientes, se ha evidenciado la presencia de M pachydermatis en piel humana saludable y con dermatosis, asociadas al género Malassezia En estos estudios, se identificaron muy pocos casos positivos para M pachydermatis, siendo mucho más frecuente el aislamiento de M globosa, M sympodialis y M furfur, tanto en los controles sanos como en pacientes con pitiriasis versicolor y dermatitis seborreica, a partir de muestras de piel, mediante pruebas de identificación fenotípica y genotípica (Rincón et al 2005; Prohic & Kasumagic, 2009; Giusiano et al 2010; Sosa et al 2013); llama la atención el hallazgo en personas que tenían contacto con animales domésticos (Kaur et al 2013). Estos datos soportan que M pachydermatis no es un miembro de la microbiota normal humana y que su presencia en piel es rara e indica una transmisión a partir de una fuente externa (Prohic & Kasumagic, 2009), como el contacto con animales de compañía.
En general, el tratamiento de todos los casos reportados de infecciones por M pachydermatis en humanos fue exitoso, utilizando antifúngicos de los grupos de los polienos, azoles y pirimidinas fluoradas; sin embargo, recientemente, se han publicado infecciones por aislamientos de M pachydermatis resistentes a fluconazol, flucitosina y caspofungina (Al-Sweih et al 2014; Chen et al 2015), llamativamente, en pacientes con exposición previa a antifúngicos de uso profiláctico, como el posaconazol (Choudhury & Marte, 2014), apoyando la teoría de la selección de cepas resistentes a azoles. Ya que M pachydermatis no requiere suplementación lipídica para su crecimiento y puede ser identificada erróneamente como Candida spp., se necesitan, prioritariamente, técnicas rápidas y confiables de identificación de levaduras fastidiosas, poco comunes y estandarizar protocolos efectivos y seguros de profilaxis antifúngica, en pacientes en riesgo, así como métodos para evaluar la susceptibilidad antifúngica. Aunque no han sido estudiados los mecanismos de resistencia en Malassezia spp., en otras levaduras de importancia médica, como Candida spp. y Cryptococcus spp., se han descrito cepas mutantes, que expresan enzimas responsables de una menor concentración de ergosterol en la membrana celular, que pueden causar resistencia a anfotericina B, al igual que bombas de eflujo a múltiples medicamentos que pueden determinar resistencia cruzada a anfotericina B y fluconazol (Cannon et al 2009). En la tabla 1, se resumen los estudios que han reportado la presencia de M pachydermatis en humanos.
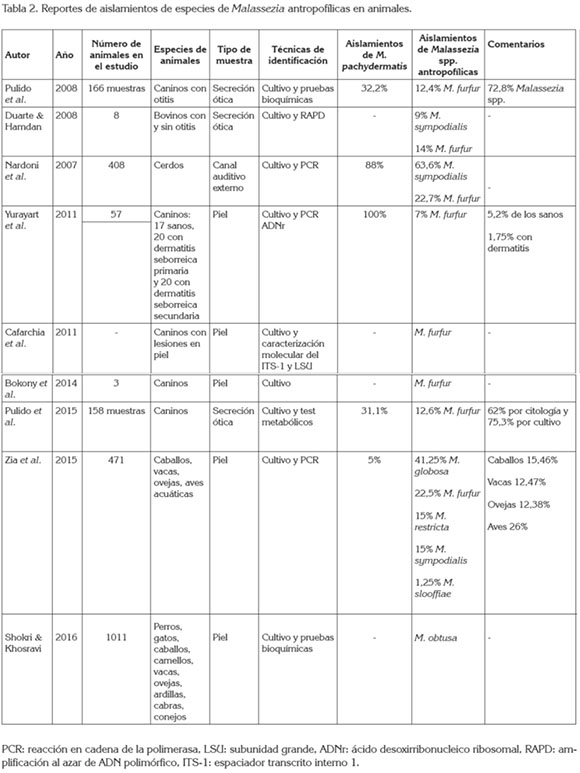
Especies antropofílicas de Malassezia en animales: En los animales de compañía, M pachydermatis es considerada una levadura lipofílica y no dependiente de lípidos, no micelial, saprófita de la piel de caninos y felinos, común en la piel normal y en la anormal, igualmente, en conductos auditivos externos normales y en animales con otitis externa. Es probable, que la humedad elevada sea un factor importante para su crecimiento, por lo que se presenta, con mayor frecuencia, en regiones anatómicas, como el conducto auditivo externo y las áreas interdigitales; adicionalmente, se exhibe en superficies de las mucosas oral, anal y vaginal. Se aísla con frecuencia de la piel del mentón, de los labios, dela región interdigital y, con menor frecuencia, de otras áreas, como la axila o la ingle (Scott et al. 2002; Girao et al 2006; Greene, 2008).
Se ha postulado que muchos factores predisponentes permiten que M pachydermatis comensal se vuelva patógena; no obstante, para su multiplicación podrían ser importantes la mayor disponibilidad de nutrientes y factores de crecimiento para las levaduras, como pueden ser las alteraciones hormonales y las seborreas (Scott et al. 2002). Un cambio en la inmunidad del huésped, una alteración del microclima o de la fisiología de la piel, puede predisponer a los animales a desarrollar la enfermedad clínica; se puede presentar como una afección dermatológica secundaria, cuando los animales exteriorizan otras dermatosis, tales como alergias, atopia, defectos de la queratinización y endocrinopatías o desórdenes metabólicos, que aumentan la producción de las glándulas sebáceas. La dermatitis primaria causa inflamación y aumento en la producción de sebo, prurito y eritema (Greene, 2008).
El primer reporte de dermatitis generalizada en perros, causada por levaduras del género Malassezia, fue obtenido por Dufait (1983). En su trabajo describió 50 casos de caninos con dermatitis por levaduras, los cuales, se diagnosticaron por citología y cultivo. Varios estudios practicados en perros han corroborado que las principales áreas anatómicas afectadas por M pachydermatis son los conductos auditivos y la zona interdigital y su implicación como agente etiológico de la otitis externa canina y de la dermatitis micotica (Nardoni et al. 2007; Pulido et al. 2010; De Bona et al 2012; Han et al. 2013).
En perros, M pachydermatis ha sido también cultivada de la microflora conjuntival de animales con enfermedad ocular clínica y, en algunos, sin patología oftálmica (Prado et al. 2004). Un estudio realizado por Ledbetter & Starr (2015) demostró que la frecuencia de detección de M pachydermatis en microflora conjuntival fue del 23%, en las muestras recolectadas de ojos de perros que tenían úlceras corneales y del 3%, aparentemente normales.
Los reportes de aislamientos en animales domésticos de especies levaduras antropofílicas dependientes de lípidos han sido publicados desde la década pasada y se siguen reportando actualmente; M furfur fue cultivada e identificada por pruebas bioquímicas de muestras de secreciones del conducto auditivo de perros con otitis (Pulido et al. 2010; Pulido et al. 2015) y de muestras de raspados de piel en caninos (Bokoni et al.2014). Durante estos mismos periodos, se hicieron estudios de aislamientos de especies antropofílicas en otros animales; es así, como fueron aisladas e identificadas, a través de cultivo y pruebas moleculares, las especies M sympodialis y M furfur, en conductos auditivos de bovinos con y sin otitis y en conductos auditivos de cerdos, en los cuales, predominó M sympodialis, que correspondió al 63,65% frente a M furfur, con un 22,7%. Los resultados de estos estudios sugieren que las especies de levaduras lipofílicas se encuentran en un proceso de adaptación a nuevos hospedadores (Duarte & Hamdan, 2008; Nardoni et al. 2010).
Resultados de investigaciones adelantadas en la década actual han demostrado, por medio de cultivo y de pruebas moleculares, la presencia de la levadura M furfur en la piel de caninos, tanto en animales, aparentemente sanos, como con dermatitis (Yurayart et al. 2011; Cafarchia et al 2011b; Bokoni et al. 2014; Pulido et al. 2015); sin embargo, nuevos estudios han hallado e identificado, por medio de cultivo y PCR, otras levaduras antropofílicas, como son M globosa, M restricta, M obtusa y M slooffiae, en diferentes animales domésticos, como ovejas, caballos, vacas y aves acuáticas, lo cual, supone que el espectro, tanto de huéspedes animales como de especies de levaduras lipofílicas, puede ser aún más amplio (Zia et al. 2015; Shokri & Khosravi, 2016). Como en ninguno de los estudios los autores pudieron afirmar que estas especies lipofílicas de Malassezia sean zoonóticas y que se estén transmitiendo de los humanos a los animales, se hace necesario la realización de investigaciones, que busquen dilucidar este interrogante. En la tabla 2, se resumen los estudios que han reportado aislamientos de especies de Malassezia antropofílicas en animales.
CONCLUSIÓN
Aunque M pachydermatis se ha considerado, históricamente, como una especie zoofílica, aislada, en principio, de caninos, existen en la literatura médica algunos reportes de la presencia de esta levadura en humanos y se ha empezado a estudiar su capacidad de transmisión zoonótica, mediante herramientas moleculares. Una mayor conciencia del potencial de transmisión de M pachydermatis a pacientes humanos y la aplicación de métodos de tipificación molecular podría conducir al reconocimiento de más casos en el futuro.
Por otra parte, el énfasis renovado de la higiene de manos en los hospitales, como resultado de la emergencia de infecciones nosocomiales con patógenos bacterianos multidrogo-resistentes, debería ayudar a prevenir el desarrollo de infecciones zoonóticas, por M pachydermatis En las UCIN, donde las infecciones nosocomiales son especialmente frecuentes, las buenas prácticas de lavado de manos, entre los trabajadores de la salud, son fundamentales. Infortunadamente, poco se conoce acerca de los agentes y de las técnicas de lavado de manos que, en efecto, eliminen el estado de portador de levaduras de Malassezia en seres humanos.
Diferentes investigadores han reportado la presencia de M pachydermatis en animales domésticos, tanto en animales de compañía como en animales de producción y en aves acuáticas. Esta levadura ha sido aislada de perros y de gatos con piel sana y en aquellos que tienen dermatitis, ya sea causada por defectos de la queratinización, por alergias a alimentos o atopia, en animales con otitis y en animales con endocrinopatías y enfermedades metabólicas, por lo que se puede considerar como una levadura comensal, en algunos animales y en otros, dependiendo de la especie, como una levadura patógena.
Estudios realizados por diferentes investigadores han encontrado, en animales, otras especies del género Malassezia, diferentes a M pachydermatis, principalmente, aquellas lípido-dependientes, que afectan al humano, como son M furfur, M sympodialis, M globosa y M restricta, lo que apunta a que estas especies han hallado nuevos hospederos y que las patologías relacionadas con estas levaduras, se pueden considerar como enfermedades antropo-zoonóticas, en donde se comparten estos patógenos, entre los humanos y los animales.
Por lo anterior, es importante que en Colombia se realicen investigaciones que busquen la presencia e identificación de estas levaduras, en donde el contacto entre el humano y el animal sea muy cercano, como son los animales domésticos, algunas aves acuáticas y en nuevas especies consideradas como mascotas no convencionales, al igual que en animales que forman parte de colecciones de zoológicos y de centros de rehabilitación de fauna silvestre. Se hace prioritario, entonces, el diseño de estudios, que evalúen el potencial de transmisión zoonótica de las levaduras del género Malassezia, que aporten al conocimiento de su ecología y epidemiología y, de esta forma, a la prevención de estas infecciones de interés, en salud humana y animal.
Agradecimientos: Los autores agradecen a la U.D.C.A, por el apoyo otorgado para la elaboración de este artículo. Conflicto de intereses: El manuscrito fue preparado y revisado con la participación de todos los autores, quienes declaramos que no existe conflicto de intereses que ponga en riesgo la validez de los resultados presentados. Financiación: Este trabajo fue financiado por Universidad de Ciencias Aplicadas y Ambientales U.D.C.A.
BIBLIOGRAFÍA
1. AL-SWEIH, N.; AHMAD, S.; JOSEPH, L.; KHAN, S.; KHAN, Z. 2014. Malassezia pachydermatis fungemia in a preterm neonate resistant to fluconazole and flucytosine. Med. Mycol. (Alemania). 5:9-11.
2. ARENDRUP, M.; BOEKHOUT, T.; AKOVA, M.; MEIS, J.; CORNELY, O. 2014. ESCMID and ECMM joint clinical guidelines for the diagnosis and management of rare invasive yeast infections. Clin. Microbiol Infect. (Israel). 20(3):76-98.
3. BANDHAYA, M. 1993. The distribution of Malassezia furfur and Malassezia pachydermatis on normal human skin. Southeast Asian J. Trop. Med. Public Health. (Tailandia). 24(2):343-346.
4. BERNIER, V.; WEILL, F.; HIRIGOYEN, V.; ELLEAU, C.; FEYLER, A. 2002. Skin colonization by Malassezia species in neonates: a prospective study and relationship with neonatal cephalic pustulosis. Arch Dermatol. (Alemania).138(2):215-218.
5. BOKONY, B.; BALINT, E.; SZABO, N.; HEGEDUS, G.T. 2014. Isolation of Malassezia furfur from canine skin scrapings. Magyar Allatorvosok Lapja. (Hungría). 136(1):41-44.
6. BOND, R. 2010. Superficial veterinary mycoses. ClinDermatol. (EUA). 28:226-236.
7. BOND, R.; GUILLOT, J.; CABAÑES, F. 2010. Malassezia yeasts in animal disease. En: Boekhout, T.; Guého, E.; Mayser, P.; Velegraki, A. (eds). Malassezia and the skin. Ed. Springer-Verlag (Alemania). p.291-292.
8. CABAÑES, F.; HERNÁNDEZ, J.; CASTELLÁ, G. 2005. Molecular analysis of Malassezia sympodialis-related strains from domestic animals. J. Clin. Microbiol. (EUA). 43(1):277-283.
9. CABAÑES, F. 2008. Micosis y zoonosis: Cryptococcusspp. Rev. Iberoam. Micol. (España). 25:S1-S3.
10. CAFARCHIA, C.; GASSER, R.; LATROFA, M.; PARISI, A.; CAMPBELL, B. 2008. Genetic variants of Malassezia pachydermatis from canine skin: body distribution and phospholipase activity. FEMS Yeast Res. (Suecia). 8:451-459.
11. CAFARCHIA, C.; GASSER, R.; FIGUEREDO, L.; LATROFA, M.; OTRANTO, D. 2011a. Advances in the identification of Malassezia. Mol. Cell. Probes. (Alemania).25(1):1-7.
12. CAFARCHIA, C.; LATROFA, M.; FIGUEREDO, L.; DA SILVA, M.; FERREIRO L. 2011b. Physiological and molecular characterization of atypical lipid-dependent Malassezia yeasts from a dog with skin lesions: adaptation to a new host? Med Mycol. (EUA). 49:365-374.
13. CANNON, R.; LAMPING, E.; HOLMES, A.; NIIMI, K.; BARET, P. 2009. Efflux-mediated antifungal drug resistance. Clin Microbiol Rev. (EUA). 22(2):291-321.
14. CASTELLÁ, G.; ABARCA, M.; CABAÑES, F. 2008. Criptococosis y animales de compañía. Rev. Iberoam. Micol. (España). 25:S19-S24.
15. CHANG, H.; MILLER, H.; WATKINS, N.; ARDUINO, M.; ASHFORD, D. 1998. An epidemic of Malassezia pachydermatis in an intensive care nursery associated with colonization of health care workers' pet dogs. N. Eng. J. Med. 338(11):706-711.
16. CHEN, I.; CHIU, N.; CHI, H.; HSU, C.; CHANG, J. 2015. Changing of bloodstream infections in a medical center neonatal intensive care unit. J. Microbiol. Immunol. Infect. (Taiwan). Epub ahead of print. doi: 10.1016/j.jmii.2015.08.023.
17. CHITTY, J.; HENDRICKS, A. 2007. Zoonotic skin disease in small animals. In Practice. (Inglaterra). 29:92-97.
18. CHOUDHURY, S.; MARTE, R. 2014. Malassezia pachydermatis fungaemia in an adult on posaconazole prophylaxis for acute myeloid leukaemia. Pathology (Australia). 46(5):450-472.
19. CHRYSSANTHOU, E.; BROBERGER, U.; PETRINI, B. 2001. Malassezia pachydermatis fungaemia in a neonatal intensive care unit. Acta Paediatr. (Suecia). 90:323-327.
20. DE BONA, E.; TELESCA, S.; FUENTEFRIA, A. 2012. Occurrence and identification of yeast in dog's external ear with and without otitis. Rev MVZ Cordoba. (Colombia). 17(2):3059-3064.
21. DUARTE, E.; HAMDAN, J. 2008. Molecular characterization of Malassezia sympodialis and Malassezia furfur from cattle whit and without otitis. Arq. Bras. Med. Vet. Zootec. 60(4):779-785.
22. DUFAIT, R. 1983. Pityrosporum canis as the cause of canine chronic dermatitis. Veterinary Medicine and Small Animal Clinician. (EUA). 78:1055-1057.
23. FAN, Y.; HUANG, W.; LI, S.; WU, G.; LAI, K. 2006. Granulomatous skin infection caused by Malassezia pachydermatis in a dog owner. AMA Arch. Derm. (EUA). 142:1181-1184.
24. FERREIRA, R.; GAMBALE, W.; GARCIA, R.; DA SILVA, L.; DURIGON, E. 2008. Malassezia spp. in acoustic meatus of bats (Molossus molossus) of the Amazon region, Brazil. Mycopathologia. (EUA). 165:21-26.
25. FINE, R.; SALUSKY, I.; HALL, T.; LUCULLO, L.; JORDAN, S. 1983. Peritonitis in children undergoing continuous ambulatory peritoneal dialysis. Pediatrics. (EUA). 71(5):806-809.
26. GAITANIS, G.; MAGIATIS, P.; HANTSCHKE, M.; BASSUKAS, I.; VELEGRAKI, A. 2012. The Malassezia genus in skin and systemic diseases. Clin Microbiol Rev. (EUA). 25(1):106-141.
27. GIRAO, M.; PRADO, M.; BRIHANTE, R.; CORDEIRO, R.; MONTEIRO, A. 2006. Malassezia pachydermatis isolated from normal and disease external ear canal in dogs: a comparative analysis. Vet J. (Brasil). 172(3):544-548.
28. GIUSIANO, G.; SOSA, M.; ROJAS, F.; VANACORE, S.; MANGIATERRA, M. 2010. Prevalence of Malassezia species in pityriasis versicolor lesions in northeast Argentina. Rev Iberoam Micol. (España). 27(2):71-74.
29. GORDON, M. 1979. Malassezia pityrosporum pachydermatis (Weidman) Dodge 1935. Sabouraudia. (EUA). 17(3):305-309.
30. GREENE, C. 2008. Enfermedades infecciosas del perro y el gato. 3ra Ed. Editorial Inter-Médica. Buenos Aires (Argentina). p.623-627.
31. GUÉHO, E.; SIMMONS, R.; PRUITT, W.; MEYER, S.; AHEARN, D. 1987: Association of Malassezia pachydermatis with systemic infections of humans. J. Clin. Microbiol. (EUA). 25(9):1789-1790.
32. GUILLOT, J.; GUÉHO, E.; CHÉVRIER, G.; CHERMETTE, R. 1997. Epidemiological analysis of Malassezia pachydermatis isolates by partial sequencing of the large subunit ribosomal RNA. Res Vet Sci. (Italia). 62:22-25.
33. GUILLOT, J.; BOND, R. 1999. Malassezia pachydermatis: a review. Med Mycol. (EUA). 37(5):295-306.
34. HAN, S.; CHUNG, T.; NAM, E.; PARK, S.; HWANG, C. 2013. Molecular analysis of Malassezia pachydermatis isolated from canine skin and ear in Korea. Med. Mycol. (EUA). 51(4):396-404.
35. HUBÁLEK, Z. 2003. Emerging human infectious diseases: anthroponoses, zoonoses and sapronoses. Emerg. Infect. Dis. (EUA). 9(3):403-404.
36. KAUR, M.; NARANG, T.; BALA, M.; GUPTE, S.; AGGARWAL, P. 2013. Study of the distribution of Malassezia species in patients with pityriasis versicolor and healthy individuals in Tertiary Care Hospital, Punjab. Indian J. Med. Microbiol. 31:270-274.
37. LAROCCO, M.; DORENBAUM, A.; ROBINSON, A.; PICKERING, L. 1988. Recovery of Malassezia pachydermatis from eight infants in a neonatal intensive care nursery: clinical and laboratory features. Pediatr. Infect. Dis J. (EUA). 7(6):398-401.
38. LAUTENBACH, E.; NACHAMKIN, I.; SCHUSTER, M. 1998. Malassezia pachydermatis infections. N. Eng. J. Med. 339(4):266-273.
39. LEDBETTER, E.; STARR, J. 2015. Malassezia pachydermatis keratomycosis in a dog. Med. Mycol. (EUA). 10:24-26.
40. LEFEBVRE, S.; WALTNER, D.; PEREGRINE, A.; REID, R.; HODGE, L. 2006. Prevalence of zoonotic agents in dogs visiting hospitalized people in Ontario: implications for infection control. J. Hosp Infect. (Inglaterra). 62:458-466.
41. MANI, I.; MAGUIRE, J. 2009. Small animal zoonoses and immunocompromised pet owners. Top Companion Anim. Med. (EUA). 24(4):164-174.
42. MARCON, M.; POWELL, D. 1992. Human infections due to Malassezia spp. Clin. Microbiol. Rev. (EUA). 5(2):101-119.
43. MARCUS, L.; MARCUS, E. 1998. Nosocomial zoonoses. N. Engl. J. Med. 338(11):756-759.
44. MESTRONI, S.; VERNA, J.; SMOLKIN, A.; BAVA, A. 2003. Etiological factors of fungemia in the Hospital San Martín in La Plata. Rev. Argent. Microbiol. 35(2):106-109.
45. MICKELSEN, P.; VIANO, M.; STEVENS, D.; DIAZ, P. 1988. Clinical and microbiological features of infection with Malassezia pachydermatis in high-risk infants. J. Infect. Dis. (EUA).157(6):1163-1168.
46. MORRIS, D.; O'SHEA, K.; SHOFER, F.; RANKIN, S. 2005. Malassezia pachydermatis carriage in dog owners. Emerg. Infect. Dis. (EUA). 11(1):83-88.
47. NARDONI, S.; DINI, M.; TACCINI, F.; MANCIANTI, F. 2007. Occurrence, distribution and population size of Malassezia pachydermatis on skin and mucosae of atopic dog. Vet. Microbiol. (Australia). 122(1-2):172-177.
48. NARDONI, S.; MERILDI, V.; FRANGIONI, S.; ARITI, G.; VERIN, R.; VANNUCCI, P.; MANCIANTI, F. 2010. Isolation and characterization of Malassezia spp. In healthy swine of different breeds. Veterinary Microbiology. (Italia). 14: 155-158.
49. NENOFF, P.; HANDRICK, W.; KRÜGER, C.; VISSIENNON, T.; WICHMANN, K. 2012. Dermatomycoses due to pets and farm animals: neglected infections? Hautarzt. (Alemania). 63(11):848-858.
50. PACHECO, A. 2003. Mascotas en los hogares: enfermedades de los niños adquiridas por convivencia con animales. Enf. Infec. y Micro. (España). 23(4):137-148.
51. PERALAM, P.; SRIPATHI, H.; BAIRY, I.; LONIKAR, V.; RAO, R. 2009. Zoonotic sporotrichosis of lymphocutaneous type in a man acquired from a domesticated feline source: report of a first case in southern Karnataka, India. Int. J. Dermatol. (EUA). 48:1198-1200.
52. PRADO, M.; BRITO, E.; GIRÃO, M.; MONTEIRO, A.; SIDRIM, J. 2004. Higher incidence of Malassezia pachydermatis in the eyes of dogs with corneal ulcer than in healthy dogs. Vet Microbiol. (Australia).100(20):115-120.
53. PROHIC, A.; KASUMAGIC, E. 2009. Identification of Malassezia pachydermatis from healthy and diseased human skin. Med. Arch. (Bosnia y Herzegovina). 63(6):317-319.
54. PROHIC, A.; JOVOVIC, T.; KRUPALIJA, M.; KUSKUNOVIC, S. 2016. Malassezia species in healthy skin and in dermatological conditions. Int. J. Dermatol. (USA). 55:494-504.
55. PULIDO, A.; CASTAÑEDA, R.; LINARES, M.; MERCADO, M. 2008. Clinical-microbiological diagnostic of external otitis in canines in Bogotá, Colombia. Rev. MVZ Córdoba. (Colombia). 15(3):2215-2222.
56. PULIDO, A.; CASTAÑEDA, R.; LINARES, M.; MERCADO, M. 2015. Concordance between otic cytology and culture in diagnosis of external otitis canine by Malassezia spp. Rev. MVZ Córdoba. (Colombia).20(3):4720-4724.
57. RINCÓN, S.; CELIS, A.; SOPÓ, L.; MOTTA, A.; CEPERO, M. 2005. Malassezia yeast species isolated from patients with dermatologic lesions. Biomédica. (Colombia). 25:189-195.
58. ROMANO, A.; SEGAL, E.; BLUMENTHAL, M. 1978. Canaliculitis with isolation of Pityrosporum pachydermatis Br. J. Ophthalmol. 62:732-734.
59. SCOTT, D.; MILLER, W.; GRIFFIN, C. 2002. Dermatología en pequeños animales. 6ta edición. Editorial Inter-Médica. (Argentina). 380-393.
60. SHOKRI, H.; KHOSRAVI, A. 2016. An epidemiological study of animal dermatomycosis in Iran. J. Mycol Med. (Iran). (2):170-177.
61. SEYEDMOUSAVI, S.; GUILLOT, J.; TOLOOE, A.; VERWEIJ, P.; DE HOOG, G. 2015. Neglected fungal zoonoses: hidden threats to man and animals. Clin Microbiol Infect. (Israel). 21(5):416-425.
62. SOMERVILLE, D. 1971. Colonisation by Pityrosporum pachydermatis. Lancet. (Inglaterra). 17(1):799.
63. SOSA, M.; ROJAS, F.; MANGIATERRA, M.; GIUSIANO, G. 2013. Prevalencia de especies de Malassezia asociadas a lesiones de dermatitis seborreica en pacientes de Argentina. Rev. Iberoam. Micol. (España).30(4):239-242.
64. VAN BELKUM, A.; BOEKHOUT, T.; BOSBOOM, R. 1994. Monitoring spread of Malassezia infections in a neonatal intensive care unit by PCR-mediated genetic typing. J. Clin. Microbiol. (EUA). 32(10):2528-2532.
65. WELBEL, S.; MCNEIL, M.; PRAMANIK, A.; SILBERMAN, R.; OBERLE, A. 1994. Nosocomial Malassezia pachydermatis blood-stream infections in a neonatal intensive care unit. Pediatr. Infect. Dis. J. (EUA).13(2):104-108.
66. WORLD HEALTH ORGANIZATION. 1967. Joint WHO/ FAO expert committee on zoonoses, 3rd report. WHO Technical Report Series. (Italia). 378.
67. YURAYART, C.; CHINDAMPORN, A.; SURADHAT, S.; TUMMARUK, P.; KAJIWARA, S. 2011. Comparative analysis of the frequency, distribution and population sizes of yeasts associated with canine seborrheic dermatitis and healthy skin. Vet. Microbiol. (Australia). 148(2-4):356-362.
68. ZIA, M.; MIRHENDI, H.; TOGHYANI, M. 2015. Detection and identification of Malassezia species in domestic animal and acuatic birds by PCR-RFLP. Iran J. Vet. Res. 16(1):36-41.
Recibido: Octubre 13 de 2016 Aceptado: Diciembre 1 de 2016

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.