CIENCIAS AGRARIAS-Artículo Científico
DESINTOXICACIÓN DE LA TORTA DE Jatropha curcas L. COMO POSIBLE ALTERNATIVA DE ALIMENTO PARA GANADO BOVINO EN EL CARIBE COLOMBIANO
DETOXIFICATION OF Jatropha curcas L. SEED MEAL AS POSSIBLE ALTERNATIVE LIVESTOCK FEED IN THE COLOMBIAN CARIBBEAN
Betty Jarma Arroyo1, Yenis Vanegas O2, Marcelo Francisco Pompelli3, Carlos Garrido P4, Egídio Bezerra Neto5, Alfredo Jarma Orozco6
1 Ingeniera Agroindustrial, Universidad del Atlántico, Barranquilla, Colombia. Trabajo presentado como requisito para optar al título de Ingeniero Agroindustrial, e-mail: betyca1@hotmail.com
2 Ingeniera Agroindustrial, Universidad del Atlántico, Barranquilla, Colombia. Trabajo presentado como requisito para optar al título de Ingeniero Agroindustrial
3 Ph.D. Fisiología de Plantas, Universidad Federal de Pernambuco, Brasil, e-mail: mfpompelli@gmail.com
4 Ingeniero Químico, Profesor Facultad de Ingeniería Agroindustrial, Universidad del Atlántico, Barranquilla, Colombia, e-mail: carrgar1@hotmail.com
5 Ph.D. Bioquímica Vegetal, Universidad Federal Rural de Pernambuco, Brasil, e-mail: egidiobn@yahoo.com.br
6Ph.D. Fisiología de Cultivos, Profesor Facultad Ciencias Agrícolas Universidad de Córdoba, Montería, Colombia, e-mail: ajarma24@yahoo.com.
Rev. U.D.C.A Act. & Div. Cient. 17(1): 171-178, Enero-Junio 2014
RESUMEN
Jatropha curcas L es una planta tropical y se utiliza, actualmente, como fuente de biodiesel. La torta, después de la extracción de aceite, es rica en proteínas y es una fuente potencial de alimento para el ganado; sin embargo, está compuesta por un grupo de sustancias tóxicas, incluyendo ésteres de forbol (PMA) y algunos otros antinutrientes. En esta investigación, se aplicaron diferentes métodos de desintoxicación en la torta desgrasada de J. curcas, para eliminar o reducir a un nivel aceptable o permitido, la concentración de PMA, taninos y saponinas. La metodología incluyó tres tratamientos químicos, etanol, metanol e hidróxido de sodio/ hipoclorito de sodio. Los dos primeros, con radiación térmica seca y, el tercero, con radiación térmica húmeda (agua). Se realizó un análisis físico-químico, para caracterizar el contenido de fibra, de proteínas solubles, de extracto etéreo, de nitrógeno y de carbohidratos solubles. Las desintoxicaciones actuaron, de tal manera, que los niveles de actividad de antinutrientes se vieron altamente afectados (p<0.05). Los tratamientos con metanol e hipoclorito de sodio/hidróxido de sodio, arrojaron un contenido de proteínas total de 33,99% y 18,77%, respectivamente, mientras que con etanol, un total de 64,68%, dejando una torta con un nivel aceptable, de acuerdo con los requisitos exigidos para la alimentación de ganado. La reducción en el contenido de PMA en las muestras fue exitoso; las desintoxicaciones con metanol, hidróxido de sodio/hipoclorito de sodio, redujeron el contenido final en un porcentaje de 99,80% y 99,85%, respectivamente; no obstante, la desintoxicación con etanol dio un estricto valor de 99,96%, caracterizándose como la mejor opción.
Palabras clave: Ésteres de forbol (PMA), antinutrientes, piñón manso, agroindustria.
SUMMARY
Jatropha curcas L. is a tropical plant presently used as a source of biodiesel; the cake, after oil extraction is rich in protein and is a potential source for livestock feed. However, this resultant cake is compound by a group of toxic substances, including phorbol esters (PMA), and some other antinutrients. In this investigation, were applied different methods of detoxification on the defatted cake of J. curcas using three chemical treatments, ethanol, methanol (both with dry thermal radiation), and sodium hydroxide / sodium hypochlorite with wet thermal radiation (water) to eliminate or reduce to a tolerable and permissible level the concentration PMA, tannins, and saponins. A physical-chemical analysis was performed to characterize the fiber content, soluble protein, lipids, nitrogen and soluble carbohydrates. The detoxification acted in a way that the activity levels of antinutrients were highly affected (p<0.05). Treatments with methanol and sodium hydroxide/sodium hypochlorite showed a low percentage on the protein content, 33.99% and 18.77% respectively, while the detoxification with ethanol reduced to 64.68%, leaving a cake in a highly acceptable level, according to the requirements for livestock feed. The reduction on the content of PMA in the samples was also successful; detoxified samples with methanol and sodium hydroxide/sodium hypochlorite, reduced the final content by a percentage of 99.80 % and 99.85% respectively, while detoxification with ethanol gave a strictest value of 99.96%, leaving this latter as the best option again.
Key words: Phorbol esters (PMA), antinutrients, purging nut, agribusiness.
INTRODUCCIÓN
Jatropha curcas L. (Euphorbiaceae) es un arbusto de usos múltiples y gran importancia económica, debido a varios usos potenciales industriales y medicinales (Lim 2010; Kalam et al. 2012). Investigadores consideran la J. curcas como una alternativa a los combustibles fósiles, para reducir las emisiones de gases de efecto invernadero (Behera et al. 2010). En la actualidad, la especie puede contribuir a la disponibilidad de energías renovables, pues desenvuelve un papel importante en la producción de biodiesel, ya que no es tóxico con la naturaleza en comparación al petro-diesel (Pandey et al. 2012).
El contenido de aceite en las semillas es de alrededor de 30-40% y la torta puede contener hasta 60% de ácidos grasos, en patrones similares a los aceites comestibles (Pompelli et al. 2010). La composición y el porcentaje de los aminoácidos esenciales y el contenido mineral de la pasta resultante de la extracción de aceite puede ser comparada con pastas similares, utilizadas como forraje (Makkar et al. 2008); no obstante, debido a diversos principios tóxicos, como la lecitina (curcina), ésteres de forbol, saponinas, inhibidores de proteasas y fitatos, el aceite, la semilla o la pasta resultante de la extracción de aceite, aún no puede ser utilizado en la nutrición animal o humana (Rakshit et al. 2008; Devappa et al. 2010); su uso puede conducir a la promoción de tumores, proliferación celular, activación de plaquetas de la sangre, mitogénesis de linfocitos, eritema de la piel, producción de prostaglandinas y estimulación de la desgranulación de los neutrófilos (Saetae & Suntornsuk, 2011).
La resistencias de los ésteres de forbol a las condiciones térmicas e, incluso, a la ebullición del aceite, ha llevado a investigaciones para la detoxificación de estas semillas, mediante la extracción con solventes orgánicos y con tratamientos químicos combinados. Diversos autores, como Aregheore et al. (2003), Martínez et al. (2006) y Rakshit et al. (2008), han empleado etanol, metanol, álcalis [NaOH y Ca (OH)2], combinaciones alcohol-álcalis, etanol-NaHCO3 y NaOH-NaClO, reportando disminuciones por encima del 40%, en el contenido de ésteres de forbol. Desintoxicaciones por métodos térmicos han reportando disminuciones en actividad de antinutrientes, por tratamientos secos y disminución en la actividad de lectina, por tratamiento húmedo, a partir de los 30 minutos de cocción (Rakshit et al. 2008).
A pesar de encontrarse numeros trabajos en la desintoxicación de la torta son muy escasos los experimentos que han evaluado la pérdida de contenido nutricional en el producto tratado; no obstante, se han realizado pruebas in vitro para concer la toxicidad del producto detoxificado.
Esta investigación tuvo como propósito evaluar el efecto de la combinación de tratamientos químicos y físicos para la eliminación o disminución de sustancias tóxicas presentes en la torta de semillas de J. curcas, principalmente, esteres de forbol, saponinas y taninos. Se realizaron análisis fisicoquímicos (proximales), para conocer si la torta detoxificada cumplia con las características y la composición necesaria para adpatarla como alimento de consumo animal; lo anterior, con el fin de identificar procesos agroindustriales potenciales, que faciliten el aprovechamiento integral de la planta, sustancialmente, los altos contenidos proteicos en la torta, para su uso seguro, como alimento para ganado bovino.
MATERIALES Y MÉTODOS
Metodologías y análisis: En esta investigación, se trabajó con una torta de semillas desgrasadas de origen brasilero de J. curcas, resultante de la obtención de biodiesel, suministrado por el Centro de Tecnologías Estratégicas del Nordeste (CETENE), ubicado en la ciudad de Recife, Brasil. La torta fue dividida en doce porciones, tres partes para cada desintoxicación y tres para mantenerlas como testigo para efectos del diseño experimental; todas fueron rotuladas y guardadas a temperatura controlada.
Para la desintoxicación, se evaluaron tres metodologías: i) desintoxicación con etanol al 92%, basada en los resultados publicados por Makkar et al. (1997) y aplicación de radiación térmica seca de 74°C x 48 horas; ii) metanol al 92%, con base en los resultados reportados por Aregheore et al. (2003), empleando radiación térmica seca a 100°C x 48 horas (Martínez et al. 2006); iii) NaOH (1M) - NaClO (5%), de acuerdo con lo propuesto por Aregheore et al. (2003), aplicando radiación térmica húmeda de 121°C x 20 minutos y radiación térmica seca de 100°C x 2 horas; en este tratamiento, se requirió de numerosas lavadas hasta controlar el pH (7-7,5) y eliminar cualquier residuo del solvente. Al igual que las anteriores, la muestra fue enfriada, marcada y guardada en temperatura controlada.
Luego de efectuadas estas metodologías, se realizaron análisis proximales de humedad (AOAC 841.78/ 2005), cenizas (AOAC 923.03/1980), lípidos y fibras (Barreto & Bezerra, 2004), carbohidratos solubles totales (Dubois et al. 1956), proteínas solubles (Bradford, 1976), nitrógeno (ASTM, 1994 - Método D3590), con el fin de conocer el valor nutricional del producto (Fennema et al. 2010) y tres técnicas analíticas, para determinar la toxicidad final de la torta, en la que se caracterizó:
Saponinas y Taninos: Las saponinas, se determinaron cualitativa y semi-cuantitativamente y los taninos, cualitativamente, ambos de acuerdo a la metodología descrita por Pompelli et al. (2011).
Ésteres de forbol: Determinación cualitativa y cuantitativa, mediante HPLC mg/g forbol -12 miristato -13 acetato (PMA) (Makkar & Becker, 1997).Para la determinación del PMA, se empleó un Micro Highperformance liquid chromatography (HPLC), marca Thermo SCIENTIFIC, compuesto por una bomba accela 600, automuestrador y detector Photo Diode Array (PDA), con una micro columna Hypersil GOLD de 50 x 2,1mn y 1,9µ, de fase inversa. Para la fase móvil, se aplicó el gradiente definido por Makkar & Becker (1997), modificado. Se trabajó con agua tipo HPLC, con 1,75% de ácido O-fosfórico 85% (solvente A) y Acetonitrilo (solvente B), con un flujo 200 µl/min. El volumen de muestras fue de 1 µl, para ello se usó un gradiente y una muestra patrón, pura: (PMA) Forbol 12-miristato 13-acetato ≥ 99%, (TLC) líquido, de la empresa Sigma Aldrich®.
La cuantificación del PMA, se realizó a una longitud de onda 250nm a una temperatura de 25-26°C.
Análisis estadísticos de los resultados: Los resultados fueron sometidos a un análisis de varianza bajo la estructura de un diseño completamente aleatorizado con arreglo factorial, en el cual, se evaluaron los tratamientos quimicos. La unidad experimental (UE) estuvo compuesta por doce (12) muestras. Cada tratamiento químico constó de tres repeticiones y una muestra testigo con igual repeticiones, para un total de 12 muestras. La información fue analizada estadísticamente, a través del Statistical Analysis System (SAS) y el programa Statgraphics versión 2.1; se utilizó como prueba de comparación de media la diferencia mínima significativa (DMS), en niveles significantes de 5 y 1%. Las interacciones que resultaron significativas o altamente significativas, se descompusieron gráfica y numéricamente, a través de un ANOVA, con la tasa de varianza F significante al 5%.
RESULTADOS Y DISCUSIÓN
En la desintoxicación, los tratamientos con etanol y con metanol mostraron semejanzas de comportamiento, desde la adición del solvente hasta el resultado final, después de aplicar los tratamientos térmicos; en las dos muestras, el material de ambas se compactó, dejando una apariencia de ''suelo árido''.
En el tratamiento con NaOH-NaClO, se observó que al adicionarle NaOH, aparecía un poco de efervescencia durante pocos segundos (± 3); al añadirle NaClO, se desprendía un olor fuerte parecido al olor del amoniaco. Esta desintoxicación dio como resultado una torta maleable y pastosa (características que fueron conservadas hasta el momento previo de secado en el horno).
Composiciones proximales
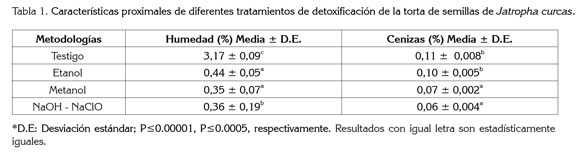
Contenido de humedad y ceniza: En este caso, se obtuvieron valores aceptables, todos inferiores al 5%, que están dentro de los parámetros de normalidad/aceptabilidad, para este tipo de alimentos. Esto permite obtener un producto que puede ser almacenado por tiempo definido y condiciones poco controladas; sin embargo, se debe tener en cuenta que los valores de humedad pueden variar según los tiempos y las condiciones de secado. El contenido de humedad de un grano, según Cayón (1996), se ve afectado por varios factores, entre ellos, la madurez del grano, la humedad de la cosecha y la temperatura y el porcentaje de humedad relativa de almacenamiento, es decir, que el ambiente en donde se almacena la trota posee alta humedad relativa, se puede absorber y aumentar el contenido de humedad.
El porcentaje de cenizas de las muestras también se ubica dentro del límite permisible, menor a 10% (Akintayo, 2003), pues depende de la composición del material y el porcentaje del mismo que está asociado al contenido de otros minerales, como potasio, sodio, fósforo (Tabla 1).

Contenido de lípidos: El porcentaje de lípidos se vio altamente afectado por los tratamientos de detoxificación con etanol y con metanol, reduciendo la concentración en un 59 y 54,42%, respectivamente. Esto se puede deber a que el pequeño tamaño del grupo hidroxilo alcohólico en los dos solventes es soluble en entornos, tanto acuosos como lípidos (King et al. 2009) y que en los lavados, que exigían cada uno de los tratamientos, se hayan descartado también contenido de ácidos grasos: el 41,07%, para etanol y 45,58%, para metanol; no obstante, la muestra desintoxicada con NaOH-NaClO, arrojó una disminución significativamente desproporcional (p<0,05) en comparación con las otras dos metodologías, disminuyendo el valor lipídico, en un 90,3% y eliminando, casi por completo, la presencia de ácidos grasos, que se encontraban en la muestra. Este bajo contenido puede ser por consecuencia de diversos factores, uno de ellos, es que el hidróxido de sodio (catalizador básico) haya actuado como detergente (Lakatos & Oliveira 2001), separando las suciedades del sustrato sobre el que estaban retenidas y saponificando los ácidos saturados presentes en la torta, de tal manera, que el elevado porcentaje inicial de la torta se haya reducido casi en su totalidad (Tabla 2).
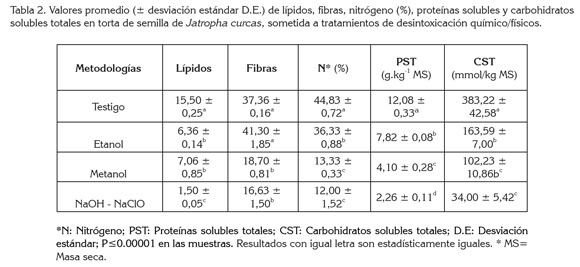
Contenido de fibra cruda: Se observó un aumento parcial en el contenido de fibras de la muestra tratada con etanol (10% más que el testigo), lo que se puede deber a que la selección de la muestra se hizo con base a una torta que, probablemente, no presentaba la misma homogeneidad en su contextura (alta heterogeneidad). Lo anterior puede ser consecuencia del proceso de obtención del biodiesel, que prioriza este objetivo (combustible) y no la calidad final de la torta, que es considerada subproducto (Tabla 2).
Contenido de nitrógeno: Las muestras desintoxicadas con metanol y NaOH-NaClO redujeron el contenido de nitrógeno, a una proporción de 29,7 y 26,7%, respectivamente; las elevadas condiciones térmicas a los que fueron sometidos estos dos tratamientos pueden argumentar la reducción excesiva de la proteína (Badui, 2006), pues al ser termolábiles, fueron crucialmente afectadas por estas dos metodologías. Estos valores indican que las desintoxicaciones degradaron, de tal manera el contenido de proteína cruda, que dejaron valores inaceptables, según la Norma General del Codex para Productos Proteínicos Vegetales (Ppv) Codex Stan 174 - 1989 (FAO OMS, 2006), que justifica un valor mínimo de 40%, según el estándar de la misma (Tabla 2); no obstante, la muestra detoxificada con etanol, redujo un 18,96% del nitrógeno inicial comparada con la muestra testigo, dejando un elevado contenido (81,08% N) y de proteína cruda. Aunque esta metodología también exigía tratamiento térmico, la exposición fue menor, tanto en tiempo como en temperatura, por lo que la reducción en nitrógeno fue menor.
Contenido de proteínas solubles y carbohidratos solubles totales: Las proteínas son moléculas termolábiles, inestables a cambios de temperaturas altas, lo que conduce a la degradación de las mismas (Badui, 2006). Los tratamientos que tuvieron mayor radiación y exposición térmica (metanol y NaOH-NaClO), arrojaron los valores más bajos de proteína con un contenido final de 33,97% y 18,76%, para cada una.
En la detoxificación con etanol, la reducción de proteína fue de un 35,31%, dejando un contenido final total de 64,68%, valor satisfactorio para la elaboración de una dieta para ganado bovino (FAO OMS, 2006).
La importancia de la conservación de la proteína en los tratamientos de detoxificación radica en que los microorganismos también digieren la proteína por acción enzimática y la convierten en ácidos grasos volátiles y amoniaco; las bacterias utilizan el amoniaco para nutrirse y sintetizar su propia proteína celular que, a la larga, será la fuente principal de aminoácidos para el rumiante, cuando los microorganismos son digeridos en el tracto digestivo del animal (Robles, 2008).
El tratamiento con NaOH-NaClO presenta una disminución abrupta de carbohidratos, pues reduce su contenido once veces más si se compa con la muestra testigo, dando como resultado una torta pobre de contenido (8,87%). Lo anterior, puede ser consecuencia de la alta afinidad de los átomos de carbono (unidos a otros grupos funcionales como carbonilo e hidroxilo) con los solventes, que pudo haber llevado a cabo un hidrólisis simple o simplemente actuaron como agente reductor (Badui, 2006).
Entre tanto, aunque la reducción con metanol fue menor (26,07%), no es un porcentaje suficiente para el aporte y el almacenamiento de energía para el ganado, pues debe estar entre el 50 y 80% de carbohidratos (Wattiaux, 2012), lo que hace que se conviertan en tratamientos inconvenientes (Tabla 2).
Es importante que la cantidad de carbohidratos solubles en las muestras sea relativamente alta, pues de esto depende, en gran parte, la calidad de la nutrición animal, ya que son convertidos rápidamente en ácidos grasos volátiles y son fuente inmediata de energía, para la multiplicación de la flora ruminal (Robles, 2008). Por lo anterior, La muestra detoxificada con etanol está un poco más cerca de los parámetros establecidos, pues arrojó un valor de 42,68%, dejando esta opción más accesible y favorable que las anteriores.
Valoración tóxica: El contenido tóxico de la muestra, se determinó con base en los resultados del contenido de ésteres de forbol, presencia de saponinas y de taninos. Los valores obtenidos de las pruebas se muestran en la tabla 3.
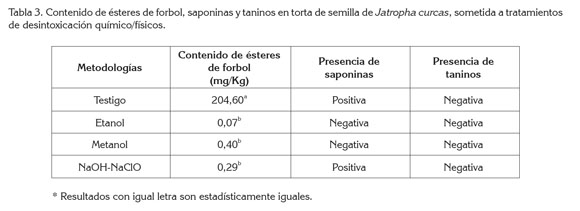
Las muestras de J. curcas sin desintoxicar, presentaron un elevado contenido del metabolito 12-miristato 13-acetato, corroborando la necesidad de desintoxicación de la misma.
En cuanto a la ausencia de taninos en todas las muestras, se puede deber a tres factores: i) la torta de Jatropha curcas que se escogió para realizar los análisis pertenezca a una variedad libre o de muy poco contenido de esta sustancia; ii) el porcentaje evaluado de las muestras haya sido tan pequeño como para denotar presencia de estos y, iii) el método por determinación cualitativa no haya sido lo suficientemente eficaz.
Por otra parte, la presencia de saponinas, sólo en la muestra sin detoxificar, es un buen indicador de que las metodologías aplicadas eliminaron favorablemente la presencia de saponinas en las muestras.
Comparación de dietas existentes: Teniendo en cuenta la referencia de la FAO, se compararon los componentes nutricionales de dos suplementos alimenticios para ganado (algodón y harina de pescado) y las tortas desintoxicadas de J. curcas (Tabla 4).
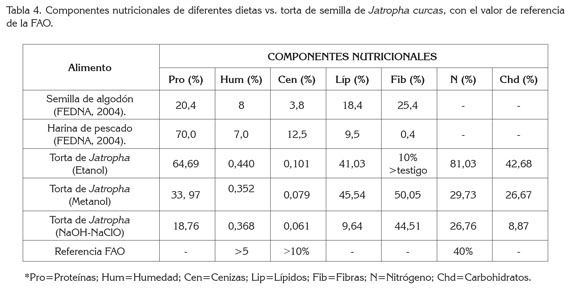
Con base en los resultados observados para la torta tratada con etanol, contenidos de proteína (64%), carbohidratos solubles totales (42,68%), nitrógeno (36,33%) y fibra (41,3%), demuestran que puede ser utilizada como un suplemento alimenticio, pues no discrepa con las características de los otros suplementos que ya están estandarizados y comercializados. La disminución en el contenido de ésteres de forbol en las muestras con etanol, de un 99,96%, seguido por NaOH-NaClO, en 99,85% y, finalmente metanol, en 99,80%, indican que ninguno de los extractos presenta factores antinutricionales o toxicológicos, pues no hay diferencia significativa entre ellos (p<0.05).
Por lo anterior, los resultados del presente trabajo indican que la alternativa más adecuada para la desintoxicación de la torta de J. curcas L es el tratamiento con etanol, dado que los valores nutricionales se mantuvieron, pues no hubo mayores degradaciones, según los criterios de la FAO, no hay residuos de solventes tóxicos y los componentes antinutricionales y dañinos (ésteres de forbol, saponinas) fueron eliminados satisfactoriamente, resultando más conveniente en cuanto a su aplicación, seguridad y consumo, lo que resulta más atractivo, si se desea utilizar de manera agroindustrial; sin embargo, todos los tratamientos aplicados afectaron significativamente el contenido de proteína cruda y soluble en la torta de J. curcas, pues degradaron, de tal manera las moléculas que, incluso, hasta el mejor de ellos, redujo el contenido final a la mitad (etanol); por tanto, se recomienda realizar estudios con animales para confirmar la seguridad de la torta desintoxicada (presencia de curcina), antes de su aplicación en alimentos.
Agradecimientos: Al laboratorio de investigación del grupo GIPAVE de la Universidad de Córdoba (Sede Berastegui), en especial al Doctor Guillermo Arrázola y la M.Sc. Marcela Villalba, por su ayuda en la determinación y estandarización del método con PMA mediante HPLC. Conflicto de intereses: Los autores declaramos que no existe ningún conflicto de interés que ponga en riesgo la validez de los resultados presentados.
BIBLIOGRAFÍA
1. AKINTAYO, E,T. 2003. Characteristics and composition of Parkia biglobbossa and Jatropha curcas oils and cakes. Biores. Techn. 92:307-310.
2. AOAC 841.78. Official Methods of Analysis18 th. Edition. 2005. Determinación de humedad. Washington, D.C. http://www.fao.org/docrep/field/003/ab489s/ab489s03.htm (con acceso 05/08/2012).
3. AOAC 923.03. Official Methods of Analysis. 1980. Determinación de cenizas. Washington, D.C. http://www.fao.org/docrep/field/003/ab489s/ab489s03.htm (con acceso 06/08/2012).
4. ASTM D 3590. 1994. Standard test methods for total Kjeldahl nitrogen in water. Disponible desde internet en http://www.freestd.us/soft2/717483.htm (con acceso 03/07/2012).
5. AREGHEORE, E.M.; BECKER, K.; MAKKAR, H.P.S. 2003. Detoxification of a toxic variety of Jatropha curcas using heat and chemical treatments and preliminary nutritional evaluation with rats. South Pacific J. Nat. Sci. 21:50-56.
6. BADUI, S. 2006. Química de alimentos. Pearson - Educación. 4ed.p.716-717.
7. BARRETO, L.P.; BEZERRA, N.E. 2004. Método de análises químicas em plantas. Ed. UFRPE (Brasil). p.27- 60
8. BEHERA, S.K; SRIVASTAVA, P.; TRIPATHI, R.; SINGH, J.P; SINGH, N. 2010. Evaluation of plant performance of Jatropha curcas L. under different agropractices for optimizing biomass - A case study. Biomass. Bioenerg. 34:30-41.
9. BRADFORD, M. 1976. A Rapid and Sensitive Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein-Dye Binding. Anal. Biochem. 72:248-254.
10. CAYÓN, G. 1996. Ecofisiología de la palma de aceite (Elaeis guineensis Jacq.). Primer Curso Internacional de Palma de Aceite. Memorias. Cenipalma, Bogotá. p. 38-54.
11. DEVAPPA, R.K.; MAKKAR, H.P.S.; BECKER, K. 2010.Jatropha toxicity, a review. Journal of Toxicology and Environmental Health, Part B 13: 476-507.
12. DUBOIS, M.; GILLES, K.A.; HAMILTON, J.K.; REBERS, P.A; SMITH, F. 1956. Colorimetricmethod for determination of sugars and related substances. Anal. Chem. 28:350-356.
13. FAO OMS. 2006. Previsiones demográficas mundiales. Disponible desde internet en http://www.un.org/esa/population/publications/wpp2006/Spanish.pdf (con acceso 01/05/2012).
14. FEDNA. 2004. Fundación Española para el Desarrollo de la Nutrición Animal. Disponible desde internet en http://www.fundacionfedna.org/ (con acceso 03/12/2013).
15. FENNEMA, O.R.; DAMODARAN, S.; PARKIN, K.L. 2010. Química de alimentos de Fennema. 4 Ed. ARTMED (Brasil). 1094p.
16. KING, A.; HE, W.; CUEVAS, J.; FREUDENBERGER, M.; RAMIARAMANANA, D.; GRAHAM, I. 2009. Potential of Jatropha curcas as a source of renewable oil and animal feed. J. Exp. Botany. 10:2897-2905.
17. KALAM, M.A.; AHAMED J.U.; MASJUKI, H.H. 2012. Land availability of Jatropha production in Malaysia. Renew. Sustain. Energy Reviews. 16:3999-4007.
18. LAKATOS, V.; OLIVEIRA, W. 2001. Polifosfatos em detergentes em pó comerciais. Quim. Nova. 24(5):700- 708.
19. LIM MENG HON, J. 2010. Jatropha in South East Asia.SEGI Rev. 3(2):118-134.
20. MAKKAR, H.P.S.; BECKER, K.; SPORER, F.; WINK, M. 1997. Studies on nutritive potential and toxic constituents of different provenances of Jatropha curcas. J. Agr. Food. Chem. 45:3152-3157.
21. MAKKAR, H.P.S.; BECKER, K. 1997. Potential of Jatropha curcas seed meal as a protein supplement to livestock feed, constraints to its utilization and possible strategies to overcome constraints. Proceedings of Jatropha 97: International Symposium on Biofuel and Industrial Products from Jatropha curcas and other Tropical Oil Seed Plants. Managua, Nicaragua, February 1997. p.160-166,173-178,190-205.
22. MAKKAR, H.; SIDDHURAJU, P.; BECKER, K.; HARINDER, P.S. 2007. Plant Secondary Metabolites. Methods in Molecular Biology. Ed. Humana Press (Totowa, New Jersey). p.101-105.
23. MAKKAR, H.P.S.; FRANCIS, G.; BECKER, K. 2008. Protein concentrate from Jatropha curcas screw pressed seed cake and toxic and anti-nutritional factors in protein concentrate. J. Sci. Food Agri.88:1542-1548.
24. MARTÍNEZ, J.; SIDDHURAJU, P.; FRANCIS, G.; DÁVILA, G; BECKER, K. 2006. Chemical composition, toxic/antimetabolic constituents, and effects of different treatments on their levels, in four provenances of Jatropha curcas L. from Mexico. Food Chem. 96:80-89.
25. PANDEY, V.C.; SINGH, K.; SINGH, J.S.; KUMARD, A.; SINGHB, B.; SINGHA, R.P. 2012. Jatropha curcas: A potential biofuel plant for sustainable environmental development. Renew. Sustain. Energy Reviews. 16:2870-2883.
26. POMPELLI, M.P.; DOS SANTOS, M.G.; ALMEIDA-CORTEZ, J.S.; MORAIS, A.F. 2011. Fisiologia Vegetal: Uma abordagem práctica. Ed. UFPE (Brasil). p.26- 30.
27. POMPELLI, M.F.; FERREIRA, D.T.R.G.; CAVALCANTE, P.P.G.S.; SALVADOR, T.L.; HSIE, B.S.; ENDRES, L. 2010. Environmental influence on the physicochemical and physiological properties of Jatropha curcas L. Seeds. Australian J. Bot. 58:421-427.
28. RAKSHIT, K.; DARUKESHWARA, J.; RATHINA, K.; NARASIMHAMURTHY, K.; SAIBABA, P.; BHAGYA, S. 2008. Toxicity studies of detoxified Jatropha meal (Jatropha curcas) in rats. Food Chem Tox. 46:3621-3625.
29. ROBLES, G.L. 2008. Alternativas para sostener su ganado en épocas críticas. Disponible desde internet en http://www.engormix.com/MA-ganaderia-carne/articulos/alternativas-sostener-ganado-epocas-t2191/p0.htm (con acceso 02/02/2013).
30. SAETAE, D.; SUNTORNSUK, W. 2011. Toxic Compound, Anti-Nutritional Factors and Functional Properties of Protein Isolated from Detoxified Jatropha curcas Seed Cake. Int. J. Mol. Sci. 12:66-77.
31. WATTIAUX, M.A. 2012. Composición y análisis de alimentos. Wisconsin, Madison. Disponible desde internet en http://vaca.agro.uncor.edu/~pleche/material/babkcoc/02_s.pdf (con acceso 02/16/2013).
Recibido: Junio 30 de 2013 Aceptado: Febrero 19 de 2014

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.