CIENCIAS AGRARIAS-Artículo Científico
COMPARACIÓN DEL PERFIL TIROIDEO EN EL GATO DOMÉSTICO POR GÉNERO Y EDAD
COMPARISON OF THYROID PROFILE IN DOMESTIC CAT BY GENDER
José Henry Osorio 1, Stefania Matheus 2, Jorge Enrique Pérez3
1 Laboratorio de Bioquímica Clínica y Patología Molecular, Departamento de Ciencias Básicas de la Salud, Universidad de Caldas, Manizales (Colombia), e-mail: jose.osorio_o@ucaldas.edu.co
2 Facultad de Ciencias Agropecuarias, Universidad de Caldas, Manizales (Colombia), e-mail: stefymatheus@hotmail.com
3 Laboratorio de Microbiología, Departamento de Ciencias Básicas de la Salud, Universidad de Caldas, Manizales (Colombia), e-mail: labmicro@ucaldas.edu.co Universidad de Manizales. Carrera 9 No 19-03, Manizales (Colombia).
Rev. U.D.C.A Act. & Div. Cient. 17(1): 197-203, Enero-Junio, 2014
RESUMEN
Los niveles séricos de las hormonas tiroideas en el felino doméstico, se analizan para determinar cuál es el rango normal en la especie y para poder identificar si existe o no una posible alteración, ya sea a nivel de la glándula tiroides o a nivel hipofisiario, que resulte en una concentración alta o baja de las mismas. La presente investigación tuvo como objetivo comparar y analizar la correlación entre las concentraciones tiroideas séricas de cuatro grupos de felinos criollos o sus cruces (hembras jóvenes Vs machos jóvenes; hembras adultas Vs machos adultos; hembras jóvenes Vs hembras adultas; machos jóvenes Vs machos adultos). Se obtuvieron 92 muestras sanguíneas de gatos en estado de ayuno, diferenciados por género y edad (46 gatos menores de un año: 21 hembras y 25 machos y 46 gatos mayores de un año: 21 hembras y 25 machos). Se determinaron los niveles de hormona estimuladora de tiroides (TSH) y tetrayodotironina libre (T4L), mediante inmunoensayo enzimático. Para el grupo de los felinos jóvenes, se encontró diferencia estadísticamente significativa en la variable T4L, con P-valor inferior a 0,05 (0,01), con una confidencia del 95%; de igual forma, en el grupo de hembras, se halló una diferencia estadísticamente significativa en esta misma variable, con un P-valor inferior a 0,05 (0,03). Los resultados mostrados por las hembras jóvenes sugieren menores concentraciones del perfil tiroideo con respecto a los machos jóvenes y menores concentraciones, en comparación con hembras adultas
Palabras clave: Felinos, tiroides, hormonas.
SUMMARY
Serum levels of thyroid hormones in cats are analyzed to determine the normal range in the species, and, for identifying a possible alteration either at the level of the thyroid gland or pituitary level, resulting in a high or low concentration of them. The objective of the present research was to compare and analyze the correlation between serum thyroid concentrations of four groups native-born cats or their crosses (females young vs. males young, adult females vs. adult males, females young vs. adult females, males young vs. adult males). Samples from 96 cats in the fasting state, differentiated by gender and age (46 cats under one year: 21 females and 25 males and 46 cats over one year: 21 females and 25 males) were obtained, and the levels of thyroid releasing hormone (TSH) and free tetraiodothyronine (T4L) were measured by enzymatic immunoassay. For the group of young cats statistically significant difference was found in the T4L variable with P value less than 0.05 (0.01) for a confidence of 95%, just as in group of females was found a statistically significant difference in this same variable with a P value less than 0.05 (0.03). The results shown by young females suggests high concentrations of thyroid profile with respect to young males and lower concentrations compared to adult females
Key words: Feline, thyroid, hormones.
INTRODUCCIÓN
Las hormonas tiroideas son los factores principales en el control del metabolismo basal, que interactúan con el núcleo de las células e inician la transcripción de ácido ribonucleico mensajero (ARNm) (Cunningham & Klein, 2009).
La función de estas hormonas es aumentar el consumo de oxígeno de los tejidos (Gunn-Moore, 2005).
Las hormonas tiroideas tienen una influencia profunda en el balance energético. La Triyodotironina (T3) incrementa la tasa del metabolismo basal y ha sido propuesta como reguladora de las proteínas ligadoras, al actuar sobre los genes de estas proteínas, involucradas en los procesos de oxidoreducción mitocondrial y de disipación de calor (Zaninovich, 2001; Matamoros et al. 2002; Cunningham & Klein, 2009). Estas proteínas, se encuentran involucradas en la producción de energía por medio de calor, facilitando la disipación de protones, a través del gradiente electroquímico de la membrana mitocondrial, sin necesidad de ligarse a otro proceso que consuma energía (Birchard, 2006).
Las hormonas tiroideas juegan un papel crucial en el desarrollo y en el funcionamiento fisiológico del sistema nervioso central (Rudas et al. 2003); cuando ocurre una alteración en los niveles de estas hormonas, se producen defectos en la mielinización, migración y diferenciación neuronal, lo cual, se ve reflejado en un retraso mental y problemas neurológicos de carácter irreversible (Kratzsch & Pulzer, 2008). De igual forma, se sabe que las hormonas tiroideas regulan la acción de la calcitonina que, junto con la paratohormona, mantienen la homeostasis del calcio y controlan su depósito y absorción a nivel del hueso, así como su excreción a nivel renal y su absorción en el tracto digestivo (Schenck, 2007); es por eso, que animales con alteración en las hormonas tiroideas pueden presentar defectos en la formación ósea, aumentando, por ende, el número de fracturas y de lesiones a nivel del sistema locomotor (Archer & Taylor, 1996; De Wet et al. 2009).
Cuando hay un exceso de hormonas tiroideas en los felinos (hipertiroidismo), caracterizado por un producción excesiva y secreción crónica de T4 y T3, ocurre una disminución de la condición corporal en un periodo de tiempo relativamente corto, al mismo tiempo, que aumenta el consumo de alimento, observándose un comportamiento anormal (hiperactividad), al igual que aumento de la glándula tiroidea (Bocio) (Peter et al. 1987; Lien et al. 2008; Mori et al. 2008; Boretti et al. 2009); también, se ha documentado enfermedades cardiovasculares, hepáticas y hematológicas, así como infecciones del tracto urinario (ITU) e insuficiencia renal crónica en gatos viejos, debido, posiblemente, a un aumento del fuljo sanguíneo renal (Adams et al. 1997; Kaplan, 2002; Langston& Reine, 2006; Mayer-Roenne et al. 2007). Cuando se sospecha de esta patología, el diagnóstico consiste, primero, en la medición de hormonas tiroideas en suero, principalmente, T4L y TSH (Nelson & Couto, 2000; Shiel & Mooney, 2007). Estudios recientes sugieren que los felinos que prefieren comer enlatados comerciales para gatos presentan significativamente mayor riesgo de padecer hipertiroidismo (Martin et al. 2000; Edinboro et al. 2004).
De igual forma, cuando ocurre una deficiencia de hormonas tiroideas (hipotiroidismo), se observa retraso mental y de crecimiento, con desproporción corporal en relación a la cabeza y letargia marcada (Schaer, 2003). Es común relacionar la obesidad con el hipotiroidismo, pero según estudios realizados, se debe relacionar es con el aumento de leptina que causa obesidad (Ferguson et al. 2007). Esta alteración, se produce principalmente a temprana edad y su diagnóstico debe ser de carácter prematuro, ya que la tasa de mortalidad en los gatos que padecen esta enfermedad es muy elevada (Peterson & Ward, 2007).
Debido a que los trastornos de la tiroides son una causa importante de morbilidad en gatos, principalmente geriátricos y que existen factores que afectan las concentraciones basales de las hormonas tiroideas, como edad, raza, temperatura ambiental, estado nutricional y salud, es necesario conocer los valores de referencias de las hormonas tiroideas, para así poder realizar un diagnóstico preciso y, de esta manera, llevar a cabo un tratamiento adecuado. Dado que existe poca literatura que compare las variables sexo y edad, el objetivo del presente trabajo fue cotejar y analizar la correlación entre las concentraciones tiroideas séricas de cuatro grupos de gatos criollos o sus cruces.
MATERIALES Y MÉTODOS
Se tomaron muestras de sangre de 92 felinos domésticos criollos o cruzados en el departamento de Caldas, Colombia, en estado de ayuno, diferenciados por género y edad: 46 gatos menores de un año: 21 hembras y 25 machos y 46 gatos mayores de un año: 21 hembras y 25 machos. Los animales consumían una dieta a base de alimento balanceado. El tamaño de las muestras fue determinado mediante un cálculo de poblaciones finitas, utilizando el Raosoft Simple Size Calculator (Raosoft, 2004). La toma de las muestras de sangre, se realizó en las horas de la mañana, mediante venopunción en la yugular; se refrigeraron las muestras, mientras se llevaban al laboratorio; luego, se centrifugaron a 3500 rpm en una centrífuga (Thermo de serie IEC CL31 Multispeed), durante 15 minutos; posteriormente, fue extraído el suero, que se conservó a -30°C, hasta su análisis. Para la determinación del T4 libre, se utilizó la prueba de Inmunoensayo enzimático competitivo ELISA de la casa comercial Accubind T4L, Monobind Inc©; brevemente, los sueros fueron colocados en contacto con una fase sólida, que contenía anticuerpos contra la T4, a la cual, se le agregó el conjugado compuesto por T4 libre unido a peroxidasa de rábano (HRP); luego de una hora de incubación a temperatura ambiente, se hizo un lavado para liberar aquellas moléculas no unidas y se agregó el substrato formado por una mezcla de tetrametil bencidina (TMB) y peróxido de hidrógeno disuelto en buffer de acetato, con una incubación de 15 minutos, tiempo, al cabo del cual, se detuvo la reacción al agregarle una solución de ácido clorhídrico 1N (Nelson & Wilcox, 1996; Midgeley, 2001). La lectura se hizo en un equipo lector de microelisas (Titertek multiscanTM), a una absorbancia de 450nm; las absorbancias obtenidas de los estándares se graficaron junto con las concentraciones y de la curva de calibración se obtuvieron las concentraciones de T4 libre, de las respectivas muestras.
Para la determinación de los niveles de TSH (Hormona estimulante del Tiroides), se utilizó una prueba de Inmunoensayo enzimático colorimétrico ELISA tipo sandwich, utilizada para la cuantificación del TSH de origen humano (Accubind TSH-Monobind Inc ®). A una placa de 96 pozos que tenía unidos anticuerpos monoclonales contra la TSH en una interacción estreptavidina-biotina, se le agregó una alícuota de suero obtenido de los felinos y una alícuota de conjugado compuesta de un anticuerpo policlonal (de cabra purificado y IgG de ratón monoclonal marcado con biotina de buffer) contra la TSH, unido a la peroxidasa de rábano; se incubó dos horas a temperatura ambiente, tiempo, al cabo del cual, se lavó la placa con una solución de fosfatos, para eliminar todas aquellas moléculas no unidas y se agregó el substrato formado por una mezcla de tetrametil bencidina (TMB) y de peróxido de hidrógeno; gracias a la presencia de la enzima en el complejo inmune, previamente formado, se produjo la generación de oxígeno a partir de peróxido de hidrógeno, el cual, al actuar sobre la tetrametil bencidina generó un cambio de color, cuya intensidad es proporcional a la concentración de la hormona; para detener la reacción enzimática luego de un periodo de incubación de 15 minutos, se agregó ácido clorhídrico 1N (Hopton & Harrap, 1986) y, posteriormente, se procedió a hacer la lectura en un fotómetro lector de microelisas (Titertek multiscanTM), a una longitud de onda de 450nm. Los resultados obtenidos de los estándares se graficaron frente a sus concentraciones, generándose una curva de calibración, en la cual, se pudieron obtener las concentraciones de cada uno de los sueros probados.
Se establecieron cuatro grupos, de acuerdo con el género y la edad, de la siguiente manera: hembras jóvenes Vs hembras adultas; machos jóvenes Vs machos adultos; hembras jóvenes Vs machos jóvenes; hembras adultas Vs machos adultos.
Para realizar el análisis de los resultados, se empleó el programa estadístico Statgraphics Plus 5.1, mediante el StatAdvisor, procedimiento que realizó un análisis de la varianza simple, realizando varios test y gráficos para comparar los valores de promedio, varianza, desviación estándar y el rango mínimo y máximo para cada una las siguientes variables: TSH y T4L, en cada uno de los cuatro grupos. El F-test en la tabla de ANOVA simple, comprobó la existencia o no de diferencias significativas entre las medias. Para todas las inferencias, se estipularon α = 5%, por debajo del cual se rechazó la hipótesis nula de igualdad entre grupos. La probabilidad fiducial, se evaluó por intervalos de confianza (IC ± 95%). Las estadísticas paramétricas incluyen estimadores de tendencia central (media aritmética) y dispersión (desviación estándar).
RESULTADOS Y DISCUSIÓN
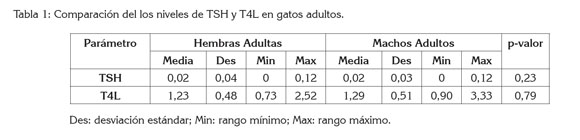
Los valores de forma general de la media y desviación estándar expresados en µUI/mL para TSH fue de 0,07 y 0,35, respectivamente y para T4L (ng/dL) fue de 1,19 y 0,43, respectivamente. Los niveles reportados de las dos variables medidas para cada grupo, se encuentran en las tablas 1, 2, 3 y 4. Los valores de T4L están entre los rangos obtenidos por otros estudios (Peterson et al. 1994; Melián-Limiñana, 1999); sin embargo, no se encuentran reportes de los niveles de TSH en gatos, ya que no existe hoy en día una prueba comercial específica para la TSH felina; no obstante, estudios recientes han demostrado que la TSH canina puede ser útil en el diagnóstico de hipotiroidismo como hipertiroidismo felino, ya que si los valores de TSH son detectables o están dentro de la normalidad, el gato no es enfermo (Deborah & Greco, 2006; Shiel & Mooney, 2007).




Al hacer las comparaciones entre los cuatro grupos (hembras adultas frente a machos adultos, hembras jóvenes frente a macho jóvenes, machos jóvenes frente a machos adultos y hembras jóvenes frente a hembras adultas) con los diferentes datos, se encontró que para TSH no existe diferencia significativa en ninguno de los grupos, puesto que el p-valor del test F es superior o igual a 0,05 (Tablas 1, 2, 3, 4). No fue hallado otro artículo o reporte donde se compare y correlacionen los niveles de TSH en gatos, con los factores de sexo y edad.
Para T4L, se encontró que existen diferencias entre el grupo de hembras jóvenes Vs hembras adultas (Tabla 4), con un nivel de confianza del 95,0%, ya que el p-valor del test F es inferior a 0,05 (p = 0,03), siendo más alto en hembras adultas; de igual forma, el estudio revela que entre hembras jóvenes Vs machos jóvenes hay diferencia estadística significativa con un nivel de confianza del 95,0%, (p = 0,01), donde las hembras jóvenes tienden a presentar niveles superiores de T4L que los machos jóvenes (Tabla 2).
Las anteriores comparaciones tampoco han sido citadas en otras investigaciones, puesto que los reportes expuestos se basan en otros factores, como son comparaciones de gatos sanos con gatos hipertiroideos, encontrando que los niveles de T4L son más altos en estos últimos (Peterson et al. 1994; Melián-Limiñana, 1999).
La mayor relevancia de este estudio consiste en la utilidad de la medición de las hormonas tiroideas para el diagnóstico de las enfermedades tiroideas, como son el hipotiroidismo y el hipertiroidismo en el felino doméstico, pues al no existir claridad en los niveles e intervalos promedio de las hormonas en suero, se dificulta la determinación de estas patologías (Trepanier, 2006). Es por eso, que los ensayos realizados con suero humano son aceptables, pero deben estar completamente validados para su uso con el suero del gato y deben ser modificados para permitir la medición de las concentraciones bajas circulantes de la hormona en esta especie (Peterson, 2006; Van Hoek et al. 2009). Por lo tanto, es fundamental tener en cuenta los múltiples factores que alteran las concentraciones séricas de las hormonas tiroideas en los felinos, entre ellos, la herencia genética, la dieta y la disminución de T4T, debido a enfermedades concurrentes, además de medicamentos que alteran las concentraciones de T4L, como los glucocorticoides, las sulfonamidas potenciadas y los anticonvulsivantes (Schenck, 2005; Peterson & Ward, 2007).
La T4L es la fracción que mejor refleja el estado tiroideo periférico y es el marcador más sensible para evaluar la funcionalidad de la glándula tiroides (Melián-Limiñana, 1999; Shiel & Mooney, 2007). En estudios realizados, la T4L es la hormona que descarta la presencia de hipotiroidismo en gatos jóvenes, con una confiabilidad del 87%, en caso de encontrarse los niveles por debajo del rango establecido (Mooney, 2010).
Por otro lado, al momento de tomar las muestras sanguíneas, se debe manejar adecuadamente la técnica, el almacenamiento y el transporte de las mismas, debido a que estas variables pueden alterar los valores de las hormonas. A su vez, es importante analizar los factores que alteran los niveles normales de la yodotironina, como son la edad, el sexo, la obesidad, los fármacos y algunas enfermedades no relacionadas directamente con la glándula tiroides, ya que estos factores pueden desencadenar un error en el análisis de las muestras y, por lo tanto, la interpretación de los resultados obtenidos (Panciera, 1998).
En la medicina veterinaria de pequeños animales, las enfermedades endocrinas son cada vez más comunes (Watson et al. 2005); en la última década ha aumentado la prevalencia del hipertiroidismo felino en un 20%, en Estados Unidos y el Reino Unido (Brennan & Jones, 2005) y, a pesar de todas las investigaciones realizadas acerca de las patologías, no existen estudios donde se correlacione la edad y el sexo en gatos sanos.
Este estudio revela una actualización en los niveles séricos de las hormonas tiroideas. Igualmente, dadas las diferencias en las comparaciones entre grupos para el perfil tiroideo en gatos, pueden ser considerados cuatro perfiles tiroideos así: machos adultos, hembras adultas, machos jóvenes y hembras jóvenes, teniendo en cuenta que las hembras jóvenes son las que presentan menor concentración de T4L; sin embargo, hay que tener claro que es un campo muy inexplorado y que existen pocos estudios donde se comparen y correlacionen los diferentes factores (edad, sexo, alimentación, ambiente, medicamentos), que influyen en los niveles de las hormonas tiroideas.
Agradecimientos: A Yirly Johanna Suárez Vela, del programa jóvenes investigadores de Colciencias, por realizar las correcciones del manuscrito. Conflicto de intereses: El artículo fue elaborado con la participación y revisión de los autores, quienes declaramos que no existe ningún conflicto de intereses que ponga en riesgo la validez de los resultados obtenidos. Financiación: Este estudio fue financiado por la Universidad de Caldas.
BIBLIOGRAFÍA
1. ADAMS, W.H.; DANIEL, G.B.; LEGENDRE, A.M. 1997. Investigation of the effects of hyperthyroidism on renal function in the cat. Can. J. Vet.Res. 61:53-56.
2. ARCHER, F.J.; TAYLOR, S.M. 1996. Alkaline phosphatase bone isoenzyme and osteocalcin in the serum of hyperthyroid cats. Can. Vet. J. 37:735-739.
3. BIRCHARD, S.J. 2006. Thyroidectomy in the cat. Clin Tech Small Anim Pract. 21(1):29-33.
4. BORETTI, F.S.; SIEBER-RUCKSTUHL, N.A.; GERBER, B.; LALUHA, P.; BAUMGARTNER, C.C.; LUTZ, H. 2009. Thyroid enlargement and its relationship to clinicopathological parameters and T4 status in suspected hyperthyroid cats. J. Fel. Med. Surg. 11(4):286-292.
5. BRENNAN, S.F.; JONES, B.R. 2005. Feline hyperthyroidism. EJCAP. 15(2):169-172.
6. CUNNINGHAM, J.G.; KLEIN, B.G. 2009. Fisiología Veterinaria. 4ta ed. Barcelona, España: Elsevier Saunders. p. 430-436.
7. DEBORAH, S.; GRECO. 2006. Diagnosis of congenital and adult-onset hypothyroidism in cats. Clin Tech Small Anim Pract 21:40-44.
8. DE WET, C.S.; MOONEY, C.T.; THOMPSON, P.N.; SCHOEMAN, J.P. 2009. Prevalence of and risk factors for feline hyperthyroidism in Hong Kong. J Feline Med Surg. 11(4):315-321.
9. EDINBORO, C.H.; SCOTT-MONCRIEFF, J.C.; JANOVITZ, E.; THACKER, H.L.; GLICKMAN, L.T. 2004. Epidemiologic study of relationships between consumption of commercial canned food and risk of hyperthyroidism in cats. J. Am. Vet. Med. Assoc. 224(6):879-886.
10. FERGUSON, D.C.; CAFFALL, Z.; HOENIG, M. 2007. Obesity increases free thyroxine proportionally to nonesterified fatty acid concentrations in adult neutered female cats. J. Endocrin. 194(2):267-273.
11. GUNN-MOORE, D. 2005. Feline endocrinopathies. Vet Clin Small Anim. 35(1):171-210.
12. HOPTON, M.R.; HARRAP, J.J. 1986. Inmunoradiometric assay of thyrotropinas as a first line thyroid function test in the routine laboratory. Clin. Chem. 32:691-691.
13. KAPLAN, E. 2002. Primary hyperparathyroidism and concurrent hyperthyroidism in a cat. Can. Vet J. 43(2):117-119.
14. KRATZSCH, J.; PULZER, F. 2008. Thyroid gland development and defects. Best Practice Res. Clin. Endocrin. Metabol. 22(1):57-75.
15. LANGSTON, C.E.; REINE, N.J. 2006. Hyperthyroidism and the kidney. Clin. Tech. Small Anim. Pract. 21(1):17-21.
16. LIEN, Y.H.; WU, T.J.; HUANG HP. 2008. Evaluation of a point-of-care enzyme-linked immunosorbent assay for determination of basal serum total thyroxine concentration in cats. JVCS. 1(3):86-88.
17. MARTIN, K.M.; ROSSING, M.A.; RYLAND, L.M.; DIGIACOMO, R.F.; FREITAG, W.A. 2000. Evaluation of dietary and environmental risk factors for hyperthyroidism in cats. J. Am. Vet. Med. Assoc. 217(6):853-856.
18. MATAMOROS, R.; GÓMEZ, C.; ANDAUR, M. 2002. Hormonas de utilidad diagnóstica en Medicina Veterinaria. Arch. Med. Vet. 34(2):167-179.
19. MAYER-ROENNE, B.; GOLDSTEIN, R.E.; ERB, H.N. 2007. Urinary tract infections in cats with hyperthyroidism, diabetes mellitus and chronic kidney disease. J. Feline Med. Surg. 9(2):124-132.
20. MELIÁN-LIMIÑANA, C. 1999. Diagnóstico de hipotiroidismo canino e hipertiroidismo felino. Vector plus: Miscelánea científico cultural. 13:4-18.
21. MIDGELEY, J. 2001. Direct and indirect free thyroxine assay methods in theory and practice. Clin. Chem. 47:1353-1363.
22. MOONEY, C.T. 2010. The effects of non-thyroidal factors on tests of thyroid function. Small Animal Medicine and Feline Medicine Chapters. p.28-30. Disponible desde Internet en: http://samedicine.anzcvs.org.au/samedicine/science_week_proceedings/2010/the%20effects%20of%20non-thyroidal%20factors%20on%20tests%20of%20thyroid%20 function%20-%20carmel%20t%20mooney.pdf (con acceso 26/08/13).
23. MORI, D.A.; CUNHA, M.G.; PIPPI, N.L.; GOMES, K.; BECKMANN, D.V. 2008. Hipertireoidismo feline. Ciencia Rural. 38(5):1486-1494.
24. NELSON, J.C.; WILCOX, R.B. 1996. Analytical perfomance of free and total thyroxine assays. Clin. Chem. 42:146-154.
25. NELSON, R.W.; COUTO, G.C. 2000. Medicina interna de animales pequeños. 2da ed. Buenos Aires-República Argentina: Intermédica. p. 766-777.
26. PANCIERA, D.L. 1998. Manual of Small Animal Endocrinology. 2nd ed. United Kingdom: British Small Animal Veterinary Association; 1998. p.103-113.
27. PETER, H.J.; GERBER, H.; STUDER, H.; BECKER, D.V.; PETERSON, M.E. 1987. Autonomy of growth and of iodine metabolism in hyperthyroid feline goiters transplanted onto nude mice. J. Clin. Invest. 80(2):49-498.
28. PETERSON, M.E.; BROUSSARD, J.D.; GAMBLE, D.A. 1994. Use of the thyrotropin releasing hormone stimulation test to diagnose mild hyperthyroidism in cats. J. Vet. Intern. Med. 8:279-286.
29. PETERSON, M.E.; WARD, C.R. 2007. Aspectos etiopatológicos del hipertiroidismo felino. Vet. Clin. Small Anim. 37:633-645.
30. PETERSON, M.E. 2006. Diagnostic Tests for Hyperthyroidism in Cats. Clin. Techn. Small Anim. Pract. 21(1):2-9.
31. RAOSOFT. 2004. Sample size calculator. Disponible desde Internet en: http://www.raosoft.com/samplesize.html (con acceso el 19/07/2013).
32. RUDAS, P.; RÓNAI, Z.; BARTHA, T. 2003. Thyroid hormone metabolism in the brain of domestic animals. Dom. Anim. Endocrin. 29(1):88-96.
33. SCHAER, M. 2003. Clinical medicine of the Dog and Cat 2end edition. Londres, InglaterraS: Manson Publishing Ltd; p.364-389.
34. SCHENCK, P.A. 2005. Effect of diet on development of feline hyperthyroidism. Proceeding of the NAVC . Orlando, Florida. p.608-610.
35. SCHENCK, P.A. 2007. Calcium Homeostasis in Thyroid Disease in Dogs and Cats. Vet. Clin. Small Anim. 37(4):693-708.
36. SHIEL, R.E.; MOONEY, C.T. 2007. Pruebas de hipertiroidismo en gatos. Vet. Clin. Small Anim. 37:671-691.
37. TREPANIER, L.A. 2006. Medical Management of Feline Hyperthyroidism. Vet. Clin, Small Anim. 21(1):22-28.
38. VAN HOEK, I.M.; PEREMANS, K.; VANDERMEULEN, E. 2009. Effect of recombinant human thyroid stimulating hormone on serum thyroxin and thyroid scintigraphy in euthyroid cats. J. Feline Med. Surg. 11:309-314.
39. WATSON, S.G.; RADFORD, A.D.; KIPAR, A.; IBARROLA, P.; BLACKWOOD, L. 2005. Somatic mutations of the thyroid-stimulating hormone receptor gene in feline hyperthyroidism: parallels with human hyperthyroidism. J. Endocrin. 186(3):523-537.
40. ZANINOVICH, A.A. 2001. Hormonas tiroideas, obesidad y termogénesis en grasa parda. Medicina. 61:597- 602.
Recibido: Julio 19 de 2013 Aceptado: Noviembre 22 de 2013

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.